- •1.Динамическое состояние белков в организме.Катепсины.
- •2.Пищевые белки как источник ак. Переваривание белков.
- •3.Протеиназы жкт.Субстратная специфичность протеиназ.
- •4.Проферменты протеиназ, механизм превращения в ферменты.Биологическое значение.
- •5.Пепсин, роль, методы количественного определения.
- •6.Экзопептидазы.Их роль в переваривании белков.
- •13. Общая схема источников и путей расходования аминокислот (с лекций)
- •15. Специфичность трансаминаз, коферментная функция вит в6
- •16. Особая роль глутамата в р-ях трансаминирования
- •17. Биологическое значение р-ции трансаминирования
- •19) Окислительное дезаминирование аминокислот, химизм, ферменты , биологическое значение
- •21)Непрямое дезаминирование , транс-дезаминирование, химизм, биологическая роль
- •23) Биогенные амины,происхождение,функции
- •Вопрос 32 Недостаточность фолиевой кислоты и витамина в12. Антивитамины фолиевой кислоты. Механизм действия сульфаниламидных препаратов.
- •Вопрос 33. . Обмен фенилаланина и тирозина. Все пути превращения в норме.
- •1 Реакция – тирозинаминотрансфераза
- •Вопрос 34 - Фенилкетонурия, биохимический дефект, проявление болезни, диагностика, лечение.
- •Вопрос 35. Алкаптонурия, альбинизм. Биохимический дефект, проявление болезней.
- •Вопрос 36 Нарушения синтеза дофамина при паркинсонизме.
- •Вопрос 37 Конечные продукты азотистого обмена: соли аммония и мочевина.
- •46. Распад нуклеиновых кислот, нуклеазы пищеварительного тракта и тканей.
- •49. Инозиновая кислота как предшественник пуриновых мононуклеотидов
- •51. Биосинтез пиримидиновых нуклеотидов.
- •52. Регуляция биосинтеза пуриновых и пиримидиновых мононуклеотидов
- •53. Биосинтез дезоксирибонуклеотидов
- •54. Применение ингибиторов синтеза дезоксирибонуклеотидов для лечения злокачественных опухолей.(тут я мало что нашел…)
- •55. Нарушения обмена нуклеотидов: оротацидурия, ксантинурия. (ксантинурия маловато)
- •56. Подагра, причины возникновения. Применение аллопуринола для лечения подагры.
- •58.Биосинтез(репликация) днк,общая характеристика процесса, биологическое значение. Этапы репликации.
- •60. Синтез днк и фазы клеточного деления. Роль циклинов и циклинзависимых протеинкиназ в продвижении клетки по клеточному циклу.
- •61.Повреждение и репарация днк. Днк- репарирующий комплекс, механизм процесса и условия репарации.
- •62. Биосинтез рнк. Особенности процесса транскрипции, этапы рнк- полимеразы, их роль.
- •63. Понятие о мозаичной структуре генов, первичном транскрипте; механизм созревания рнк (посттранскрипционный процессинг).
- •64. Биосинтез белков. Понятие о коллинеарности кода. Этапы процесса.
- •65. Биосинтез белков. Основные компоненты белоксинтезирующей системы. Биосинтез и созревание м-рнк.
- •66. Понятие о биологическом коде, свойства биологического кода. Универсальность биологического кода и процессов биосинтеза белка.
- •67. Транспортная рнк как адаптор аминокислот. Биосинтез аминоацил-т-рнк.
- •68. Субстратная специфичность арс-аз, их роль. Изоакцепторные т-рнк. (часть не нашла)
23) Биогенные амины,происхождение,функции
Образуются при декарбоксилирование аминокислот ферментами декорбаксилазами. К биогенным аминам относят дофамин,норадреналин,адреналин( синтезируются изначально из аминокислоты тирозина), серотонин, мелотанин( синтезируются из триптофана) Многие амины могут выполнять роль гормонов и нейромедиаторов

Амины, образовавшиеся при декарбоксилировании аминокислот, часто являются биологически активными веществами. Они выполняют функцию нейромедиаторов (серотонин, дофамин, ГАМК и др.), гормонов (норадреналин, адреналин), регуляторных факторов местного действия (гистамин, карнозин, спермин и др.). Серотонин может превращаться в гормон мелатонин, регулирующий суточные и сезонные изменения метаболизма организма и участвующий в регуляции репродуктивной функции.
|
Амино- кислоты |
Серии |
Триптофан |
Тирозин |
Глутами- новая кислота |
Гистидин |
Орнитин Лизин |
|
Продукты декарбокси- лирования |
Этаноламин |
Триптамин |
|
γ-амино- масляная кислота |
Гистамин |
Путресцин Кадаверин |
|
Биологичес- ки активные вещества |
Ацетилхолин |
Серотонин |
Дофамин |
ГАМК |
Гистамин |
Спермидин (и спермин) |
|
Формулы |
|
|
|
|
|
|
|
Физиологи- ческая роль |
Возбуждаю- щий медиаторвегетативной нервной системы |
Возбуждающий медиатор средних отделов мозга |
Медиатор среднего отдела мозга |
Тормозной медиатор высших отделов мозга |
Медиатор воспаления, аллергических реакции, пищеваритель- ный гормон |
Изменяют степень агрегации полисом. Регулируют синтез РНК и белка |
В организме биогенные амины подвергаются реакции окислительного дезаминирования с образованием альдегидов и аммиака. Процесс осуществляется при участии моноаминооксидаз.
Схематически механизм трансдезаминирования можно представит так:

24)Образование серотонина и гистамина. Роль аминов
Гистамин образуется путем декарбоксилирования гистидина в тучных клетках соединительной ткани
Гистамин образует комплекс с белками и сохраняется в секреторных гранулах тучных клеток. Секретируется в кровь при повреждении ткани (удар, ожог, воздействие эндо- и экзогенных веществ), развитии иммунных и аллергических реакций. Гистамин выполняет в организме человека следующие функции:
стимулирует секрецию желудочного сока, слюны (т.е. играет роль пищеварительного гормона);
повышает проницаемость капилляров, вызывает отёки, снижает АД (но увеличивает внутричерепное давление, вызывает головную боль);
сокращает гладкую мускулатуру лёгких, вызывает удушье;

Схема А

участвует в формировании воспалительной реакции - вызывает расширение сосудов, покраснение кожи, отёчность ткани;
вызывает аллергическую реакцию;
выполняет роль нейромедиатора;
является медиатором боли.
Серотонин - нейромедиатор проводящих путей. Образуется в надпочечниках и ЦНС из аминокислоты 5-гидрокситриптофана в результате действия декарбоксилазы ароматических аминокислот. Этот фермент обладает широкой специфичностью и способен также декарбоксилировать триптофан и ДОФА, образующийся из тирозина. 5-Гидрокситриптофан синтезируется из триптофана под действием фенилаланингидроксилазы с коферментом Н4БП (этот фермент обладает специфичностью к ароматическим аминокислотам и гидроксидирует также фенилаланин) (см. схему ниже).
Серотонин может превращаться в гормон мелатонин, регулирующий суточные и сезонные изменения метаболизма организма и участвующий в регуляции репродуктивной функции.
Серотонин - биологически активное вещество широкого спектра действия. Он стимулирует сокращение гладкой мускулатуры, оказывает сосудосуживающий эффект, регулирует АД, температуру тела, дыхание, обладает антидепрессантным действием. По некоторым данным он может принимать участие в аллергических реакциях, поскольку в небольших количествах синтезируется в тучных клетках.
Вопрос № 25
Образование катехоламинов и ГАМК, функции аминов.
В мозговом веществе надпочечников и нервной ткани тирозин является предшественником катехоламинов( дофамина, норадреналина, адреналина).
При образовании катехоламинов и меланина (в меланоцитах) промежуточным продуктом служит диоксифенилаланин (ДОФА). Однако гидроксилирование тирозина в клетках различных типов катализируется различными ферментами:
- Тиразиназа ( Cu-зависимый фермент)
- Тирозингидроксилаза (1)
- ДОФА – декарбоксилаза (2)
- дофамингидроксилаза (3)
- фенилэтаноламин-N-метилтрансфераза (4)
дофамин и норадреналин служат медиаторами в синаптической передаче нервных импульсов, а адреналин – гормон широкого спектра действия, регулирующий энергетический обмен. Одна из функций катехоламинов – регуляция деятельности ССС.

В нервных клетках декарбоксилирование глутамата (отщепление а-карбоксильной группы) приводит к образованию γ-Аминомасляной кислоты(ГАМК), которая служит основным тормозным медиатором высших отделов мозга. Содержание ГАМК в головном мозге в десятки раз выше других нейромедиаторов. Она увеличивает проницаемость постсинаптическизх мембран для ионов К+, что вызывает торможение нервного импульса, повышает дыхательную активность нервной ткани, улучшает кровоснабжение головного мозга.

Функции аминов:
Амины, образовавшиеся при декарбоксилировании аминокислот, часто являются биологически активными веществами. Они выполняют функцию нейромедиаторов (серотонин, дофамин, ГАМК и др.), гормонов (норадреналин, адреналин), регуляторных факторов местного действия (гистамин, карнозин, спермин и др.).
Вопрос № 26
Окислительное дезаминирование и гидроксилирование биогенных аминов.
Для осуществления биологической функции в нервных клетках требуется определённая концентрация биогенных аминов. Избыточное накопление их может вызывать различные патологические отклонения. В связи с этим большое значение приобретают механизмы инактивации биогенных аминов.
окислением ферментами моноаминооксидазами (МАО) с коферментом FAD - таким путем чаще происходит инактивация дофамина, норадреналина, серотонина, ГАМК. При этом происходит окислительное дезаминирование биогенных аминов с образованием альдегидов, а затем соответствующих кислот, которые выводятся почками

метилированием с участием SAM под действием метилтрансфераз. Таким образом могут инактивироваться различные биогенные амины, но чаще всего происходит инактивация гастамина и адреналина. Так, инактивация адреналина происходит путём метилирования гидроксильной группы в ортоположении (см. схему ниже). Реакция инактивации гистамина также преимущественно происходит путём метилирования

Вопрос № 27
Трансметилирование, метионин и S-аденозилметионин.
Метионин - незаменимая аминокислота. Она необходима для синтеза белков организма, участвует в реакциях дезаминирования, является источником атома серы для синтеза цистеина. Метионил-тРНК участвует в инициации процесса трансляции.
Метильная группа метионина - мобильный одноуглеродный фрагмент, используемый для синтеза ряда соединений. Перенос метильной группы метионина на соответствующий акцептор называют реакцией трансметилирования, имеющей важное метаболическое значение. Метильная группа в молекуле метионина прочно связана с атомом серы, поэтому непосредственным донором этого одноутлеродного фрагмента служит активная форма аминокислоты.
Реакция активация метионина
Активной формой метионина является S-аденозилметионин (SAM) - сульфониевая форма аминокислоты, образующаяся в результате присоединения метионина к молекуле аденозина. Аденозин образуется при гидролизе АТФ (см. схему А).
Эту реакцию катализирует фермент метионин аденозилтрансфераза, присутствующий во всех типах клеток. Структура (-S+-CH3) в SAM - нестабильная группировка, определяющая высокую активность метильной группы (отсюда термин "активный метионин"). Эта реакция уникальна для биологических систем, так как, по-видимому, является единственной известной реакцией, в результате которой освобождаются все три фосфатных остатка АТФ.
Отщепление
метильной группы от SAM и перенос её на
соединение-акцептор катализируют
ферменты метилтрансферазы. SAM в ходе
реакции превращается в S-аденозилгомоцистеин
(SAГ).
Вопрос № 28
Синтез креатина, адреналина, фосфатидилхолина, их биологическая роль.
Фосфатидилхолины (лецитины) - наиболее распространённая группа глицерофосфолипидов, участвующих в образовании мембран клеток и липопротеинов, в составе которых осуществляется транспорт липидов

Синтез креатина
Креатин необходим для образования в мышцах высокоэнергетического соединения - кре-атинфосфата. Синтез креатина идёт в 2 стадии с участием 3 аминокислот: аргинина, глицина и метионина. В почках образуется гуанидинацетат при действии глицинамидинотрансферазы
Затем гуанидинацетат транспортируется в печень, где происходит реакция его метилирования
Креатин с кровотоком переносится в мышцы и клетки мозга, где из него образуется высокоэнергетическое соединение - креатинфосфат.
Эта реакция легко обратима и катализируется ферментом креатинкиназой. Фермент локализован в цитозоле и митохондриях клеток, обладает органоспецифичностью. В норме активность его в крови очень мала. Обнаружено три изоферментные формы креатинкиназы (см. раздел 2).
Креатинфосфат играет важную роль в обеспечении энергией работающей мышцы в начальный период. В результате неферментативного дефосфорилирования, главным образом в мышцах, креатинфосфат превращается в креатинин, выводимый с мочой. Суточное выделение кре-атинина у каждого индивидуума постоянно и пропорционально общей мышечной массе


Вопрос № 29 ( ребят..ну эээ….ну в общем как-то так, если вдруг на меня снизойдет озарение, то количество инфы возрастет)
Метилирование чужеродных и лекарственных соединений.
Метилирование — простой химический процесс, при котором метильная группа — атом углерода и три атома водорода — связывается с другими молекулами.
В тканях человека, особенно в печени, происходит метилирование чужеродных и лекарственных соединений ( амины, фенолы, тиоловые соединения и др.) с образованием N -, О - и S-метиловых конъюгатов. При этом часто изменяется биологическая активность веществ.
Так метилирование диметилсульфатом используют при синтезе лекарственных веществ, например, анальгина; в производстве амидоприна метилирование осуществляют формальдегидом и восстановительным агентом – обычно муравьиной кислотой.
Вопрос № 30
Роль серина и глицина в образовании одноуглеродных групп.
Образование и использование одноуглеродных фрагментов
Особое значение реакций катаболизма серина и глицина заключается в том, что они сопровождаются образованием одноуглеродного метиленового фрагмента (-СН2-). Метиленовая группа в молекуле метилен- Н4-фолата может превращаться в другие одноуглеродные группы (фрагменты): метенильную (-СН=), формильную (-НС=О), метильную (-СН3) и формиминогруппу (-CH=NH) (рис. 9-25).
Ещё один источник формального и форми-мино-фрагментов - гистидин. Катаболизм гистидина происходит только в печени (очень небольшой процент в коже) в результате следующих реакций (см. схему на с. 498).
Конечными продуктами катаболизма гистидина являются глутамат, NH3 и одноуглеродные фрагменты - формимино-Н4-фолат и формил-Н4-фолат.
Все образующиеся производные Н4-фолата играют роль промежуточных переносчиков и служат донорами одноуглеродных фрагментов при синтезе некоторых соединений: пуриновых оснований и тимидиловой кислоты (необходимых для синтеза ДНК и РНК), регенерации метионина, синтезе различных формиминопроизводных (формиминоглицина и т.д.)
Перенос одноуглеродных фрагментов к акцептору необходим не только для синтеза ряда соединений, но и для регенерации свободного Н4-фолата в печени.
31.Тетрагидрофолиевая кислота, роль в синтезе и использовании одноуглеродных радикалов. Метилирование гомоцистеина
Ферменты, коферментами которых служат производные фолиевой кислоты играют большую роль в превращениях серина и глицина. Фолиевая кислота – это витамин В9.
-
Фолиевая кислота

Коферментную функцию выполняет восстановленная форма фолата – тгфк(или Н4-фолат):

Фолиевая кислота в печени превращается в Н4-фолат в несколько стадий с участием ферментов фолатредуктазы и дигидрофолатредуктазы, коферментом которых служит NADPH.
Особое значение реакций катаболизма серина и глицина заключается в том, что они сопровождаются образованием одноуглеродного метиленового фрагмента (-СН2-), переносчиком которого и является тгфк.
(реакции чисто для наглядности):


Метиленовая группа в молекуле метилен- Н4-фолата может превращаться в другие одноуглеродные группы (фрагменты): метенильную (-СН=), формильную (-НС=О), метильную (-СН3) и формиминогруппу (-CH=NH)
Таким образом главная роль тгфк - перенос одноуглеродных фрагментов. Они также могут использоваться в дальнейшем для синтеза некоторых соединений: пуриновых оснований и тимидиловой кислоты (необходимых для синтеза ДНК и РНК).
Собственно куда именно присоединяется :

Реакции метилирования играют важную роль в организме и протекают очень интенсивно. Это вызывает большой расход метионина, так как он является незаменимой аминокислотой (в клетках метионин синтезироваться не может). Метионин - незаменимая аминокислота. Активной формой метионина является S-аденозилметионин (SAM) - сульфониевая форма аминокислоты, образующаяся в результате присоединения метионина к молекуле аденозина.

Отщепление метильной группы от SAM и перенос её на соединение-акцептор катализируют ферменты метилтрансферазы. SAM в ходе реакции превращается в S-аденозилгомоцистеин (SAT).
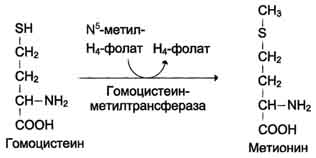
S-аденозилгомоцистеин при действии гидролазы расщепляется на аденозин и гомоцистеин.
S-аденозилгомоцистеин + Н2О → Аденозин + Гомоцистеин
Гомоцистеин может снова превращаться в метионин под действием гомоцистеинметилтранс феразы. Донором метильной группы в этом слу чае служит N5-метил-Н4-фолат.
Метилирование гомоцистеина:
Метионин - незаменимая аминокислота, однако может регенерироваться из гомоцистеина. Следовательно, незаменим именно гомоцистеин, но единственным его источником в организме служит метионин. В пище гомоцистеина крайне мало, поэтому потребности человека в метиони-не и гомоцистеине обеспечиваются только метионином пищи.