
- •1.Динамическое состояние белков в организме.Катепсины.
- •2.Пищевые белки как источник ак. Переваривание белков.
- •3.Протеиназы жкт.Субстратная специфичность протеиназ.
- •4.Проферменты протеиназ, механизм превращения в ферменты.Биологическое значение.
- •5.Пепсин, роль, методы количественного определения.
- •6.Экзопептидазы.Их роль в переваривании белков.
- •13. Общая схема источников и путей расходования аминокислот (с лекций)
- •15. Специфичность трансаминаз, коферментная функция вит в6
- •16. Особая роль глутамата в р-ях трансаминирования
- •17. Биологическое значение р-ции трансаминирования
- •19) Окислительное дезаминирование аминокислот, химизм, ферменты , биологическое значение
- •21)Непрямое дезаминирование , транс-дезаминирование, химизм, биологическая роль
- •23) Биогенные амины,происхождение,функции
- •Вопрос 32 Недостаточность фолиевой кислоты и витамина в12. Антивитамины фолиевой кислоты. Механизм действия сульфаниламидных препаратов.
- •Вопрос 33. . Обмен фенилаланина и тирозина. Все пути превращения в норме.
- •1 Реакция – тирозинаминотрансфераза
- •Вопрос 34 - Фенилкетонурия, биохимический дефект, проявление болезни, диагностика, лечение.
- •Вопрос 35. Алкаптонурия, альбинизм. Биохимический дефект, проявление болезней.
- •Вопрос 36 Нарушения синтеза дофамина при паркинсонизме.
- •Вопрос 37 Конечные продукты азотистого обмена: соли аммония и мочевина.
- •46. Распад нуклеиновых кислот, нуклеазы пищеварительного тракта и тканей.
- •49. Инозиновая кислота как предшественник пуриновых мононуклеотидов
- •51. Биосинтез пиримидиновых нуклеотидов.
- •52. Регуляция биосинтеза пуриновых и пиримидиновых мононуклеотидов
- •53. Биосинтез дезоксирибонуклеотидов
- •54. Применение ингибиторов синтеза дезоксирибонуклеотидов для лечения злокачественных опухолей.(тут я мало что нашел…)
- •55. Нарушения обмена нуклеотидов: оротацидурия, ксантинурия. (ксантинурия маловато)
- •56. Подагра, причины возникновения. Применение аллопуринола для лечения подагры.
- •58.Биосинтез(репликация) днк,общая характеристика процесса, биологическое значение. Этапы репликации.
- •60. Синтез днк и фазы клеточного деления. Роль циклинов и циклинзависимых протеинкиназ в продвижении клетки по клеточному циклу.
- •61.Повреждение и репарация днк. Днк- репарирующий комплекс, механизм процесса и условия репарации.
- •62. Биосинтез рнк. Особенности процесса транскрипции, этапы рнк- полимеразы, их роль.
- •63. Понятие о мозаичной структуре генов, первичном транскрипте; механизм созревания рнк (посттранскрипционный процессинг).
- •64. Биосинтез белков. Понятие о коллинеарности кода. Этапы процесса.
- •65. Биосинтез белков. Основные компоненты белоксинтезирующей системы. Биосинтез и созревание м-рнк.
- •66. Понятие о биологическом коде, свойства биологического кода. Универсальность биологического кода и процессов биосинтеза белка.
- •67. Транспортная рнк как адаптор аминокислот. Биосинтез аминоацил-т-рнк.
- •68. Субстратная специфичность арс-аз, их роль. Изоакцепторные т-рнк. (часть не нашла)
13. Общая схема источников и путей расходования аминокислот (с лекций)
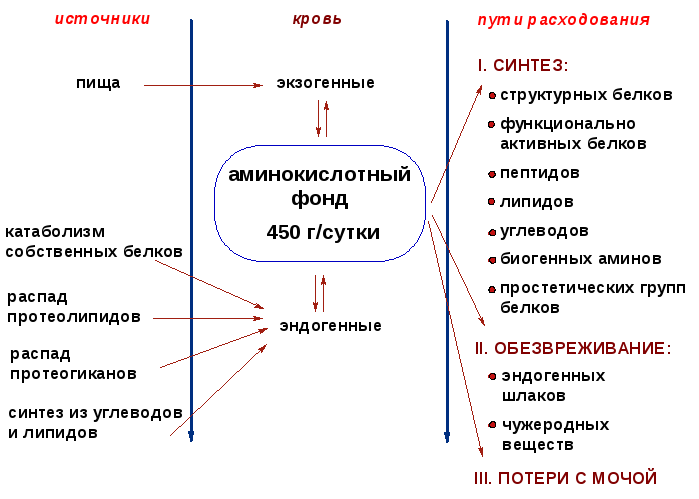
14. Трансаминирование аминокислот, химизм, ферменты. Ак участвующие в трансаминировании
Трансаминирование
– р-ции межмолекулярного переноса
аминогруппы от ак на L-кетокислоту
без промежуточного образования аммиака.
Является обратимой, донорно-акцепторная
связь (донор-любая кислота, акцептор
L-кк)
Р-ции протекают при участии специфических ферментов, названных А.Е. Браунштейном аминоферазами ( по соврем классификации- аминотрансферазы или аминотрансаминазы)
Все трансаминазы сод-т один и тот же кофермент – пиридоксальфосфат (ПФ- производноеvit B6 )
Ферменты трансаминирования переносят NH2-группу не на L-кк, а сначала на кофермент ПФ. Реакции трансаминирования идут в 2 стадии: в первой - к ПФ присоединяется NH2 гр от первого субстрата- аминокислоты, образуется комплекс фермент-пиридоксаминфосфат и кетокислота- первый продукт р-ции. Этот процесс включает промежуточное образование 2 шиффовых оснований; на второй стадии комплекс фермент-пиридоксаминфосфат соединяется с кетокислотой (второй субстрат) и снова через промежуточное образование 2 шиффовых оснований передают аминогруппу на кетокислоту, в результате фермент возвращается в свою нативную форму, и образуется новая аминокислота- второй продукт реакции. В р-ции вступают все ак, кроме лизина, треонина, пролина

15. Специфичность трансаминаз, коферментная функция вит в6
Трансаминазы- специфические ферменты, которые сод-т один и тот же кофермент – пиридоксальфосфат (ПФ- производное vitB6 ). Трансаминаза специфична только к донорно-акцепторной связи. ПФ-источник трансаминазы и дезаминирования.Чаще всего в реакциях трансаминирования участвуют аминокислоты, содержание которых в тканях значительно выше остальных - глутамат, аланин, аспартат и соответствующие им кетокислоты - α-кетоглутарат, пируват и оксалоацетат. Основным донором аминогруппы служит глутамат.
Суммарно эти реакции можно представить в виде схемы:

Акцептором аминогруппы любой аминокислоты, подвергающейся трансаминированию (аминокислота 1), служит α-кетоглутарат. Принимая аминогруппу, он превращается в глутамат, который способен передавать эту группу любой α-кетокислоте с образованием другой аминокислоты (аминокислота 2).
Аминотрансферазы обладают субстратной специфичностью к разным аминокислотам. В тканях человека обнаружено более 10 разных аминотрансфераз. Наиболее распространёнными ферментами в большинстве тканей млекопитающих являютсяаланинаминотрансфераза (АЛТ), по обратной реакции - глутамат-пируватаминотрансфераза(ГПТ) и аспартатаминотрансфераза (ACT), по обратной реакции - глутамат-оксалоацетатаминотрансфераза (ГОТ).
АЛТ (АлАТ) катализирует реакцию транса-минирования между аланином и α-кетоглутаратом. Локализован этот фермент в цитозоле клеток многих органов, но наибольшее его количество обнаружено в клетках печени и сердечной мышцы.
ACT (АсАТ) катализирует реакцию трансами-нирования между аепартатом и α-кетоглутаратом аналогично предыдущей. В результате образуются оксалоацетат и глутамат. ACT имеет как цитоплазматическую, так и митохондриальную формы. Наибольшее его количество обнаружено в клетках сердечной мышцы и печени. Так как наибольшее количество АЛТ и ACT сосредоточено в печени и миокарде, а содержание в крови очень низкое, можно говорить об органоспецифичности этих ферментов.
В результате работы аминотрансфераз аминный азот многих аминокислот переходит в состав глутамата. Есть основания считать, что накопление аминогрупп в форме глутаминовой кислоты происходит в цитозоле. Затем глутамат с помощью транслоказ попадает в митохондрии, где активна специфическая ACT. В результате действия этого фермента глутамат снова превращается в α-кетоглутарат. Последний используется для непрямого дезаминирования аминокислот, содержащихся в митохондриях. Это очень важно, так как только глутамат в тканях млекопитающих наиболее быстро может подвергаться окислительному дезаминированию (см. ниже).
