
- •1.Динамическое состояние белков в организме.Катепсины.
- •2.Пищевые белки как источник ак. Переваривание белков.
- •3.Протеиназы жкт.Субстратная специфичность протеиназ.
- •4.Проферменты протеиназ, механизм превращения в ферменты.Биологическое значение.
- •5.Пепсин, роль, методы количественного определения.
- •6.Экзопептидазы.Их роль в переваривании белков.
- •13. Общая схема источников и путей расходования аминокислот (с лекций)
- •15. Специфичность трансаминаз, коферментная функция вит в6
- •16. Особая роль глутамата в р-ях трансаминирования
- •17. Биологическое значение р-ции трансаминирования
- •19) Окислительное дезаминирование аминокислот, химизм, ферменты , биологическое значение
- •21)Непрямое дезаминирование , транс-дезаминирование, химизм, биологическая роль
- •23) Биогенные амины,происхождение,функции
- •Вопрос 32 Недостаточность фолиевой кислоты и витамина в12. Антивитамины фолиевой кислоты. Механизм действия сульфаниламидных препаратов.
- •Вопрос 33. . Обмен фенилаланина и тирозина. Все пути превращения в норме.
- •1 Реакция – тирозинаминотрансфераза
- •Вопрос 34 - Фенилкетонурия, биохимический дефект, проявление болезни, диагностика, лечение.
- •Вопрос 35. Алкаптонурия, альбинизм. Биохимический дефект, проявление болезней.
- •Вопрос 36 Нарушения синтеза дофамина при паркинсонизме.
- •Вопрос 37 Конечные продукты азотистого обмена: соли аммония и мочевина.
- •46. Распад нуклеиновых кислот, нуклеазы пищеварительного тракта и тканей.
- •49. Инозиновая кислота как предшественник пуриновых мононуклеотидов
- •51. Биосинтез пиримидиновых нуклеотидов.
- •52. Регуляция биосинтеза пуриновых и пиримидиновых мононуклеотидов
- •53. Биосинтез дезоксирибонуклеотидов
- •54. Применение ингибиторов синтеза дезоксирибонуклеотидов для лечения злокачественных опухолей.(тут я мало что нашел…)
- •55. Нарушения обмена нуклеотидов: оротацидурия, ксантинурия. (ксантинурия маловато)
- •56. Подагра, причины возникновения. Применение аллопуринола для лечения подагры.
- •58.Биосинтез(репликация) днк,общая характеристика процесса, биологическое значение. Этапы репликации.
- •60. Синтез днк и фазы клеточного деления. Роль циклинов и циклинзависимых протеинкиназ в продвижении клетки по клеточному циклу.
- •61.Повреждение и репарация днк. Днк- репарирующий комплекс, механизм процесса и условия репарации.
- •62. Биосинтез рнк. Особенности процесса транскрипции, этапы рнк- полимеразы, их роль.
- •63. Понятие о мозаичной структуре генов, первичном транскрипте; механизм созревания рнк (посттранскрипционный процессинг).
- •64. Биосинтез белков. Понятие о коллинеарности кода. Этапы процесса.
- •65. Биосинтез белков. Основные компоненты белоксинтезирующей системы. Биосинтез и созревание м-рнк.
- •66. Понятие о биологическом коде, свойства биологического кода. Универсальность биологического кода и процессов биосинтеза белка.
- •67. Транспортная рнк как адаптор аминокислот. Биосинтез аминоацил-т-рнк.
- •68. Субстратная специфичность арс-аз, их роль. Изоакцепторные т-рнк. (часть не нашла)
1.Динамическое состояние белков в организме.Катепсины.
С обменом белков и аминокислот неразрывно связано понятие азотистого баланса (АБ), под которым понимают разницу между количеством азота, введенного в организм с пищей (Nввед) и количеством азота, выведенного из организма (Nвывед) в виде конечных продуктов азотистого обмена.
Динамическое состояние белка в организме - изменение белкового состава без нарушения функции.Оно мб:
1)Равновесное(равновесный АБ)- скорость катаболизма=скорость анаболизма
2)Положительное-скорость анаболизма больше(у детей и во время восстановления организма после заболевания)
3)Отрицательное-скорость катаболизма больше(у пожилых людей, при голодании, при онкологических заболеваниях)
КАТЕПСИНЫ(от греч. kathepso — перевариваю), протеолитич. ферменты из группы эндопептидаз. Локализованы в лизосомах клеток животных. Осуществляют внутриклеточное переваривание белков. По строению активного участка катепсины разделяют на цистеиновые, сериновые и аспартатные протеазы. Наиболее многочисленны катепсины, содержащие в своём активном сайте цистеин: это катепсины B, C, H, F, L, K, O, S, V/L2, X, W. К сериновым протеазам относятся катепсины A и G, к аспартатным — D и E.
Оптимальный pH для действия катепсинов =3.8. Их активность растёт в опухолевых клетках. Катепсины группы В — трипсиноподобные; группы D — действуют подобно пепсину, активируют другие катепсины. Катепсин группы G наиболее активен в полиморфноядерных лейкоцитах, действует подобно химотрипсину.
2.Пищевые белки как источник ак. Переваривание белков.
Нам надо кушать 100-120 г белка в день при трате 12000 кДж + по 10 г на каждые 1200 кДж. А детишкам 55-72 г\день
Источники свободных аминокислот в клетках - белки пищи, собственные белки тканей и синтез аминокислот из углеводов. Фонд свободных аминокислот организма составляет примерно 35 г. Содержание свободных аминокислот в крови в среднем равно 35-65 мг/дл. Большая часть аминокислот входит в состав белков, количество которых в организме взрослого человека нормального телосложения составляет примерно 15 кг.
В организме человека в сутки распадается на аминокислоты около 400 г белков, примерно такое же количество синтезируется. Поэтому тканевые белки не могут восполнять затраты аминокислот при их катаболизме и использовании на синтез других веществ. Первичными источниками аминокислот не могут служить и углеводы, так как из них синтезируются только углеродная часть молекулы большинства аминокислот, а аминогруппа поступает от других аминокислот. Следовательно, основным источником аминокислот организма служат белки пищи.
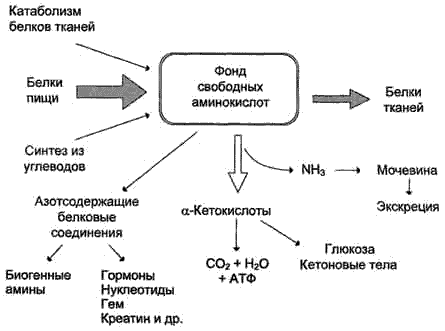
95-97% белков пищи всасываются в виде АК.Пептидазы ЖКТ поэтапно расщепляют пептидные связи белковой молекулы до конечного продукта гидролиза белков- АК,При гидролизе происходит разрыв СО-NН связи.
3.Протеиназы жкт.Субстратная специфичность протеиназ.
Протеиназы делят на 2 типа:
Экзопептидазы-катализируют разрыв концевой пептидной связи с высвобождением концевой АК.
Карбоксипептидаза, аминопептидазы
Эндопептидазы-разрывают связь внутри полипептидной цепи.
Пепсин(рН 1-2), реннин, трипсин,химотрипсин(и у трипсина рН 7,2-7,8), эластаза
Специфичность:
Трипсин преимущественно гидролизует пептидные связи, образованные карбоксильными группами аргинина и лизина. Химотрипсины наиболее активны в отношении пептидных связей, образованных карбоксильными группами ароматических аминокислот (Фен, Тир, Три).
Карбоксипептидазы А и В - цинксодержащие ферменты, отщепляют С-концевые остатки аминокислот. Причём карбоксипептидаза А отщепляет преимущественно аминокислоты, содержащие ароматические или гидрофобные радикалы, а карбоксипептидаза В - остатки аргинина и лизина.
Последний этап переваривания - гидролиз небольших пептидов, происходит под действием ферментов аминопептидаз и дипептидаз, которые синтезируются клетками тонкого кишечника в активной форме.
Аминопептидазы последовательно отщепляют N-концевые аминокислоты пептидной цепи. Наиболее известна лейцинаминопептидаза - Zn2+- или Мn2+-содержащий фермент, несмотря на название, обладающий широкой специфичностью по отношению к N-концевым аминокислотам.
Дипептидазы расщепляют дипептиды на аминокислоты, но не действуют на трипептиды.
В результате последовательного действия всех пищеварительных протеаз большинство пищевых белков расщепляется до свободных аминокислот.
