
- •Карбоксильная группа
- •Реакции подлинности
- •Количественное определение
- •Сложноэфирная и амидная группы
- •Химические свойства
- •Реакции подлинности
- •Количественное определение
- •Азометиновая группа
- •Первичная алифатическая аминогруппа
- •Количественное определение
- •Ароматическая нитрогруппа Химические свойства
- •Количественное определение
- •Вторичная аминогруппа Химические свойства
- •Реакции подлинности
- •Количественное определение
- •Вторичная аминогруппа в составе имидной, сульфамидной, гидразидной функциональных групп и в некоторых гетероциклических соединениях
- •Химические свойства
- •Реакции подлинности
- •Количественное определение
- •Третичный и четвертичный атом азота
- •Химические свойства
- •Реакции подлинности
- •Количественное определение
- •Ковалентно связанный галоген
- •Подлинность
- •Количественное определение
- •Ковалентно связанная сера
- •Подлинность
- •Ковалентно связанный азот
Количественное определение
Количественное определение ЛВ, содержащих ковалентно связанный галоген, включает переведение его в ионогенное состояние и последующее определение полученного соединения подходящим методом.
1. Аргентометрические методы после востановительной минерализации (Zn + NaOH, Zn + CH3COOH) или гидролитического разложения (алифатические соединения). Фактор эквивалентности зависит от количества атомов галогена (1/n)
Варианты: Фаянса (прямое титрование, уксуснокислая среда, индикаторы – бромфеноловый синий или эозинат натрия);
Фольгарда (обратное титрование, азотнокислая среда, индикатор – железоаммонийные квасцы);
 Косвенный
метод Фольгарда
(обратное титрование, азотнокислая
среда, индикатор – железоаммонийные
квасцы + 0,1 мл тиоцианата аммония).
Косвенный
метод Фольгарда
(обратное титрование, азотнокислая
среда, индикатор – железоаммонийные
квасцы + 0,1 мл тиоцианата аммония).
fэкв (бромкамфоры)=1
fэкв (лиотиронина)=1/3
2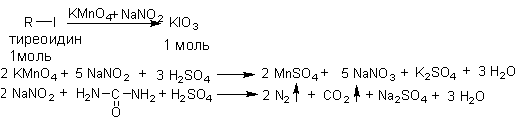 .Унифицированный
йодометрический метод для йодсодержащих
органических соединений
(лиотиронин, тиреоидин). Метод основан
на окислительной минерализации
йодорганических веществ избытком калия
перманганата и концентрированной серной
кислоты до йодата, который определяют
йодометрически после удаления избытка
окислителя. Избыток калия перманганата
удаляют натрия нитритом, избыток
последнего мочевиной, т.к. и калия
перманганат и натрия нитрит являются
окислителями по отношению к йодиду и
будут мешать йодометрическому определению
йодата.
.Унифицированный
йодометрический метод для йодсодержащих
органических соединений
(лиотиронин, тиреоидин). Метод основан
на окислительной минерализации
йодорганических веществ избытком калия
перманганата и концентрированной серной
кислоты до йодата, который определяют
йодометрически после удаления избытка
окислителя. Избыток калия перманганата
удаляют натрия нитритом, избыток
последнего мочевиной, т.к. и калия
перманганат и натрия нитрит являются
окислителями по отношению к йодиду и
будут мешать йодометрическому определению
йодата.
f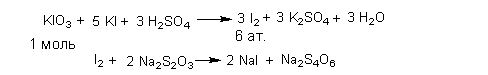 экв
(йода)=1/6.
fэкв
(вещества)=1/6
х n,
где n
– число атомов йода в молекуле вещества.
экв
(йода)=1/6.
fэкв
(вещества)=1/6
х n,
где n
– число атомов йода в молекуле вещества.
3. Метод сжигания в колбе с кислородом (ГФ ХI, вып.1, стр. 181). Метод основан на сожжении органического вещества в атмосфере кислорода, растворении образующихся продуктов сгорания в поглощающей жидкости и последующем определении элементов, находящихся в растворе в молекулярном и ионном виде.
3.1. Определение фтора. Продукты сжигания фторсодержащего органического соединения (фториды) поглощают водой и определяют одним из методов.
![]() 3.1.1. Ториметрический
метод, вариант прямого титрования.
Метод основан на свойстве фторидов
количественно вступать в реакцию с
нитратом тория (IV)
с образованием фторида тория (IV).
Индикатор – ализариновый красный,
переход окраски от желтой к розовой.
3.1.1. Ториметрический
метод, вариант прямого титрования.
Метод основан на свойстве фторидов
количественно вступать в реакцию с
нитратом тория (IV)
с образованием фторида тория (IV).
Индикатор – ализариновый красный,
переход окраски от желтой к розовой.
fэкв (фтора)=1. fэкв (вещества)=1/n, где n – число атомов фтора
в молекуле вещества.
3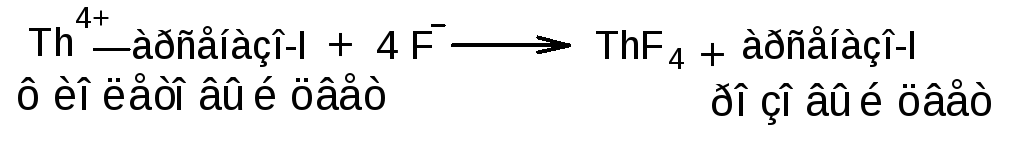 .1.2.Спектрофотометрия
в видимой области спектра (длина волны
580 нм).
Определение связано с уменьшением
оптической плотности растворов комплекса
тория (IV)
с арсеназо-I
в присутствии фторидов.
.1.2.Спектрофотометрия
в видимой области спектра (длина волны
580 нм).
Определение связано с уменьшением
оптической плотности растворов комплекса
тория (IV)
с арсеназо-I
в присутствии фторидов.
Расчет ведут с использованием градировочного графика.
3![]() .2.Определение
хлор - и бромсодержащих органических
веществ. В
качестве поглощающей жидкости используют
раствор пероксида водорода, затем смесь
нейтрализуют щелочью по бромфеноловому
синему и галогенид ионы определяют
меркуриметрически в азотнокислой среде
в присутствии индикатора дифенилкарбазона
(изменение окраски от желтой к розовато
– фиолетовой). Расчет ведут на содержание
хлора или брома
.2.Определение
хлор - и бромсодержащих органических
веществ. В
качестве поглощающей жидкости используют
раствор пероксида водорода, затем смесь
нейтрализуют щелочью по бромфеноловому
синему и галогенид ионы определяют
меркуриметрически в азотнокислой среде
в присутствии индикатора дифенилкарбазона
(изменение окраски от желтой к розовато
– фиолетовой). Расчет ведут на содержание
хлора или брома
fэкв (хлора, брома)=1. fэкв (вещества)=1/n, где n – число атомов хлора или
брома в молекуле вещества.
3.3.Определение йода. Поглощающей жидкостью является раствор щелочи. Образующиеся йодсодержащие соединения окисляют бромом до йодата, который определяют йодометрически.
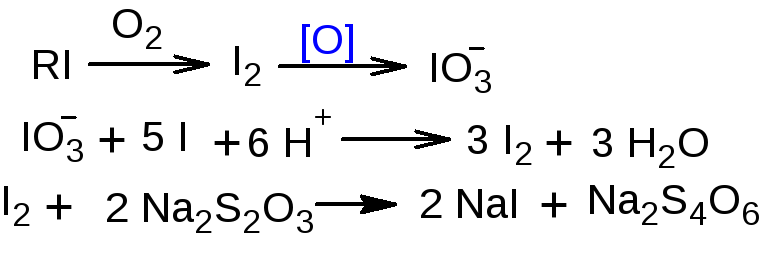
fэкв (йода)=1/6. fэкв (вещества)=1/6 х n, где n – число атомов йода в молекуле вещества.
