
afanasev_a_e_fizicheskie_processy_torfyanogo_proizvodstva
.pdf
31
Рис. 1.6. Зависимость полной энергии
взаимодействия |
молекул |
от расстояния: |
U – полная |
энергия |
всей системы |
(0d – минимальное расстояние сближения); штриховая линия – гармонические колебания
При дальнейшем сближении (r1 r0) быстро растут силы отталкивания и общая потенциальная энергия становится положительной.
Если средняя кинетическая энергия молекул не превышает потенциальной энергии взаимодействия, то образуются кристаллы. Силы взаимодействия можно считать электрическими, т.к. магнитные и гравитационные силы во много раз меньше (8 10-23 Дж против
8 10-19 Дж).
Химическая связь
имеет тот же порядок (10-19 Дж) и подразделяется:
на гомеополярную (однополярную) ковалентную у металлоидов (например, ZnS);
гомеополярную |
металлическую |
связь |
атомов |
металлов |
(Ni, Fe и т.д.); |
|
|
|
|
гетерополярную (разнополярную) ионную связь между металлом и металлоидом (NaCl, KCl и т.д.);
молекулярную связь одинаковых молекул.
Различают кристаллические системы, отличающиеся соотношениями между сторонами и углами: триклинная, моноклинная, ромбическая, ромбоэдрическая, гексагональная, тетрагональная, кубическая [5]. Для кристаллических тел характерным является дальний порядок. Другим важным понятием является ближний порядок, определяющийся размещением атомов, ближайших к рассматриваемому. Блочная структура кристаллов (d = 10–4 – 10–6 см) из-за размытости линий приводит к понижению прочности. Для монокристаллов (в виде усов) значения теоретической прочности приближаются к реальной из-за отсутствия в них дефектов структуры (дислокаций: линейные, винтовые; включения атомов других элементов и вакансии).
Механические свойства твердых тел определяются деформацией объема (первичная деформация), изменением формы тела (вторая главная деформация) и относительным их изменением:
ε |
l |
(1.90) |
l |
32
под действием силы Р на сечение S, вызывающей напряжение
σ |
P |
. |
|
(1.91) |
|
|
|||
|
S |
|
|
|
|
|
|
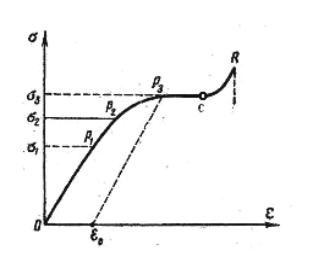
При |
этом = f ( ) имеет |
|
|
|
сложный вид (рис. 1.7), отли- |
|
|
|
|
чающийся от характерной для |
|
|
|
|
капиллярно-пористых и порис- |
|
|
|
|
тых тел [9]: 0Р1 – область упру- |
|
|
|
|
гих деформаций; Р1Р2 – участок |
|
|
|
|
с некоторым нарушением про- |
|
|
|
|
порциональности, но он также |
|
|
|
|
относится |
к упругой области |
|
|
|
деформаций; 2 – предел упру- |
|
|
|
|
гости; участок Р2Р3 – область |
|
|
|
|
пластических деформаций. По- |
|
|
|
|
сле снятия напряжения тело не |
|
Рис. 1.7. Зависимость относительной |
возвращается в исходное со- |
|||
деформации от напряжения |
|
|
стояние: |
деформация 0 оста- |
точная, 3 соответствует Р3 и называется пределом пластичности. За последним начинается область текучести (горизонтальный участок Р3С). Материал течет. Далее (СR) частично материал упрочняется до точки R – предел прочности, затем наступает разрыв.
В области упругих деформаций напряжение и относительная де-
формация связаны законом Гука: |
|
|
|
|
|
l |
αP |
1 |
P , |
(1.92) |
|
l |
E |
||||
|
|
|
где α |
1 |
– коэффициент упругости; Е – модуль упругости (модуль Юн- |
|||||
|
|||||||
|
E |
|
|
|
|
||
га). |
|
|
|
|
|||
Для стали Е = 210 кН/мм2, меди – 80 (на растяжение), для полимеров |
|||||||
толщиной 50–100 нм Е = 106 – 107 Н/м2 (1–10 Н/мм2). |
|||||||
Поперечное сжатие стержня n = |
d при его растяжении равно |
||||||
|
|
|
d |
|
|||
|
|
d |
βP αμP , |
(1.93) |
|||
|
|
d |
|
|
|
|
|
где – коэффициент поперечного сжатия, μ |
β |
|
– коэффициент Пуассона, |
||||
α |
|||||||
|
|
|
|
|
|||
т.е. n = . Значения 0,25 – 0,5.
Помимо растяжения, сжатия встречаются сдвиг и кручение. Для торфяных систем характерны деформации сжатия и сдвига.

33
Для сдвига одной части слоя, относительно закрепленной другой под
углом , закон Гука принимает вид |
|
= G , |
(1.94) |
где G – модуль сдвига.
Деформация кручения сводится к сдвигу. Объем тела при этом не меняется. При закручивании стержня на некоторый угол момент пары сил
M πGr4 ,
2l
где l – длина стержня; r – его радиус. Из теории связь между рассмотренными выше модулями:
G |
E |
. |
|
|
|||
2(1 μ) |
|||
|
(1.95)
упругости [5] следует
Температура плавления Т (приложение 1.5) связана с изменением давления dP уравнением Клаузиуса-Клапейрона
dT T |
Vж Vт |
dP , |
(1.96) |
|
|||
|
q0 |
|
|
где q0 – молекулярная теплота плавления; Vж и Vт – объем 1 кмоля жидкости и соответственно твердого тела. При не очень низких Т теплоемкость всех химически простых твердых тел равна Ср = 3R* = 25 103 Дж/кг атом К (закон Дюлонга-Пти).
Тепловой поток Q, Дж, за счет теплопроводности за время опреде-
ляется формулой |
|
|
|
Q λ |
T |
S τ , |
(1.97) |
|
x |
|
|
где – коэффициент теплопроводности, Вт/м К; T – градиент темпера-
x
туры, К/м; S – сечение тела, через которое переносится энергия, м2. Длина твердых тел lt зависит от температуры t тела:
lt = l0(1+а t).
Для твердых изотропных тел а = 1/3 b = const – коэффициент линей-
ного теплового расширения, b – то же, объемного расширения, l0 – длина при t = 00С.
Пример. Найти, насколько изменяется температура плавления льда при увеличении внешнего давления на 1 105 Н/м2, если изменение энтропии при плавлении 1 кмоля льда равно 22,2 кДж/К.
Дано: = 1 кмоль льда, S = 22,2 кДж/К, Р = 1 105 Н/м2. Принимаем= 18 кг/кмоль, плотность воды ж = 1000 кг/м3, а льда т = 900 кг/м3 (приложение 1.5). Определим
V |
μ |
|
18 |
18 10 3 м3 , V |
μ |
|
18 |
2 10 2 м3. |
|
|
|
|
|||||
ж |
ρж |
1000 |
т |
ρт |
900 |
|
||
|
|
|
||||||
34
Изменение энтропии S при фазовых переходах определяется из
(1.45): |
|
|
|
|
|
|
|
|
S |
mλ0 |
|
vq0 |
|
Q |
, |
(1.45)* |
|
T |
T |
T |
||||||
|
|
|
|
|
где m, – соответственно масса фазы и число киломолей; 0 – удельная теплота плавления, Дж/кг; q0 – молекулярная теплота плавления, Дж/кмоль;Q – изотермическая теплота плавления, Дж; Q = m 0 или Q = q0 (наш случай).
Из уравнения (1.96) находим
|
|
|
T |
P(Vж Vт )T |
. |
|
(1.96) |
* |
|||
|
|
|
|
q0 |
|
|
|||||
|
|
|
|
|
|
|
|
|
|
||
Из (1.45)* найдем q |
0 |
ST |
, подставим в (1.96)* и получим расчетную |
||||||||
|
|
v |
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
||
формулу для T |
P(Vж |
Vт )v |
. Подставляя в нее данные задачи, получаем |
||||||||
S |
|||||||||||
|
|
|
|
|
|
|
|
||||
|
T |
1 105 |
(18 10 |
3 2 10 2 )1 |
0,009 К , |
|
|||||
|
|
|
22,2 |
103 |
|
|
|
||||
|
|
|
|
|
|
|
|
|
|||
т.е. температура плавления уменьшается.
Рассмотренные закономерности молекулярно-кинетической теории и термодинамики позволяют читателю использовать их в качестве модельных представлений протекающих процессов в реальных коллоидных и ка- пиллярно-пористых телах (торф, сапропель), давать качественное объяснение и критически оценивать вновь получаемые теоретические и экспериментальные закономерности этих процессов.
1.18. Методические указания к решению задач
При решении задачи необходимо внимательно изучить ее условие и установить, какие физические процессы затрагивают это условие и какими закономерностями они описываются. Затем выразить искомый параметр (характеристику) через одну из известных закономерностей. Проанализировать полученное соотношение и установить неизвестные параметры. Найти их связь с данными задачи. Задать условие задачи в буквенном виде, т.е. составить расчетные формулы, подставить численные значения параметров, выраженных обязательно в одной и той же системе единиц (СИ). Соотношения между единицами СИ, внесистемными единицами и единицами других систем можно найти в любой справочной литературе при задачниках по общему курсу физики, например в [3]. В случае использования однородных единиц измерения, входящих в числитель и знаменатель расчетной формулы, перевод в систему СИ необязателен.
35
Необходимо обратить внимание на степень точности окончательного решения. Последняя не должна превышать точности исходных данных. Численный ответ записать с наименованием.
Решение может быть представлено в виде графической зависимости. На графике обязательно указать масштаб, если требуется точное решение, или только показать тенденцию определяемой зависимости.
В качестве дополнительных требований провести теоретический анализ расчетной формулы, определить постоянные и переменные величины. Упростить расчетную формулу с помощью введения обобщенной постоянной. Уравнение привести к известному виду функции (линейному, нелинейному). Построить график зависимости искомой величины от переменной (или обобщенной переменной). Определить угловой коэффициент (при линейной) или угловые коэффициенты (при нелинейной зависимости) и сравнить с обобщенной постоянной расчетного уравнения. Оценить одну из составляющих постоянной и сравнить с известными (табличными) значениями. Сделать выводы о точности полученного решения.
Задачи к части 1
1. Давление воздуха внутри закупоренной бутылки при температуре 7оС было равно 1 атм. При нагревании бутылки пробка вылетела. Определить температуру, до которой нагрели бутылку, если пробка вылетела при давлении воздуха в бутылке, равном 1,3 атм.
2. Считая, что в воздухе содержится 23,6 вес. % кислорода и 76,4 вес. % азота, найти плотность воздуха при давлении 750 мм рт. ст. и температуре 13оС. Найти парциальные давления кислорода и азота при этих условиях.
3.Плотность некоторого газа равна 6 10-2 кг/м3, средняя квадратичная скорость молекул этого газа равна 500 м/с. Найти давление, которое газ оказывает на стенки сосуда.
4.Во сколько раз средняя квадратичная скорость пылинки, взвешен-
ной в воздухе, меньше средней квадратичной скорости молекулы воздуха? Масса пылинки 10-8 г. Воздух считать однородным газом, масса одного киломоля равна 29 кг/кмоль.
5.Чему равна энергия вращательного движения молекул, содержащихся в 1 кг азота при температуре 7оС?
6. Найти удельную теплоемкость кислорода: 1) при V = const,
2)при P = const.
7.Какое количество тепла надо сообщить 12 г кислорода, чтобы на-
греть его на Т = 50К при постоянном давлении?
36
8.В закрытом сосуде объемом 2 л находится азот, плотность которого 1,4 кг/м3. Какое количество тепла надо сообщить азоту, чтобы нагреть его
вэтих условиях на Т = 100 К?
9.Какая часть молекул кислорода при 0оС обладает скоростью от 100
до 110 м/с?
10.На какой высоте давление воздуха составляет 75% от давления на уровне моря? Температуру считать постоянной и равной 0оС.
11.Определить среднюю длину свободного пробега молекул углекислого газа при температуре 100оС и давлении 0,1 мм рт. ст. Диаметр молекулы углекислого газа принять равным 3,2·10-8 см.
12.Построить график зависимости коэффициента диффузии водорода
от температуры в интервале 100К Т 600К через каждые 100 К при постоянном давлении P = 1 атм.
13.Найти диаметр молекулы кислорода, если известно, что для кислорода коэффициент внутреннего трения при 0оС равен = 18,8·10-6 Н·с/м2.
14.Построить график зависимости коэффициента теплопроводности
водорода от температуры в интервале 100К Т 600К через 100 К.
15.10 г кислорода находятся под давлением 3·105 Н/м2 при температуре 10оС. После нагревания при постоянной давлении газ занял объем в 10 л. Найти: 1) количество тепла, полученного газом; 2) изменение внутренней энергии газа; 3) работу, совершенную газом при нагревании.
16.6,5 г водорода, находящегося при температуре 27оС, расширяется вдвое при P = const за счет притока тепла извне. Найти: 1) работу расширения; 2) изменение внутренней энергии газа; 3) количество тепла, сообщенного газу.
17.При нагревании 1 кмоля двухатомного газа его абсолютная температура увеличивается в 1,5 раза. Найти изменение энергии, если нагревание происходит: 1) изохорически; 2) изобарически.
18.Пользуясь данными о критических величинах Тк и Рк для некоторых газов (приложение 1.3), найти для них постоянные a и b, входящие в уравнение Ван-дер-Ваальса.
19.1 кмоль кислорода находится при температуре t = 27оС и давлении P = 107 Н/м2. Найти объем газа, считая, что кислород при данных условиях ведет себя как реальный газ.
20.0,5 кмоля трехатомного газа адиабатически расширяется в пустоту от V1 = 0,5 м3 до V2 = 0,3 м3. Температура газа при этом понижается на 12,2 К. Найти из этих данных постоянную a, входящую в уравнение Ван-дер-ваальса.
21.Найти плотность насыщенных паров воды при температуре 50оС.
22.При температуре 100оС плотность ртути равна 13,4 г/см3. При какой температуре плотность ртути равна 13,1 г/см3? Коэффициент объемного расширения ртути принять равным 1,8·10-4 1/К.
37
23.Давление воздуха внутри мыльного пузыря на 1 мм рт. ст. больше атмосферного. Чему равен диаметр пузыря? Коэффициент поверхностного натяжения мыльного раствора принять равным 0,043 Н/м.
24.На какую высоту поднимется бензол в капилляре, внутренний диаметр которого равен d = 1 мм? Смачивание считать полным.
25.Нелетучее вещество с массой 1 кмоль = 60 кг/кмоль растворено в воде. Температура раствора 80оС, давление насыщенных паров над раствором 353 мм. рт. ст. Найти осмотическое давление раствора.
26.40 г сахара (С12Н22О11) растворено в 0,5 л воды. Температура раствора 50оС. Чему равно давление насыщенных водяных паров над раствором?
27. Изменение энтропии при плавлении 1 кмоля льда равно 22,2 Кдж/К. Найти, насколько изменяется температура плавления льда при увеличении внешнего давления на 1 105 Н/м2.
28.Пользуясь законом Дюлонга - Пти, найти удельную теплоемкость:
1)меди; 2) железа; 3) алюминия.
29.Какие силы надо приложить к концам стального стержня с площа-
дью поперечного сечения 10 см, чтобы не дать ему расшириться при нагревании от 0оС до 30оС?
30.К стальной проволоке длиной 1 м и радиусом 1 мм подвесили груз в 100 кг. Чему равна работа расширения проволоки?
2.ВЛАЖНЫЕ ПОРИСТЫЕ ТЕЛА
Кпористым телам относятся дисперсные системы с достаточно прочными контактами между частицами твердой фазы [7, 8, 10]. В зависимости от числа и видов связей в контактах различают относительно легко деформируемые несвязанные пористые тела (порошки, пасты, крошкообразный торф, сапропель и др.). Здесь раздробленной (дисперсионной) фазой являются твердые частицы, а непрерывной (дисперсионной средой) – жидкость или газ. Более прочные структуры возникают при плотных контактах частиц (вплоть до их сростания и образования непрерывной среды – формованный торф, сапропель). Промежутки между частицами твердой фазы частично или полностью заполнены влагой. Прочность пористого тела, особенности его структуры, размеры пор в основном зависят от дальнодействующих поверхностных сил (теория ДЛФО, [7, 10]). В отличие от сил химических связи, где радиус действия сравним с атомными размерами (см. рис. 1.6, отрезок od), дальнодействие поверхностных сил связано с электростатическими и электромагнитными полями, создаваемыми по-
верхностными зарядами и осциллирующими атомными и молекулярными диполями, и распространяется на 10–7 м, превосходя на несколько порядков радиус действия сил химической связи. При обезвоживании (или вла-
38
гопоглощении) взаимодействие между элементами структуры происходит в соответствии с иерархией системы: зародыш, ассоциат, агрегат, макроагрегат [7], которую можно представить как дисперсную систему, состоящую из частиц различных размеров, т.е. неодинаковой дисперсности и структуры.
Следовательно, за физико-механические свойства пористых макротел отвечают:
–прочность индивидуального контакта P, определяющаяся видом взаимодействия (связи Ван-дер-Ваальса, водородные и химические);
–количество взаимодействий N;
–наличие дефектов структуры [7,10].
Воспользоваться рассмотренными условиями для реальных коллоидных капиллярно-пористых тел представляет определенные трудности, т.к. они построены на модельных представлениях процессов структурообразования, зависящих от внешних и внутренних условий тепломассопереноса, и могут использоваться лишь для качественной оценки этих процессов.
Поэтому в практике научных исследований, а особенно инженерных расчетов используется эмпирический подход изучения зависимости обобщающей характеристики структурообразования (например прочности R) от физико-химических и технологических характеристик при удалении влаги различных форм и энергии связи с твердой фазой при получении продукции из торфа.
2.1. Форма и энергии связи влаги с твердой фазой
Торф в отличие от других видов твердых горючих ископаемых сильно обводнен и способен удержать до 15…25 частей воды на одну часть сухого вещества. Поэтому основу большинства технологий получения продукции из торфа (особенно на топливо) составляют процессы обезвоживания (сушки) торфа сначала в естественном залегании (осушение торфяных залежей), затем при получении из нее продукции различного назначения, которых насчитывается до 70 наименований.
Взаимодействие воды с твердой фазой определяется особенностями строения обеих составляющих [9].
Молекула воды H2O представляет собой равнобедренный треугольник, в вершине которого находится ядро кислорода, а в основании – два ядра атома водорода. Взаимодействие ядер определяется расстоянием между ними. Так, между ядрами O и H в несвязанной молекуле воды (водяного пара) расстояние r составляет 9,6·10-11м, в кристаллической решетке льда – 9,9·10-11м. Между атомами H r = 1,54·10-10м, угол в вершине HOH – 1,83 рад, в решетке льда – 1,91 рад. Эти обстоятельства обеспечивают больший дипольный момент 6,13·10-29Кл·м. Каждая молекула льда окружена четырьмя соседними. При конденсировании воды образуется ажур-

39
ная тетраэдрическая решетка с пустотами внутри по аналогии со структурой льда. Размер пустот больше диаметра молекулы воды [9].
Молекулы воды на линии O–H…O взаимодействуют через водородные или H-связи, которые широко распространены в природе (органические и неорганические соединения). Добавки неэлектролитов приводят как к стабилизации, так и разрушению структуры воды. Торфяная вода представляет раствор, в котором растворителем служит низкомолекулярная жидкость (вода), а растворенными являются высокомолекулярные органические и минеральные вещества в коллоидном, молекулярном и ионном состоянии [9].
Общая минерализация торфяных вод уменьшается от низинных (7…18) ·10-2 кг/м3 к верховым (4…7) ·10-2 кг/м3 болотам. В минеральном комплексе торфяных залежей преобладают ионы кальция и его водорастворимые соединения. Степень насыщенности поглощающего комплекса торфа кальцием составляет до 0,2 (верховые), 0,2…0,45 (переходные), 0,45…0,7 и более (низинные залежи). Химический состав вод неоднороден даже в пределах одного торфяного месторождения. Поэтому торф относится к природным ионнообменникам. Процессы протекают в основном в кислой среде (pH<7). Так, атмосферные воды имеют pH=4,0…5,2; верхо-
вые болот – 3,6…5,6; низинные – 4,7…7,3; переходные – 4,2…6,3.
В водах обнаруживаются моносахариды, уроновые кислоты, аммиак, полимеры углеводов (пентозы), гуминовые кислоты, битумы, азотистые и другие соединения. Изменение кислотности коррелирует с содержанием CaO и количеством обменного кальция Ca2+ в воде, а также катионов Fe3+, Mg2+, Ca2+ по глубине торфяной залежи и во времени [9].
Сорбционные процессы в торфе носят объемный и специфический механизм сорбции. Специфический механизм определяют гидроксильные, карбоксильные, кислородные и азотные атомные группы. Влага моносорбции Wм = 0,152–0,167 кг/м3 (приложение 2.2). Каждая молекула воды может образовать до четырех водородных связей (две за счет неподеленных электронных пар атома кислорода и еще две обеспечивают водородные атомы). Одна из них идет на взаимодействие с активными центрами, а оставшиеся могут присоединить до трех молекул воды при W≤(0,3…0,4) кг/кг. Дальнейшее заполнение емкости идет за счет вторичных центров сорбции (эпитаксиальный механизм взаимодействия) с образованием полимолекулярно сорбированной влаги Wпол , структура которой и упорядоченность определяются содержанием функциональных групп, обладающих различной энергией связи: COOH – 3,6·104 , OH – 2,9·104 Дж/моль [9]. Энергия связи E адсорбционносвязанной воды определяется из уравнения
A R*T ln |
1 |
, |
(2.1) |
|
40
где φ – относительное давление паров воды (φ=P/PS); А – энергия, затрачиваемая на работу сорбции (десорбции) молекул воды, Дж/моль.
При поглощении жидкости происходят выделение тепловой энергии и контракция (сжатие) системы. Тело, поглощая жидкость, увеличивает свои размеры, но объем набухшего тела Vнт меньше суммы объема сухого тела Vст и поглощенной жидкости Vж : V (Vст Vж ) Vнт .
Тело обладает давлением Pн набухания, аналогично осмотическому давлению растворенного вещества. С ростом W величина Pн уменьшается. Зависимость Pн=f(T, φ) следует из уравнения
P |
R*T |
ρ |
|
ln , |
(2.2) |
|
ж |
||||
н |
μ |
|
|
|
|
|
|
|
|
|
откуда выражение для оценки теплоты набухания Q (Дж/моль) равно
|
|
|
|
Q Pнυm , |
(2.3) |
где |
|
|
μ |
– удельный объем жидкости, м3/моль. |
|
m |
ρж |
|
|||
|
|
|
|
||
|
|
|
|
|
Теплота набухания Q обусловлена теплотой адсорбции E. Содержание физико-химически связанной воды в торфе определяется
компонентным составом и структурой индивидуальных соединений. Осмотическая (энтропийносвязанная) вода удерживается в торфе ос-
мотическими силами внутри элементов структуры (частиц, ассоциатов, см. раздел 1.16). Это влага набухания. Осмотическими ячейками обычно служат клетки растений, а также полости, в которых находится раствор органических и минеральных веществ (приложение 2.2). Эту воду трудно отделить от иммобилизованной. В верховом торфе более высокое содержание Wосм, чем в низинном [9].
Влага механического удержания обусловлена содержанием частиц растительного происхождения и гидрофильных коллоидов, а также особенностями их макро- и микроструктуры. Эта влага по своим свойствам не отличается от свободной. Она удаляется при полевой сушке торфа и разделяется (приложение 2.2) на капиллярную (Wкап = 4…25 кг/кг), внутриклеточную (0,8…3,0), иммобилизованную (0,6…1,7), структурно захваченную (0,3…3,1). Все они относятся к слабым формам связи воды:
Wсл= Wкап+ Wвнк +Wимм+ Wстр+ Wосм.
К влаге механического удерживания применимы соотношения (1.68)– (1.89) (см. разделы 1.13 – 1.16).
Формы связи влаги с твердой фазой торфа могут быть рассмотрены с позиции изменения термодинамического потенциала dG Гиббса. Так, для постоянного числа взаимодействующих частиц N = Const из уравнения
(1.51) следует (μ dN = 0)
dG VdP SdT . |
(2.4) |
