
- •Классификация, строение и биологическая роль липидов.
- •Переваривание липидов в желудочно-кишечном тракте. Роль желчных кислот и панкреатических липаз: желчные кислоты эмульгируют жиры, а липазы разрушают сложные липиды до более простых.
- •Липолиз. Бета-окисление высших жирных кислот:
- •Ацетил-КоА – как центральный метаболит обмена липидов. Кетогенез. Кетоновые тела, биологическое значение их превращений.
- •Нарушения липидного обмена при сахарном диабете. Механизм развития гиперлипидэми и, кетоза.
-
Ацетил-КоА – как центральный метаболит обмена липидов. Кетогенез. Кетоновые тела, биологическое значение их превращений.
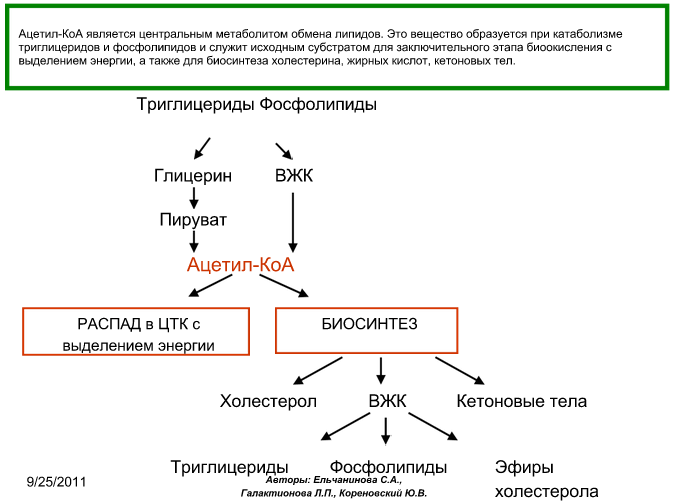
Кетогенез – синтез кетоновых тел (ацетоацетат, бета-оксибутират) из Ацетил КоА. Синтезируется в митохондриях гепатоцитов:

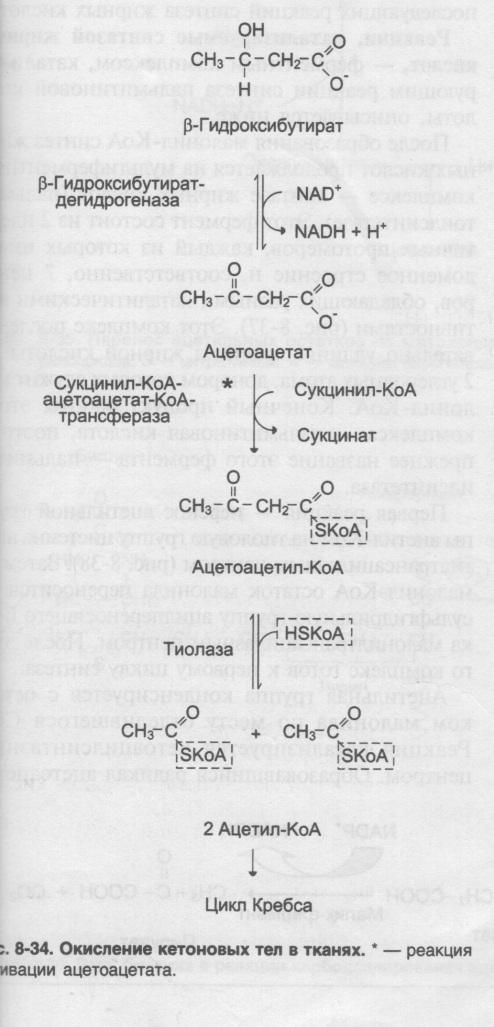
При низком соотношении инсулин/глюкагон в жировой ткани активируется распад жиров. Жирные кислоты в большом количестве поступают в печень, где распадаются до большого количества ацетил-КоА, больше, чем может вступить в цикл Кребса. Поэтому избыток идёт на синтез кетоновых тел. В крови в основном встречается бета-гидроксибутират, ацетоацетата меньше. В крови ацетоацетат может неферментативно декарбоксилироваться, в результате чего образуется Ацетон. Он не используется для окисления, выводится лёгкими и почками.
Биологическая роль: при длительном голодании кетоновые тела становятся основным источником энергии для скелетных мышц, сердца, почек.
-
Эйкозаноиды. Роль фосфолипазы А2, циклооксигеназы, липооксигеназы в образовании простагландинов, тромбоксанов, лейкотриенов. Биологическая роль эйкозаноидов. Лекарственные вещества – ингибиторы циклооксигеназы.
Буду отвечать не по порядку вопроса, а по порядку образования. Есть мембрана. На мембране есть фосфолипиды. Некоторые их них могут иметь арахидоновую кислоту во второй позиции. Что значит вторая позиция? Господи, сейчас вам нарисую.
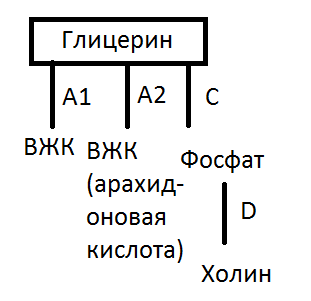
Как видно, арахидоновая кислота находится в А2 позиции. Поэтому фермент, который отщепляет арахидоновую кислоту назван фосфолипаза А2.
Дальше арахидоновая кислота может пойти по двум путям.
1. Пойти в простогландины под действием циклооксигеназы. Действие разное. Например PG E2 расслабляет гладкую мускулатуру, тем самым расширяя сосуды. Если простогландин имеет два кольца в своей структуре, то он уже не просто простогландин, он уже простациклин PG I2 подавляет агрегацию тромбоцитов, расширяет сосуды.
В тромбоцитах из простагландинов синтезируются тромбоксаны. Только в них! TX A2 например стимулирует агрегацию тромбоцитов, сужает сосуды
2. Под воздействием липоксигеназы может пойти в лейкотриены. Выделяются лейкоцитами. Активируют хемотаксис и агрегацию тромбоцитов, сужают бронхи.
Также нужно знать, что эйкозаноиды участвуют в воспалении.
В качестве противовоспалительных средств используются ингибиторы циклооксигеназы – это препараты нестироидного действия, например аспирин. Поскольку циклооксигеназа ингибируется, то арахидоновая кислота идёт в образование лейкотриенов. А если у вас астма? Ведь лейкотриены сужают бронхи! Для этого есть лекарственные препараты стероидного действия, которые ингибируют непосредственно фосфолипазу А2. Ну это так, многие преподаватели любят задавать такой вопрос, да и для общего развития полезно.
-
Понятие о синтезе высших жирных кислот в организме человека: организм синтезирует заменимые ВЖК из ацетил-КоА, который образуется при распаде глюкозы. То есть синтезируемые ВЖК нужны нам для запаса излишков углеводов, поступающих с пищей (ну кроме там всяких структурных функций)
Локализация: в основном в печени, меньше в жировой ткани и сись.. ой, простите, лактирующих молочных железах. Синтез происходит частично в цитозоле, частично в митохондриях.
Исходные субстраты: ацетил-КоА (не одна молекула, для синтеза пальмитиновой кислоты требуется 8 ацетил-КоА) и NADPH2 как источник атомов водорода.
Типы химических реакций: 1. В митохондриях образование ацетил-КоА из пирувата (декарбоксилирование).
2. ацетил-КоА + оксалоацетат = цитрат + HS KoA. (цитратсинтаза) (конденсация)
3. транспорт цитрата из митохондрий в цитозоль.
4. Цитрат + HS-KoA +АТФ = Ацетил-КоА + АДФ + Pi + оксалоацетат
5. Образование малонил- КоА из ацетил-КоА (ацетил-КоА-карбоксилаза) (карбоксилирование)
6. Синтез пальмитиновой кислоты с помошью синтазы жирных кислот (пальмитатсинтазы). Там много тонкостей, но, думаю, будет достаточно сказать, что синтез идёт путём последовательного присоединения малонил-КоА к субстрату, пока не образуется пальмитиновая кислота.
7. На основе пальмитиновой кислоты в эндоплазматическом ретикулуме образуется другие заменимые ВЖК по тому же типу, что и пальмитиновая кислота, но уже без синтазы жирных кислот.
Роль пальмитатсинтазы: синтез пальмитиновой кислоты идёт непосредственно на этом ферменте. Он может стимулироваться цитратом и инсулином и ингибируется пальмитоил-КоА, глюкагоном и адреналином.
Заменимые и незаменимые жирные кислоты: незаменимые – линолевая, линоленовая,арахидоновая. Должны поступать с пищей. Заменимые: пальмитиновая, стеариновая, олеиновая. Могут синтезироваться.
-
Строение и биологическая роль холестерина: Холестерин – стероид. Биологическая роль: идёт на синтез многих веществ, а также является структурным элементом мембран клеток.
Понятие о синтезе и направлениях превращений холестерина: Синтез холестерина проходит в три этапа.
1 этап. Из ацетил-КоА и ацетоацетил-КоА (который образуется из двух ацетил-КоА при действии тиолазы) образуется 3-гидрокси-3метилглютарил Коэнзим А (ГМГ-КоА), который затем превращается в мевалонат под воздействием ГМГ-КоА-редуктазы.
2 этап. Мевалонат, пройдя через множество реакций, разбираться в которых я даже не собираюсь, превращается в сквален. Про этот этап можете сказать, что идёт образование углеродных колец.
3 этап. Сквален под действием циклазы превращается в ланостерол, который проходит через 20 реакций, превращаясь в конце концов в холестерин.
Холестерин используется для синтеза стероидных гормонов, витамина D, желчных кислот, для обновления мембран клеток.
Роль ГМГ-КоА-редуктазы и липопротеинов в обмене холестерина:
ГМГ-КоА-редуктаза является ключевым ферментом синтеза холестерина. Фермент регулируется соотношением инсулин/глюкагон.
Когда инсулина много – фермент дефосфорилируется и становится активным. Когда глюкагона много – фермент фосфорилируется и становится неактивным.
ГМГ-КоА-редуктаза ингибируется желчными кислотами, из-за голодания (лечебно-профилактические диеты).
Липопротеины: ЛПНП отвечают за транспорт холестерина из печени в ткани, а ЛПВП – из тканей в печень. Важно, чтобы ЛПВП было в достаточном количестве, иначе холестерин будет задерживаться в тканях и как следствие – атеросклероз.
-
Жировая инфильтрация печени – накопление ТАГ в печени. Или можно сказать, что это дисбаланс между синтезом ТАГ и ФЛ в сторону увеличения синтеза нейтрального жира в печени.(одно и тоже, как тебе понрав)
Причины - 1. Увеличение поступления жира: слишком много жира и углеводов (которые в печени переходят в жиры) поступает с пищей; голодание (липолиз в жировой ткани, жир идёт в печень.)
2. Уменьшение оттока жира: мало ЛПОНП, мало липотропных факторов.
3. Обеднение печени гликогеном, приводящее к мобилизации жира из депо
4. Повышение секреции СТГ гипофизом, мобилизующего жир из депо.
Понятие о липотропных факторах и механизмах их действия: печень может синтезировать из фосфатидной кислоты либо фосфолипиды, либо ТАГ. Фосфолипиды всегда в ходу, а вот ТАГ имеют свойство накапливаться в печени. Поэтому всегда предпочтительней синтезировать именно фосфолипиды. Липотропные факторы этим и занимаются – усиливают синтез фосфолипидов, уменьшают ТГ в печени. Липотроп.факторы – доноры метильных групп для образования холина(составной части фосфолипидов).
К липотропным факторам относятся витамины В9 и В12, казеин молока, метионин (творог, лекар.препараты).
-
Биохимические основы развития атеросклероза.
К тканям липиды у нас несут ЛПНП, а от тканей – ЛПВП. Если у нас много ЛПНП, или мало ЛПВП, или и то и другое вместе (дислипопротеинэмия) – то холестерин задерживается в тканях (его транспортируют в ткани, а от тканей – нет). Это одна из причин развития атеросклероза – нарушения обмена ЛПНП и ЛПВП (снизу написана другая причина – нарушение поглощения ЛПНП тканями. Также причиной может являться избыточное поступление холестерина, нарушения его вывода с желчью). ЛПНП из-за этого называются атерогенными липопротеидами, а ЛПВП – антиатерогенными.
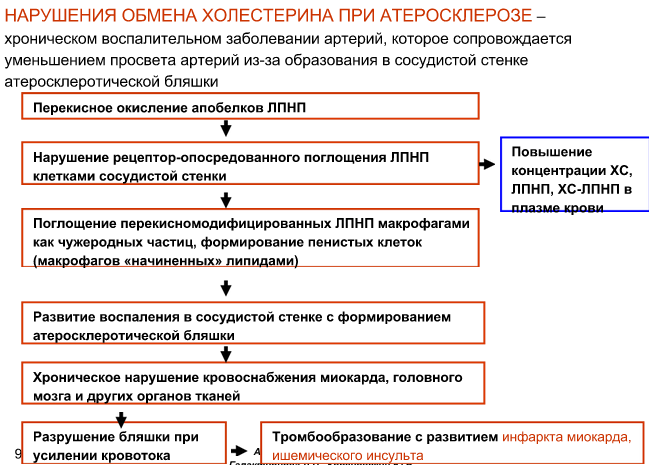
Направления коррекции нарушений липидного обмена:
1)употреблять меньше холестерина (диета – стараться употреблять только растительную пищу, которая не содержит холестерина)
2)принятие вит.C,E,A (ингибируют перекисное окисление липидов в ЛПНП)
3) принятие секвестрантов желчных кислот (увеличивают вывод желчных кислот с калом, печень вынуждена синтезировать новые из холестерина)
4)принятие препаратов ингибиторов ГМГ-КоА-редуктазы (участвует в синтезе холестерина)
5) принятие фибратов – лекарственные препараты, стимулирующие липопротеин-липазу.
-
Гормональная регуляция липидного обмена.
Гормоны прямого действия: адреналин, СТГ, инсулин.
Гормоны непрямого действия : глюкокортикоиды, половые гормоны, лептин.
Эффекты инсулина: стимулирует синтез жира, активирует липопротеинлипазу, ацетил КоА карбоксилазу. Подавляет ТАГ-липазу.
Короче делает всё, чтобы жир запасался (если надо сказать по-умному, то угнетает липолиз, активирует липогенез)
Адреналина: опосредует свой эффект через усиление секреции глюкагона и снижения секреции инсулина. Мембраны адипоцитов содержат адренорецепторы двух типов альфа и бета. Активация альфа - адренорецептора связано с торможением липолиза, бета – адренорецепторов – со стимуляцией липолиза.
В целом у человека преобладают бета-адренорецепторы, поэтому суммарное действие адреналина приводит к активации липолиза
СТГ: стимулирует липолиз
Глюкагона: стимулирует ТАГ-липазу – мобилизация жира.
Глюкокортикоиды оказывают двоякое действие: на фоне мышечной работы - глюкокортикоиды стимулируют липолиз, в состоянии покоя - ингибируют липолиз.
При развитии опухоли коры надпочечников или при введении высоких доз препаратов глюкокортикостероидов, наблюдается рост жировых запасов на лице и в верхней части туловища (синдром Иценко-Кушинга).
Половые гормоны: активируют липолиз
Лептин: усиливает синтез жира.
