
- •1) Предмет и задачи химической науки
- •2) Значение химии для медиков
- •3) Роль н2о и растворов в жизнедеятельности.
- •1. Влияние равновесия с образованием комплексного соединения на гетерогенное равновесие.
- •2. Влияние кислотно-основного равновесия на гетерогенное равновесие.
- •3. Влияние окислительно-восстановительного равновесия на ге-
- •8). Сильные и слабые электролиты.
- •9). Степень и константа диссоциации. Факторы, влияющие на степень и константу диссоциации.
- •10). Сформулируйте закон разведения Оствальда.
- •11). Что называют ионной силой раствора? Закон Дебая-Хюккеля.
- •12). Роль электролитов в процессах жизнедеятельности.
- •13). Процессы сольватации и гидратации. Сольволиз и гидролиз.
- •14). Гидролиз солей. Дайте определение гидролизу. Гидролиз с точки зрения протолитической теории.
- •15. Какие типы солей подвергаются гидролизу? Типы гидролиза.
- •16.Роль гидролиза биоорганических соединений в процессах жизидеятельности?
- •17.Напишите уравнение гидролиза атф. Какова роль этого процесса в организме человека?
- •18.Как выражается константа гидролиза для различных случаев гидролиза? Что называется константой гидролиза? От чего зависит константа гидролиза соли?
- •19.Как определяется степень гидролиза, факторы влияющие на степень гидролиза.
- •20. Что называют растворами? Значение растворов в жизнедеятельности организмов?
- •21.Классификация растворов: растворы электролитов, неэлектролитов, растворы амфолитов, растворы полиэлетролитов.
- •22.Концентрация растворов и способы её выражения
- •23.Диффузия в растворах. Закон Фика. Уравнение Эйнштейна-Смолуховского
- •24. Факторы, влияющие на скорость диффузии. Роль диффузии в процессах переноса веществ в биологических системах
- •25.Коллигативные свойства разбавленных растворов электролитов
- •26. Закон Рауля и следствия из него: понижение температуры замерзания растворителя, повышение температуры кипения, осмос.
- •27. Осмос. Осмотическое давление. Закон Вант-Гоффа. Зависит ли осмотическое давление от природы растворённого вещества?
- •50)Предмет химической кинетики?
- •51) Что понимают под скоростью химической реакции?
- •52)В чем различие гомогенных и гетерогенных химических процессов?
- •53)Как выражается средняя и истинная скорость химических реакций?
- •54)Какие факторы влияют на скорость химической реакции?
- •55) Закон действия масс?
- •56)Что такое константа скорости химической реакции?
- •58.Порядок и молекулярность реакции.
- •59.Какое явление называется катализом? Отличие гомогенного от гетерогенного. Особенности ферментативного катализа.
- •61.Выражение константы равновесия через равновесные концентрации реагирующих веществ.Каков физический смысл константы равновесия.
- •62.Принцип Ле Шателье.
- •63.При увеличении температуры увеличиваются скорости как прямой,так и обратной реакции.Почему наблюдается смещение равновесия?Изменяется ли при этом константа хим.Равновесия?
- •71 Теория мономолекулярной адсорбции Ленгмюра.
- •72. Уравнение Фрейндлиха.
- •73. Правило Шилова .
- •75.Классификация дисперсных систем по размеру частиц дф и степени дисперстности .
- •77. Классификация дисперсных систем по агрегатному состоянию фаз , их виды и обозначения .?
- •86Понятие от полимерах. Природные биополимеры
- •89Классификация вмс
- •II. По природе высокомолекулярные соединения подразделяются на:
- •90.Способы получения вмс
- •99) Взаимосвязь между процессами обмена веществ и энергии. Калорийность основных составных частей пищи и некоторых продуктов. Расход энергии при различных видах двигательной активности.
- •101. Термодинамически обратимые и необратимые процессы. Второй и третий закон термодинамики.
- •102. Энтропия. Статистическое и термодинамическое толкование энтропии. Стандартная энтропия.
- •103. Свободная энергия Гиббса(изобарно-изотермический потенциал). Энтальпийный и энтропийный факторы. Экзо- и эдноэрганические процессыв организме
- •104)Термодинамические и кинетические аспекты химического равновесия
- •105) Кислотно-основное равновесие. Современные представления о кислотно-основных равновесиях.
- •10. Структурная и пространственная изомерии.
- •20. Что такое Ка,рКа? Какая существует зависимость между их величиной и силой кислоты?
- •21. Дать определения кислоты и основания по теории Бренстеда.
- •22. От каких факторов зависит сила кислот? Перечислите их.
- •23. Как зависит кислотность от природы атома в кислотном центре? Как она изменяется в группах, периодах? Почему?
- •24. Охарактеризуйте влияние донорных и акцепторных заместителей на силу кислоты и оснований.
- •37. Гетерофункциональный заместитель как фактор, влияющий на химические свойства реакционного центра. Специфические реакции гетерофункциональных соединений.
17.Напишите уравнение гидролиза атф. Какова роль этого процесса в организме человека?
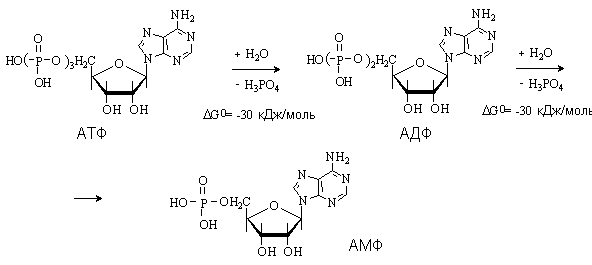
Главная роль АТФ в организме связана с обеспечением энергией многочисленных биохимических реакций. Являясь носителем двух высокоэнергетических связей, АТФ служит непосредственным источником энергии для множества энергозатратных биохимических и физиологических процессов. Всё это реакции синтеза сложных веществ в организме: осуществление активного переноса молекулчерезбиологические мембраны, в том числе и для создания трансмембранного электрического потенциала; осуществлениямышечного сокращения.
Помимо энергетической АТФ выполняет в организме ещё ряд других не менее важных функций:
Вместе с другими нуклеозидтрифосфатами АТФ является исходным продуктом при синтезе нуклеиновых кислот.
Кроме того, АТФ отводится важное место в регуляции множества биохимических процессов. Являясь аллостерическим эффектором ряда ферментов, АТФ, присоединяясь к их регуляторным центрам, усиливает или подавляет их активность.
АТФ является также непосредственным предшественником синтеза циклического аденозинмонофосфата— вторичного посредника передачи в клеткугормональногосигнала.
Также известна роль АТФ в качестве медиаторавсинапсахи сигнального вещества в других межклеточных взаимодействиях (пуринергическая передача сигнала).
18.Как выражается константа гидролиза для различных случаев гидролиза? Что называется константой гидролиза? От чего зависит константа гидролиза соли?
Константа гидролиза есть константа равновесия процесса гидролиза
Если представить уравнение гидролиза в общем виде:
МА + Н2О « HА + МОН, где МА - соль;
НА - кислота;
МОН - основание,
то константа равновесия этой реакции будет следующая:
![]() .
(5.14)
.
(5.14)
Концентрация воды в разбавленном растворе и константа равновесия этого процесса — величины постоянные. Произведение двух постоянных величин будет также величиной постоянной: К[Н2О]=Кг - это и будет константа гидролиза. Константа гидролиза для данной реакции равна:
![]() (5.15)
(5.15)
Физический смысл константы гидролиза заключается в том, что она характеризует способность данной соли подвергаться гидролизу. Чем больше Кг,, тем в большей степени протекает гидролиз.
Кг зависит от природы соли и температуры.
Рассмотрим случаи зависимости Кг от природы соли.
1. Соль образована слабой кислотой и сильным основанием:
 (5.16)
(5.16)
Уравнение (5.16) показывает, что константа гидролиза Кг тем больше, чем меньше Кдис(кислоты)), т. е. чем слабее кислота, тем в большей степени подвергаются гидролизу ее соли.
2. Соль образована слабым основанием и сильной кислотой.
В этом случае К, зависит от степени диссоциации основания:
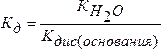 (5.17)
(5.17)
Чем слабее основание, тем в большей степени подвергается гидролизу образованная им соль.
3. Случай, когда соль образована слабым основанием и слабой кислотой.
Для таких солей Кг будет зависеть как от Кдис(кислоты), так и от Кдис(основания).
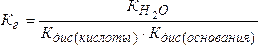 .
(5.18)
.
(5.18)
Из выражения (5.18) видно, что чем слабее основание и кислота, тем в большей степени протекает гидролиз соли.
Константа гидролиза связана со степенью гидролиза следующей зависимостью:
![]() .
(5.19, а)
.
(5.19, а)
Откуда
![]() (5.19,б)
(5.19,б)
где h - степень гидролиза;
с - концентрация раствора соли, моль/дм3.
Если соль образована двухосновной кислотой, т. е. гидролиз двухступенчатый, то тогда константы гидролиза соответственно будут равны:
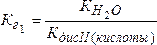 ;
; 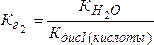 (5.20)
(5.20)
где КдисII(кислоты) и КдисI(кислоты) – константы диссоциации кислоты по II и I ступеням.
Зная степень гидролиза и концентрацию раствора соли, можно определить рН раствора:
![]() .
(5.21)
.
(5.21)
Используя выражения (5.12) и (5.21), получаем:
pH = -lg(h× c).
