
- •Тема 3 (лекции 9-17): Молекулярная физика. Термодинамика.
- •2.Модель идеального газа
- •3. Строение вещества. Жидкость, кристаллическая решётка
- •4. Молярная масса. Число Авогадро
- •5. Основное уравнение мкт идеальных газов. Физический смысл давления и температуры
- •17. Цикл Карно
- •18. Реальные газы. Уравнение Ван-дер-Ваальса.
- •19. Изотермы Ван-дер-Ваальса. Метастабильные состояние
- •20. Фазовые переходы
- •21. Формула Клапейрона-Клаузиуса
- •2. Средняя длина свободного пробела молекулы газа
5. Основное уравнение мкт идеальных газов. Физический смысл давления и температуры
![]() –основное
уравнение МКТ идеальных газов
–основное
уравнение МКТ идеальных газов
n– концентрация молекул
![]() –средняя квадратичная
скорость
–средняя квадратичная
скорость
![]()
Физический смысл давления:
Давление прямопропорционально концентрации молекул.
![]() –постоянная
Больцмана
–постоянная
Больцмана
![]()
![]() –средняя
кинетическая энергия
–средняя
кинетическая энергия
Физический смысл температуры:
Она является мерой средней кинетической энергии.
6. Уравнение Менделеева-Клапейрона
![]()
![]()
![]()
![]()
![]()
![]() ;
;
![]()
7. Изопроцессы в идеальном газе
![]()
1)
![]() –
изотермический процесс
–
изотермический процесс

![]() ;
;
![]()
2)
![]() – изохорный процесс
– изохорный процесс

![]() ;
;
![]()
Пунктиром – при низкой температуре закон не действует.
![]()
![]()
3)
![]() – изобарный процесс
– изобарный процесс

![]()
![]()
![]()
8. Закон равномерного распределения энергии по степеням свободы
Число независимых координат, полностью определяющих положение системы в пространстве, называется её числом степеней свободы (i).
Для одного атома: i=3
Для двухатомной молекулы: i=3+2=5
Для трёхатомной молекулы и более: i=3+3=6
![]() через число
степеней свободы:
через число
степеней свободы:
![]()
Закон Больцмана
На каждую
поступательную и вращательную степень
свободы приходится средняя кинетическая
энергия равная
![]() ,а
на каждую колебательную –
,а
на каждую колебательную –![]()
i=iпоступательная +iвращательная+ 2iколебательная
9. Внутренняя энергия идеального газа
Во внутреннюю энергию не включаем внутреннюю энергию системы, как целого.
Внутренняя энергия системы – это сумма кинетической энергии молекул и потенциальной энергии их взаимодействия
![]()
![]()
10. Газ в потенциальном поле. Распределение Больцмана. Барометрическая формула

![]()
n– концентрация
e– экспонента
U– потенциальная энергия
k– постоянная Больцмана
T– температура,K
![]()
![]()
![]()
11. Распределение Максвелла по скоростям
![]()

![]()
![]()
![]()
12. Механическая работа в тепловых процессах
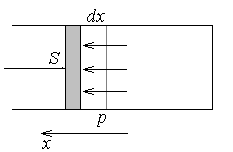


13. Первое начало термодинамики
Полученное
системой меток
![]() идет на изменение внутренней энергии
системы и совершённой системой работ.
идет на изменение внутренней энергии
системы и совершённой системой работ.
![]()
![]()

![]()
![]()
Создание двигателя, не употребляющего энергию извне (вечного) невозможно.
Теория тепловых двигателей и холодильников.
Тепловой двигатель – устройство, совершающее за счёт тепла механическую работу.
Холодильники передают тепло от тел с меньшей температурой к более нагретым за счёт механической энергии
![]() –прямой цикл
(тепловой двигатель)
–прямой цикл
(тепловой двигатель)
![]() –обратный цикл
(холодильник)
–обратный цикл
(холодильник)
![]() –КПД
–КПД
14. Теплоёмкость. Теплоёмкость при постоянном давлении. Теплоёмкость при постоянном объёме. Уравнение Майера
![]() –теплоёмкость
–теплоёмкость
Теплоёмкость единицы массы называется удельной, а единицы количества вещества – полярной.
1)
![]()
![]()
![]()
![]() │V=const
=
│V=const
=
![]()
2)
![]()
![]()

![]() –работа для
изобары
–работа для
изобары
![]()
![]()
![]()
![]()
![]() │p=const
=
│p=const
=![]()
![]() –уравнение
Майера
–уравнение
Майера
![]()
15. Работа в адиабатическом процессе. Уравнение Пуассона
Процесс теплообмена с окружающей средой:
![]()
![]()

![]()
![]()
![]()
![]()
 работа для
адиабаты
работа для
адиабаты
16. Энтропия, её статистический смысл. Второе начало термодинамики
Энтропия – степень хаоса.
Термодинамический
процесс называется обратимым, если он
может проходить как в прямом, так и в
обратном направлении, т.е. система должна
вернуться в исходное состояние без
изменений в окружающей среде
![]()
![]()
![]()
![]() (адиабатический
процесс)
(адиабатический
процесс)
Для неизолированной:
![]()
Если процесс
необратимый, то
![]()
Наибольшая степень хаоса в системе, находящейся в состоянии равновесия.
![]() –термодинамическая
вероятность состояния системы – число
способов, которых может быть реализовано
данное состояние макроскопической
системы или число микросостояний,
осуществляющие макросостояния.
–термодинамическая
вероятность состояния системы – число
способов, которых может быть реализовано
данное состояние макроскопической
системы или число микросостояний,
осуществляющие макросостояния.
Наибольшее число микросостояний соответствует равновесному состоянию.
![]() –вероятностное
определение Больцмана
–вероятностное
определение Больцмана
![]() в изолированной
системе – это второе начало термодинамики
в изолированной
системе – это второе начало термодинамики
Энтропия может либо не меняться, либо увеличиваться.
Следствия из второго начала термодинамики:
Периодически действующая машина, единственным результатом работ которой было бы превращение теплоты в работу, называется вечным двигателем IIрода.
Второе начало термодинамики запрещает ещё процессы, единственным результатом которых был бы переход тепла от менее нагретому к телам с большей температурой.
Теорема Нернста (III начало термодинамики)
![]()
