
15 Тема _ ПФ КОС _ 2015 _ лайт
.pdf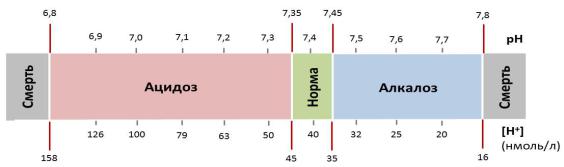
Тема: Патофизиология КОС _ 2015 _ лайт
Понятие о кислотно-основном состоянии
Кислотно-основное cостояние (син.: кислотно-щелочное равновесие) – это относительное постоянство соотношения кислот и оснований внутренней среды организма.
Реакция внутренней среды организма определяется концентрацией в ней ионов водорода (Н+). Для достижения гомеостаза необходимо соответствие между поступлением (образованием) ионов водорода и выведением их из организма.
В основе современных представлений о механизмах формирования реакции внутренней среды организма лежит протолитическая теория (теория Й.Брёнстеда), согласно которой кислотами считают вещества, освобождающие в процессе диссоциации ионы водорода, а основаниями – вещества, связывающие их.
Точная регуляция содержания Н+ имеет большое значение, поскольку концентрация этих ионов оказывает влияние на деятельность всех ферментных систем в организме. Для эффективного протекания процессов жизнедеятельности концентрация Н+ должна находиться в жёстких физиологических пределах. В связи с этим изменение содержания Н+ затрагивает практически все клетки и функции организма.
Поскольку концентрация Н+ в норме низка (около 40 нмоль/л в плазме крови) и большое количество цифр после запятой выглядит громоздко, концентрацию ионов водорода принято выражать в логарифмическом виде, обозначая, как рН (рис. 43):
рН = – log [Н+].
Показатель рН (англ. power Hydrogen – «сила водорода») – это отрицательный десятичный логарифм концентрации ионов водорода в растворе.
Из формулы следует, что рН обратно пропорционален концентрации ионов водорода. Следовательно, низкий уровень рН соответствует высокому содержанию Н+, а высокий – наоборот, свидетельствует о низком содержании Н+. Например, если рН=7, то концентрация Н+ равна 10–7 моль/л и соответствует нейтральному раствору чистой воды; растворы с высокой концентрацией Н+ – кислые (рН < 7), а с низкой концентрацией Н+ – щелочные (рН > 7).
Интегральным показателем реакции внутренней среды организма является рН плазмы крови. Физиологические колебания рН артериальной крови составляют 7,35-7,45 (рис. 43). Величина рН является жёстким гомеостатическим показателем. Уменьшение значения рН ниже 7,35, рассматривается как ацидоз (закисление крови), а увеличение более 7,45 – как алкалоз (защелачивание крови).
Рис. 43. Шкала рН / Н+
Сдвиг рН на 0,1 по сравнению с физиологической нормой способен вызвать нарушение функции дыхательной и сердечно-сосудистой систем, на 0,3 – изменение состояния центральной нервной системы. Границы предельных значений, при которых человек может выжить в течение нескольких часов, составляют 6,8 и 7,8, соответственно (рис. 1). Внутри клеток рН обычно немного ниже, чем в плазме, поскольку в результате обменных процессов образуются кислые
1
продукты. Таким образом, для эффективного протекания процессов жизнедеятельности концентрация ионов водорода должна находиться в жестких пределах. В противном случае нарушение этих процессов неминуемо приведёт к смерти.
Механизмы регуляции кислотно-основного состояния
В норме в организме образуется почти в 20 раз больше кислых продуктов, чем щелочных. В связи с этим доминируют системы, обеспечивающие нейтрализацию и экскрецию избытка соединений с кислыми свойствами.
Существуют три основных системы, деятельность которых направлена на регуляцию содержания Н+ в жидких средах, препятствующих возникновению ацидоза или алкалоза:
•химические буферные системы жидких сред организма, которые немедленно вступают
вхимическую реакцию с кислотой или щелочью, предотвращая изменение содержания Н+;
•система дыхания, дыхательный центр которой регулирует выведение углекислого газа (СО2) лёгкими (следовательно, угольной кислоты – Н2СО3) из внеклеточной жидкости;
•почки, которые способны выделять кислую или щелочную мочу, компенсируя таким образом состояние развившегося ацидоза или алкалоза.
Первой «линией обороны» при изменениях содержания ионов водорода являются химические буферные системы, которые за несколько секунд (10-30 с) способны устранить умеренные сдвиги КОС.
Второй «линией обороны» служит дыхательная система, которая за несколько минут
способна вывести из организма СО2, а следовательно, и Н2СО3.
Первые две «линии обороны» предотвращаю развитие значительных изменений в содержании Н+, пока более медленные механизмы третьей системы – выделительной – не устранят избыточное содержание кислот или оснований. По сравнению с другими системами почки действуют медленнее (несколько часов или суток), но эффективность их деятельности в поддержании КОС является более высокой.
Химические буферные системы жидких сред организма представлены гидрокарбонатным, фосфатным, белковым и гемоглобиновым буферами.
Буферный раствор – это смесь (в определённых соотношениях) слабой кислоты и сопряжённого с ней основания. Основным свойством буферных систем является способность противодействовать изменению рН при добавлении к ним в небольших количествах сильных кислот или оснований. Действие буферных систем ограничивается величиной их ёмкости.
Буферная ёмкость – величина, равная отношению сдвига рН к добавленному в раствор количеству ионов водорода (∆рН / [Н+]).
К основным буферным системам крови относятся: гидрокарбонатная, фосфатная, белковая (в плазме) и гемоглобиновая (в эритроцитах).
Гидрокарбонатный буфер – основной буфер крови и межклеточной жидкости.
Компонентами гидрокарбонатного буфера крови являются угольная кислота (Н2СО3) и гидрокарбонат (НСО3-) в соотношении 1:20 (это соотношение поддерживает рН на уровне 7,4).
Гидрокарбонатный буфер – это система открытого типа, она ассоциирована с функцией
внешнего дыхания и почек. Система внешнего дыхания поддерживает оптимальный уровень РаСО2 крови (и как следствие – концентрацию Н2СО3), а почки – содержание аниона НСО3-. Именно это обеспечивает функционирование гидрокарбонатной буферной системы в качестве эффективного и ёмкого буфера внеклеточной среды даже в условиях образования большого количества нелетучих кислот.
Гидрокарбонатный буфер используется как важный диагностический показатель состояния кислотно-основного состояния организма в целом.
Фосфатный буфер состоит из двух компонентов: роль кислоты выполняет дигидрофосфат
натрия (NaH2PO4), а роль основания – гидрофосфат натрия (Na2HPO4). Соотношение NaH2PO4 к Na2HPO4 составляет 1:4. Принцип действия фосфатного буфера аналогичен гидрокарбонатному.
Фосфатная буферная система играет существенную роль в регуляции КОС внутри клеток, особенно канальцев почек. Это обусловлено более высокой концентрацией фосфатов в клетках в сравнении с внеклеточной жидкостью. Эпителий канальцев почек содержит компоненты буфера в
2
максимальной концентрации, что обеспечивает его высокую мощность. В крови фосфатный буфер способствует поддержанию («регенерации») гидрокарбонатной буферной системы.
Белковый буфер. Буферные свойства белков основаны на их амфотерности. В кислой среде белки проявляют слабощелочные свойства и нейтрализуют кислоты. В щелочной среде они реагируют как слабые кислоты.
Гемоглобиновый буфер состоит из кислого компонента – оксигемоглобина (HbО2) и основного – восстановленного гемоглобина (Hb). Основная роль гемоглобиновой буферной системы заключается в её участии в транспорте СО2 от тканей к лёгким. Действует в эритроцитах, предупреждая изменения рН вследствие постоянного поступления из тканей СО2.
Вкрови и тканевой жидкости основной буферной системой является гидрокарбонатная, а во внутриклеточной жидкости – фосфатная и белковая.
Физиологические механизмы регуляции КОС. Исчерпанию резервов буферных систем препятствуют физиологические механизмы регуляции КОС: система внешнего дыхания, почки, печень, желудочно-кишечный тракт (ЖКТ), костная ткань.
Система внешнего дыхания обеспечивает постоянство содержания СО2 в артериальной крови. Для нормализации рН лёгким требуется 1-2 мин.
Впроцессе клеточного метаболизма непрерывно образуются кислоты двух типов: летучие, которые удаляются лёгкими, и нелетучие, которые выводятся через почки. Угольная кислота (Н2СО3), образующаяся путём гидратации СО2 в жидкостях организма, является летучей:
Н2О + СО2 ↔ Н2СО3 ↔ Н+ + НСО3-
В норме лёгкие выводят СО2 по мере образования, поэтому угольная кислота в организме не накапливается и не сдвигает рН внеклеточной жидкости. Образующийся из угольной кислоты НСО3- нейтрализуется катионами Na+ и К+.
При увеличении парциального давления СО2 в крови (гиперкапния) стимулируется дыхательный центр, развивается гипервентиляция и избыток СO2 удаляется из организма. При уменьшении парциального давления СО2 в крови (гипокапния), наоборот, происходит торможение дыхательного центра, развивается гиповентиляция и СO2 задерживается в организме.
Почечные механизмы регуляции КОС осуществляются за счёт способности почек экскретировать кислую или щелочную мочу и регулировать уровень гидрокарбоната (НСО3-) в крови. Основная роль почек в поддержании КОС: сохранение в крови гидрокарбоната и выведение из организма ионов водорода.
Для восстановления нормальных значений рН с участием почечных механизмов требуется продолжительное время – от нескольких часов до нескольких суток. Основная ценность их заключается в возможности удаления из организма избытка нелетучих кислот (не удаляемых через лёгкие – например, лактата, соляной кислоты и др.) либо оснований.
Основными механизмами регуляции КОС почками являются: ацидогенез, аммониогенез, секреция фосфатов и K+,Na+–обменный механизм.
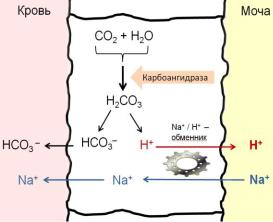
Ацидогенез – это процесс, протекающий в эпителии дистальных отделов нефрона и собирательных трубочек, обеспечивает секрецию в просвет канальцев Н+ в обмен на реабсорбируемый Na+. Количество секретируемого H+ эквивалентно его количеству, попадающему в кровь с кислотами. В результате ацидогенеза секретируемый в просвет почечных канальцев Н+ обменивается на реабсорбируемый Na+, который участвует в восстановлении гидрокарбонатной буферной системы (рис. 44).
Аммониогенез – образование и секреция в просвет почечных канальцев аммиака. Реализуется эпителием дистальных канальцев и собирательных трубочек. Аммониогенез осуществляется путём окислительного дезаминирования аминокислот, преимущественно глутамина. Образующийся при этом аммиак диффундирует в просвет канальцев и, соединившись с Н+, образует ион аммония (NH4+), который подщелачивает мочу. Ионы аммония замещают Na+ в солях и выделяются с мочой в виде хлорида аммония (NH4Cl) и сульфата аммония (NH4)2SO4. В кровь при этом поступает эквивалентное количество NaHСО3, обеспечивающего восстановление гидрокарбонатной буферной системы. Аммониогенез существенно активируется при снижении
3
рН мочи, благодаря чему рН мочи не опускается ниже 4,5 (при таком рН может развиться повреждение эпителия канальцев почек).
Рис. 44. Схема ацидогенеза в почках
Секреция фосфатов осуществляется эпителием дистальных канальцев при участии фосфатной буферной системы (кислый дигидрофосфат натрия NaН2РО4 выводится из организма с мочой).
Таким образом, секреция Н+ эпителием почечных канальцев осуществляется путём реализации трёх механизмов – ацидогенеза, аммониогенеза и секреции фосфатов, которые сопряжены с образованием гидрокарбоната и поступлением его в плазму крови. Это обеспечивает постоянное поддержание («регенерацию») одной из наиболее важных и ёмких буферных систем – гидрокарбонатного буфера.
К+,Na+–обменный механизм реализуется в дистальных канальцах нефрона и начальных участках собирательных трубочек. Обеспечивает обмен Na+ первичной мочи на K+, выводящийся в неё эпителиальными клетками. Реабсорбированный Na+ участвует в восстановлении гидрокарбонатной буферной системы. K+,Na+–обмен контролируется альдостероном. Кроме того, альдостерон регулирует (увеличивает) экскрецию эпителием почечных канальцев H+.
Таким образом, почечные механизмы регуляции КОС осуществляются путём экскреции Н+ и восстановления резерва гидрокарбонатной буферной системы в жидких средах организма.
Роль других органов в компенсации изменений КОС.
Печень: осуществляется синтез белков крови (белковый буфер); образование аммиака, нейтрализующего кислоты в жидких средах организма; «утилизация» лактата, пирувата, аминокислот с образованием глюкозы.
Желудок участвует в коррекции КОС путём изменения секреции HCl: торможение секреции HCl при защелачивании и усиление секреции HCl при закислении жидких сред организма.
Поджелудочная железа: секреция гидрокарбоната тормозится при избытке кислот в межклеточной жидкости и усиливается при их недостатке.
Кишечник: секреции кишечного сока, содержащего большое количество гидрокарбоната
(при этом в кровь поступает Н+); реабсорбции компонентов буферных систем (ионов Na+, K+, Ca2+, Cl-, НСО3-).
Костная ткань содержит большое количество солей угольной кислоты (карбонаты Na+, K+, Ca2+, Mg2+), которые могут обмениваться на Н+, компенсируя ацидоз.
Классификация нарушений кислотно-основного состояния
Типовыми формами нарушения кислотно-основного состояния являются ацидоз и алкалоз
(рис. 45).
Ацидоз – типовая форма нарушения КОС, характеризующаяся избытком в организме кислот. Развивается в результате увеличения концентрации H+ выше нормы или уменьшения концентрации НСО3- ниже нормы, что приводит к снижению рН артериальной крови ниже 7,35.
4
Алкалоз – типовая форма нарушения КОС, характеризующаяся избытком в организме оснований. Развивается вследствие уменьшения концентрации H+ в жидкостях организма или избытка НСО3-, что приводит к повышению рН артериальной крови более 7,45.
По причинам и механизмам развития нарушений КОС выделяют: газовые (син.: респираторные, дыхательные), негазовые и смешанные.
По происхождению нарушения КОС могут быть экзогенные и эндогенные, т.е. возникать либо вследствие избыточного или недостаточного поступления в организм кислых и щелочных продуктов, либо вследствие чрезмерного образования кислых метаболитов в организме и нарушенного их выделения.
Рис. 45. Классификация нарушений кислотно-основного состояния
По степени компенсированности нарушения КОС могут быть: компенсированные, субкомпенсированные и некомпенсированные (декомпенсированные). Определяющим параметром степени компенсированности нарушений КОС является величина рН.
Компенсированными сдвигами КОС считают такие, при которых рН крови не отклоняется за пределы диапазона нормы: 7,35-7,45. Компенсаторные механизмы поддерживают рН крови в пределах нормы за счёт химических и функциональных сдвигов, регулирующих КОС организма. При компенсированных формах нарушений КОС возможны изменения абсолютной концентрации компонентов гидрокарбонатной системы (Н2СО3 и HСО3-), однако соотношение [Н2СО3] / [HСО3-] сохраняется в диапазоне нормы (т.е. 1:20).
Промежуточные состояния КОС (между компенсированными и некомпенсированными) принято называть субкомпенсированными: рН 7,34 – 7,26 – cубкомпенсированный ацидоз, рН 7,46
– 7,54 – cубкомпенсированный алкалоз.
Некомпенсированные нарушения КОС: рН 7,25 и ниже – некомпенсированный ацидоз, рН 7,55 и выше – некомпенсированный алкалоз. Некомпенсированные ацидозы и алкалозы характеризуются значительными отклонениями как абсолютной концентрации Н2СО3 и HСО3-, так и их соотношения.
По клиническому течению выделяют острые и хронические нарушения КОС. Для компенсации острых нарушений КОС бывают задействованы зачастую только буферные системы организма, в регуляции хронических отклонений рН принимают участие лёгкие, почки и другие органы.
5
Показатели кислотно-основного состояния Показатель рН – отрицательный десятичный логарифм концентрации Н+ в растворе –
является интегральным показателем КОС.
РаСО2 (парциальное давление СО2 в артериальной крови) отражает концентрацию угольной кислоты. Показатель дыхательных нарушений КОС.
НСО3- – концентрация гидрокарбоната в плазме крови. На величину показателя влияют
дыхательные и метаболические нарушения КОС.
SB («Standart Bicarbonate», стандартный бикарбонат) – это концентрация гидрокарбоната в плазме крови, приведенная к стандартным условиям (t = 37°С, РаСO2 = 40 мм рт.ст.). Показатель
метаболических нарушений КОС.
ВВ («Buffer Bases», буферные основания) – совокупность всех оснований крови (все анионы крови, обладающие буферными свойствами). Cуммарная концентрация буферных оснований (ВВ) не зависит от РаСО2, по ней можно судить о сдвигах КОС, вызванных изменением содержания нелетучих кислот в крови.
BE («Base Excess», избыток оснований) – показатель отклонения концентрации буферных оснований от нормального уровня (т.е. от BB). При патологическом увеличении содержания буферных оснований ВЕ становиться положительным (избыток буферных оснований), а при снижении – отрицательным (в этом случае можно использовать термин «дефицит оснований»). ВЕ отражает метаболические (негазовые) нарушения КОС.
Этиология, патогенез и виды ацидозов Газовый ацидоз возникает при снижении вентиляции лёгких и увеличении парциального
давления СО2 в артериальной крови (гиперкапния – ↑ РаСО2). Вследствие этого возрастает содержание Н2СО3 и Н+, что вызывает развитие ацидоза. Поскольку это нарушение вызвано расстройством функции дыхания, его называют дыхательным ацидозом. Характеризуется снижением рН крови и гиперкапнией (↑РаСО2).
К дыхательному ацидозу могут привести повреждение дыхательного центра в продолговатом мозге, обструкция дыхательных путей, пневмония, эмфизема, высокая концентрация СО2 во вдыхаемом воздухе (например, нахождение в замкнутом помещении, колодце и т.д.), а также любая патология, вследствие которой нарушается газообмен между кровью и альвеолярным воздухом (в том числе, несоблюдение методики искусственной вентиляции лёгких (ИВЛ).
Компенсаторные механизмы при дыхательном ацидозе развиваются с помощью: буферных систем жидких сред организма; почек, которые медленно, в течение нескольких суток устраняют возникшие нарушения.
Негазовый ацидоз возникает вследствие снижения содержания ионов гидрокарбоната во внеклеточной жидкости.
Виды негазового ацидоза: экзогенный, метаболический, выделительный.
Экзогенный ацидоз возникает вследствие поступления в организм кислот через пищеварительный тракт. Может развиться при длительном потреблении кислых продуктов (например, содержащих лимонную или яблочную кислоты и др.), приёме некоторых лекарств (например, аспирина и др.); отравлениях кислотами (например, уксусной и др.), спиртами (например, метанол, который метаболизирует с образованием муравьиной кислоты).
Метаболический ацидоз развивается вследствие накопление во внеклеточной жидкости эндогенных кислот-метаболитов (лактата, кетоновых тел и др.). Развивается при сахарном диабете (увеличение кетоновых тел), гипоксии (увеличивается содержание лактата), голодании (увеличение кетоновых тел), подагре (накопление мочевой кислоты).
Выделительный ацидоз возникает вследствие потери НСО3- при нарушении функции почек и пищеварительной системы. Его разновидностями являются (рис. 46):
• почечный выделительный ацидоз (канальцевый ацидоз) возникает вследствие недостаточной секреции Н+ в канальцах и/или нарушении реабсорбции НСО3- (вследствие этого происходит выделение щелочной мочи). Причины: почечная недостаточность (например, при гломерулонефритах и т.д.); недостаточная секреция альдостерона (болезнь Аддисона);
6
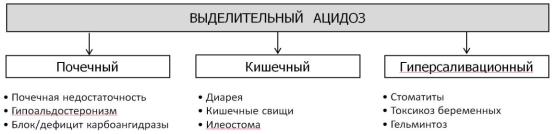
наследственные или приобретённые заболевания, связанные с нарушением функции карбоангидразы эпителия почечных канальцев (например, действие сульфаниламидов, диакарба и др.).
• выделительный ацидоз, обусловленный нарушением деятельности ЖКТ: потеря НСО3-
вследствие диареи, кишечных свищей, илеостомы, гиперсаливации (например, при стоматитах, токсикозе беременных, гельминтозах и др.).
Рис. 46. Виды выделительного ацидоза
Негазовые ацидозы с анионным промежутком. Для поддержания
электронейтральности в организме концентрации анионов и катионов в плазме крови должны быть равны друг другу. (Закон электронейтральности: «При изменениях баланса между кислотами
иоснованиями соотношение между анионами и катионами в данной среде не изменяется»).
Вклинической лаборатории в связи с определёнными техническими трудностями измеряют содержание не всех анионов.
Анионный промежуток (англ. Anion Gap, AG) – это концентрация неизмеряемых при обычных исследованиях анионов (например, фосфатов, сульфатов, салицилатов и др.).
Анионный промежуток (АП) рассчитывают по формуле:
АП = (Na+ + К+) – (Cl- + НСО3-) = 8-16 ммоль/л (в норме)
Увеличение анионного промежутка указывает на повышение содержания неизмеряемых анионов (например, салицилатов и др.).
Определение АП используют в диагностике различных вариантов негазового ацидоза. Вычисляя анионный промежуток, можно ограничить круг возможных причин развития негазового ацидоза. Выделяют негазовые ацидозы с увеличенным и нормальным анионным промежутком.
Негазовые ацидозы с увеличенным АП. Причины: увеличение содержания в организме кислот (эндоили экзогенных): лактат-ацидоз (например, при гипоксии, шоке, сепсисе, инфаркте миокарда и др.); кетоацидоз (например, при cахарном диабете, голодании, алкоголизме); отравления кислотами и спиртами (например, аспирином, метанолом, этиленгликолем и др.);
почечная недостаточность.
Негазовые ацидозы с нормальным АП. Причины: потеря организмом гидрокарбоната, что компенсируется увеличением содержания Cl- в плазме крови (гиперхлоремия). К таким ацидозам относятся выделительные ацидозы, а также ацидозы, возникающие при введении в
организм хлоридов: диарея; почечный канальцевый ацидоз (в результате применения диуретиков, например, диакарба); недостаточность надпочечников (например, болезнь Аддисона);
потребление хлорида аммония.
Механизмы компенсации ацидоза направлены на нейтрализацию избытка Н+: активация буферных систем, увеличение вентиляции лёгких, почечные механизмы.
Проявления ацидозов. Одним из наиболее выраженных симптомов при негазовом ацидозе является увеличение альвеолярной вентиляции, возникающей как дыхательная компенсация. При тяжёлом ацидозе может возникнуть глубокое и шумное дыхание – дыхание Куссмауля.
Нарастающее угнетение нервной системы, что проявляется сонливостью, заторможенностью, в тяжёлых случаях может возникнуть кома (например, при кетоацидозе у пациентов с сахарным диабетом).
7
Снижается тонус стенки сосудов, повышается их проницаемость. Это приводит к развитию гиповолемии, уменьшению притока крови к правому предсердию, снижению сердечного выброса. Снижается кровоток в мозге, миокарде и почках. Это усугубляет нарушение функций нервной системы, сердца, а также обусловливает олигурию (уменьшение диуреза).
Недостаточное выведение почками калия, натрия, хлора и других электролитов из организма приводит к повышению осмотического давления в крови и межклеточной жидкости, что ведёт к обезвоживанию клеток и их повреждению, и таким образом, к прогрессирующему развитию ацидоза и общей интоксикации. Объём внеклеточной жидкости, наоборот, возрастает, развиваются отёки.
Ацидоз усиливает парасимпатические эффекты (вызывает возбуждение центра блуждающего нерва) – развивается брадикардия, может возникнуть остановка сердца в диастоле.
При ацидозе часть Н+ из плазмы перемещается внутрь клеток в обмен на ионы калия, возникает гиперкалиемия. При выраженной гиперкалиемии возможны мышечные параличи, нарушения сердечного ритма, вплоть до полной остановки сердца. При хроническом ацидозе происходит обмен Н+ внеклеточной жидкости на ионы Са2+ костной ткани, что приводит к развитию остеопороза.
Этиология, патогенез, виды алкалозов Газовый алкалоз возникает вследствие увеличения вентиляции лёгких и снижения
парциального давления СО2 в артериальной крови (гипокапния – ↓РаСО2). Характеризуется увеличением рН артериальной крови и гипокапнией.
Патологические состояния, при которых возникает газовый алкалоз, достаточно редки. Причины: психогенное возбуждение, сопровождаемое гипервентиляцией; поражение ЦНС (например, опухоли головного мозга); при подъёме на высоту (горная болезнь); гипервентиляция при проведении искусственной вентиляции лёгких.
Компенсаторные механизмы при дыхательном алкалозе развиваются с помощью буферных систем организма и почек, которые способны усилить выведение ионов гидрокарбоната.
Негазовый алкалоз возникает вследствие повышенного содержания гидрокарбонатов во внеклеточной жидкости.
Виды негазовых алкалозов: экзогенные, метаболические, выделительные.
Экзогенный алкалоз обусловлен поступлением в организм экзогенных оснований. Сравнительно редкое нарушение КОС. Наиболее частой причиной такого алкалоза является применение пищевой соды (NaHCО3), используемой при лечении (самолечении) гастрита или язвы желудка.
Метаболический алкалоз развивается в результате избыточной секреции альдостерона
надпочечниками при первичном (например, аденома надпочечников) или вторичном (например, при сердечной недостаточности и др.) гиперальдостеронизме. Альдостерон увеличивает реабсорбцию Na+ из дистальных канальцев нефронов и в то же время стимулирует секрецию Н+, что приводит к их выведению из организма с мочой и, следовательно, к метаболическому алкалозу.
Гипофункция паращитовидных желёз сопровождается снижением содержания в крови ионов Са2+ (гипокальциемия) и повышением концентрации Na2НРО4 (гиперфосфатемией). Снижение уровня паратиреоидного гормона при гипопаратиреозе вызывает торможение высвобождения кальция из костей, стимулирует его выведение почками и активирует реабсорбцию фосфатов в канальцах почек.
Выделительный алкалоз. Выделяют следующие виды выделительного алкалоза (рис. 47). Желудочный выделительный алкалоз (гипохлоремический алкалоз) развивается
вследствие потери организмом соляной кислоты при рвоте (например, при токсикозе беременных, пилороспазме и др.).
Почечный выделительный алкалоз (гипохлоремический алкалоз) обусловлен длительным применением мочегонных средств, угнетающих реабсорбцию в канальцах почек ионов натрия, хлора и калия, в результате чего усиливается реабсорбция гидрокарбоната (например, применение фуросемида, гипотиазида и др.).
8
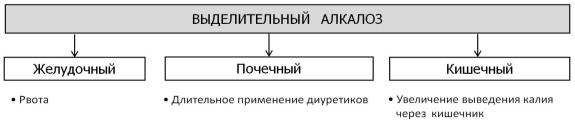
Кишечный выделительный алкалоз (гипокалиемический алкалоз) развивается вследствие повышенного выведения из организма калия через кишечник (например, в результате частого применения слабительных средств, клизм), что приводит к развитию гипокалиемии. При хронической гипокалиемии происходит выход из клеток калия в обмен на Н+. Это сопровождается повышением уровня гидрокарбоната во внеклеточной жидкости.
Компенсаторные механизмы при алкалозе развиваются с помощью снижения лёгочной вентиляции (развитие гиперкапнии) и уменьшения секреции почками ионов водорода (снижением ацидогенеза). Механизмы устранения алкалозов менее эффективны, чем ацидозов.
Рис. 47. Виды выделительного алкалоза
Проявления алкалозов. Гипокапния, возникающая при газовом алкалозе, снижает возбудимость дыхательного центра (угнетение дыхания), может вызывать спазм сосудов головного мозга и сердца, что приводит к ухудшению их кровоснабжения.
При алкалозе ионизированный кальций (iСа2+) плазмы крови в большей степени связывается с белками, что приводит к развитию гипокальциемии. Гипокальциемия проявляется повышением нервно-мышечной возбудимости: возникают судороги вплоть до тетании, ларингоспазм, судорожные подёргивания мышц лица, конечностей.
При алкалозе происходит выход Н+ из клетки во внеклеточную жидкость. При этом, ионы калия, наоборот, поступают в клетку. Развивается гипокалиемия, проявляющаяся мышечной слабостью, нарушением перистальтики желудка и кишечника (запоры), нарушениями ритма сердца.
Смешанные нарушения КОС
Смешанные нарушения КОС представляют собой одновременное развитие разных по причине и механизму нарушения кислотно-основного состояния (одновременно возникают газовые и негазовые нарушения КОС).
Если первичные изменения КОС имеют разнонаправленный характер (т.е. ацидоз – алкалоз), то проявления будут сходны с компенсированным нарушением кислотно-основного состояния и изменения рН будут минимальны. Например, отравление салицилатами, при котором первичная гипервентиляция (газовый алкалоз) и метаболический ацидоз (салицилаты – это кислоты) возникают независимо.
Если же оба процесса сдвигают рН в одну сторону (метаболический ацидоз и газовый ацидоз или метаболический алкалоз и газовый алкалоз), то это может привести к выраженному ацидозу или алкалозу.
Примеры. Смешанный ацидоз. Например, при острой сердечной недостаточности развивается газовый ацидоз (кардиогенный отёк лёгких) и негазовый ацидоз (циркуляторная гипоксия).
Смешанный алкалоз. Например, травма головного мозга может проявляться газовым (гипервентиляция лёгких) и негазовым алкалозом (вследствие рвоты желудочным содержимым).
Смешанный ацидоз является одним из наиболее опасных видов нарушения КОС. Часто наблюдается при выраженной дыхательной недостаточности (газовый ацидоз), когда гиперкапния сопровождается гипоксемией, что вызывает кислородное голодание тканей и развитие негазового ацидоза.
9

Принципы профилактики и лечения
Основным видом лечения нарушений КОС является устранение причины, вызвавшей патологию. Часто это трудновыполнимая задача, особенно при хронической патологии, связанной с нарушением функции лёгких или почечной недостаточностью.
Для нейтрализации избытка кислоты можно назначить приём внутрь гидрокарбоната натрия (питьевой соды). Приём соды после всасывания в желудочно-кишечном тракте увеличит объём гидрокарбонатной буферной системы и приведёт к возрастанию рН до нормы.
Для лечения алкалоза можно использовать хлорид аммония, принимая его внутрь. Когда хлорид аммония поступает в кровь, он частично преобразуется в печени в мочевину. Эта реакция сопровождается выделением HCl, которая быстро реагирует с буферными системами жидких сред, смещая равновесие в кислую сторону.
Оценка нарушений кислотно-основного состояния организма
Простые виды нарушений КОС могут быть диагностированы на основании анализа трёх параметров, определённых в артериальной крови: рН, РаСО2 и ВЕ.
План анализа вида нарушений КОС:
1.Установить вид нарушения КОС: ацидоз или алкалоз.
2.Определить степень компенсации ацидоза или алкалоза (компенсированный, субкомпенсированный, некомпенсированный).
3.Установить вид нарушения КОС по причине и механизму развития (газовый или негазовый).
4.Оценить наличие механизмов компенсации первичных нарушений КОС (есть / нет). Общие рекомендации. Чрезмерных компенсаций КОС не бывает. Если рН < 7,35 – это
первичный ацидоз, если рН > 7,45 – первичный алкалоз. В центре внимания должен быть пациент, а не анализ газов крови (т.е., внимательно изучите клиническую задачу – 90% правильного ответа содержится в самом условии задачи!).
Частные рекомендации.
1.Оценить значение рН (вид нарушения КОС – ацидоз или алкалоз). Если рН в пределах нормы – возможно имеется компенсированное нарушение КОС (только по значению рН крови определить нарушение КОС невозможно!).
2.Оценить значение РаСО2 (отражает дыхательный компонент нарушения КОС): если РаСО2 > 45 мм рт.ст. – гиперкапния, газовый ацидоз; если РаСО2 < 35 мм рт.ст. – гипокапния, газовый алкалоз.
3.Оценить значение ВЕ («избыток буферных оснований»). Этот показатель отражает негазовые нарушения КОС. Если ВЕ > + 2,3 ммоль – имеется избыток оснований (негазовый алкалоз), если ВЕ < -2,3 ммоль/л – имеется недостаток оснований (негазовый ацидоз).
4.Оценка других лабораторных показателей имеет дополнительное («вспомогательное») значение. Увеличение показателя «титруемая кислотность суточной мочи» свидетельствует о выведении почками избытка кислых продуктов из организма.
Задача (пример решения). Больная Н., 55 лет. Поступила на лечение по поводу обострения
хронического |
бронхита, которым |
страдает более |
10 |
лет. Показатели кислотно-основного |
||||
состояния крови: |
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
Данные анализа крови |
|
Нормальные |
|
|
Интерпретация показателей |
|
|
|
|
пациента |
|
значения |
|
|
|
|
|
|
|
показателй КОС |
|
|
|
|
|
|
|
1 |
|
2 |
|
3 |
4 |
|
|
рН крови |
= 7,37 |
|
7,35-7,45 |
|
N |
Компенсированное нарушение КОС |
|
|
РаСО2 |
= 56 мм рт.ст. |
|
35-45 |
|
↑ |
Гиперкапния, газовый ацидоз |
|
|
НСО3- |
= 32 ммоль/л |
|
22-26 |
|
↑ |
Повышено содержание НСО3- |
|
|
ВЕ |
= 7,5 ммоль/л |
|
– 2,3 до +2,3 |
|
↑ |
Избыток буферных оснований, |
|
|
|
|
|
|
|
|
негазовый алкалоз |
|
|
|
|
|
|
|
|
10 |
|
