
Коноплева 2013
.pdf
III. Неофлавоноиды с фенильным радикалом у С4:
O
OO
4-БЕНЗОКУМАРИН 4-БЕНЗОХРОМАН
(неофлаван)
IV. Бифлавоноиды
Кроме мономерных флавоноидов существуют димерные формы - флавоноиды могут конденсироваться между собой углеродуглеродными связями и другими фенольными соединениями: фенолкарбоновыми и оксикоричными к-тами, лигнанами, с изопреноидами и алкалоидами.
O
O
O
O
БИФЛАВОН
В растениях большинство флавоноидов присутствует в виде гликозидов (кроме катехинов и лейкоантоцианов). В качестве углеводной части могут быть моносахариды: D-глюкоза, D-галактоза, D- ксилоза, L-рамноза и др. В некоторых случаях встречаются специфические дисахариды: рутиноза (рамноза и глюкоза), софороза (2 молекулы глюкозы).
Сахара могут присоединяться к агликону в 3, 7, 3', 4' и др. положениях. Для флавоноидов характерно гидроксилирование. Оно возможно почти во всех положениях. У некоторых флавоноидов гидроксилы метилированы.
Основную группу флавоноидов составляют О-гликозиды; в меньшей степени распространены С-гликозиды, где углеводные компоненты связаны с агликоном через углеродный атом в 6 или 8 положениях. Известны также ацилированные гликозиды, содержащие ацильные остатки в агликоновой или в углеводной части молекулы. Ацилирующими агентами могут быть бензойная, уксусная, протока-
173
теховая, кофейная и др. кислоты. О-гликозиды в зависимости от числа остатков сахара, положения и порядка их присоединения делятся на монозиды, биозиды, триозиды и дигликозиды. В дигликозидах моносахара присоединяются в двух разных положениях флавоноидного ядра.
РАСПРОСТРАНЕНИЕ ФЛАВОНОИДОВ В РАСТИТЕЛЬНОМ МИРЕ
Флавоноиды широко распространены в высших растениях, встречаются они в водорослях и грибах, значительно реже - в микроорганизмах и насекомых.
Около 40% флавоноидов приходится на группу производных флавонола, несколько меньше - флавона, значительно реже встречаются флаваноны, халконы, ауроны.
Наиболее богаты флавоноидами растения семейств:
Бобовые |
(Fabaceae), |
Астровые |
(Asteraceaе), |
Сельдерейные (Apiaceae), |
Яснотковые |
(Lamiaceae), |
|
Розоцветные |
(Rosaceae), |
Гречишные |
(Polygonaceae), |
Березовые |
(Betulaceae), |
Рутовые |
(Rutaceae) и др. |
ЛОКАЛИЗАЦИЯ ФЛАВОНОИДОВ В РАСТЕНИЯХ
Врастениях флавоноиды локализуются в различных органах и частях растений:
- бутонах (софора японская), - цветках, обуславливая окраску лепестков (бессмертник песча-
ный, василек синий, пижма обыкновенная), - листьях (боярышники),
- траве (горцы: птичий, почечуйный, перечный; хвощ полевой), - плодах (боярышники, софора японская), - корнях (стальник пашенный, шлемник байкальский).
Содержание их в растениях колеблется от 0,5 до 30% (бутоны софоры японской).
Вклетках растений флавоноиды накапливаются в форме гликозидов, главным образом в вакуолях, а в свободном состоянии - в специальных образованиях, зачастую имеющих довольно сложное строение - смоляных и эфиромасличных ходах, канальцах, вместилищах, железках и т.д. В надземных частях растений более 85% суммы флавоноидов локализуется в клетках эпидермы и только 15% - в остальных тканях.
174
БИОЛОГИЧЕСКАЯ РОЛЬ ФЛАВОНОИДОВ В ЖИЗНИ РАСТЕНИЙ
Биологическая роль флавоноидов в жизни растений изучена еще недостаточно.
Некоторые авторы считают, что флавоноиды принимают уча-
стие:
•в окислительно-восстановительных процессах растений;
•в выработке иммунитета;
•в защите растений от неблагоприятных воздействий ультрафиолетовых лучей и низких температур;
•в процессе оплодотворения высших растений;
•обуславливают огромное разнообразие окрасок цветков и плодов, что привлекает насекомых и тем самым способствуют опылению;
•некоторые флавоноиды защищают аскорбиновую кислоту, хлорофилл от окисления (т.е. являются антиоксидантами).
ВЛИЯНИЕ ВНЕШНИХ ФАКТОРОВ НА НАКОПЛЕНИЕ ФЛАВОНОИДОВ
1.На накопление флавоноидов оказывают влияние возраст и фаза развития растения. В молодых растениях их больше; в старых растениях их количество уменьшается.
Максимальное содержание флавоноидов наблюдается в цветках, листьях и травах в период бутонизации и цветения, а к фазе плодоношения содержание снижается; в плодах и семенах - в период молочной зрелости - полного созревания; в корнях - в период увядания надземной массы осенью.
2.На накопление флавоноидов влияет освещенность. Содержание флавоноидов в растениях увеличивается с ростом
освещенности, а степень их гидроксилирования (число -ОН групп) - с увеличением высоты над уровнем моря.
3. На накопление флавоноидов влияет температура. Содержание антоцианов увеличивается при понижении температуры (покраснение листьев у щавеля), у других групп флавоноидов, наоборот, содержание увеличивается при повышении температуры.
ФИЗИКО-ХИМИЧЕСКИЕ СВОЙСТВА
1.Большинство флавоноидов - твердые кристаллические вещества с определенной температурой плавления, не имеющие запаха.
2.Окрашены в желтый цвет (флавоны, флавонолы, халконы, ауроны) или бесцветные (катехины, лейкоантоцианидины, флавано-
175
ны, изофлавоны). Наиболее яркие оттенки свойственны антоцианам, которые придают растительным тканям красную или синюю окраску
взависимости от рН среды. В кислой среде они имеют красный цвет (соли катионов), в щелочной - синий (соли анионов).
3.Гликозиды (содержащие в молекуле 3 и более остатков сахара) растворимы в воде, водно-спиртовых смесях, в спиртах при нагревании, этилацетате и нерастворимы в органических растворителях
(петролейном и диэтиловом эфирах, дихлорэтане, ССl4).
Агликоны хорошо растворимы в низших спиртах (метиловом и этиловом), органических растворителях (диэтиловом эфире, ацетоне, бензоле) и в растворах щелочей. Нерастворимы в воде. Многие метоксилированные флавоноиды (например, пиностробин) растворяются в хлороформе.
4.Гликозиды обладают оптической активностью.
5.О-гликозиды при действии разбавленных минеральных кислот и ферментов легко гидролизуются до агликона и углеводного остатка. С-гликозиды с трудом расщепляются под действием концен-
трированных кислот (HCl или СН3СООН) или их смесей при длительном нагревании.
6.Катехины и лейкоантоцианидины, как правило, гликозидных форм не образуют. Они легко окисляются в присутствии кислорода, под действием света и щелочей. Остальные флавоноиды более устойчивы к окислению.
7.Флавоноиды флуоресцируют в УФ-свете: при этом флавоны, флавонол-3-гликозиды, флаваноны, халконы обнаруживаются на хроматограммах в виде коричневых пятен, флавонолы и их 7-гликозиды -
ввиде желтых или желто-зеленых пятен.
8.Свободная ОН-группа 7 положения способна диазотировать-
ся.
9.Благодаря карбонильным и фенольным оксигруппам флавоноиды способны образовывать комплексы с солями металлов различной степени устойчивости.
10.Флавоноиды способны восстанавливаться атомарным водородом в кислой среде в присутствии магния или цинка.
11.Флавоноиды взаимодействуют со щелочами с образованием фенолятов желтой окраски, которая при нагревании изменяется до оранжевой или коричневой.
МЕТОДЫ ВЫДЕЛЕНИЯ ФЛАВОНОИДОВ ИЗ ЛРС
Для флавоноидов не существует универсального метода выделения из растительного сырья. В каждом конкретном случае учиты-
176
ваются свойства выделяемых веществ, сопутствующие вещества и особенности растительного сырья.
Для выделения флавоноидов проводят экстрацию ЛРС одним из подходящих растворителей: этанолом, метанолом, горячей водой или спирто-водной смесью.
Для очистки и разделения используют:
•избирательную экстракцию;
•осаждение солями тяжелых металлов;
•хроматографические методы.
ВЫДЕЛЕНИЕ ФЛАВОНОИДОВ ИЗ ЛРС с использованием избирательной экстракции (схема 9)
1.Экстракция суммы флавоноидов из ЛРС (70%,80% этанолом или метанолом).
2.Отгонка спирта под вакуумом до водного остатка.
3.Очистка полученной суммы флавоноидов СCl4 от липофильных веществ.
4.Разделение флавоноидов на фракции растворителями с возрастающей полярностью:
1) экстракция агликонов этиловым эфиром;
2) экстракция моногликозидов этилацетатом;
3) экстракция биозидов, триозидов и др. полярных флавоноидов н-бутанолом.
5.Разделяют полученные фракции с помощью колоночной хроматографии на полиамидном сорбенте, силикагеле или целлюлозе. Элюирование веществ проводят смесью хлороформа с этанолом или спирто-водными смесями с возрастающей концентрацией спирта.
Важно подчеркнуть, что для разделения и очистки флавоноидов нельзя использовать оксид алюминия, с которым флавоноидные соединения образуют так называемые лаки – продукты необратимой реакции.
Контроль за ходом разделения флавоноидов проводят методом хроматографии: используют ТСХ, БХ или высокоэффективную жидкостную хроматографию. Наиболее подходящими системами для БХ флавоноидов являются:
15%, 60% РАСТВОРЫ УКСУСНОЙ КИСЛОТЫ; БУТАНОЛ - УКСУСНАЯ КИСЛОТА - ВОДА (4:1:5). Для ТСХ: ХЛОРОФОРМ-МЕТАНОЛ (8:2).
177
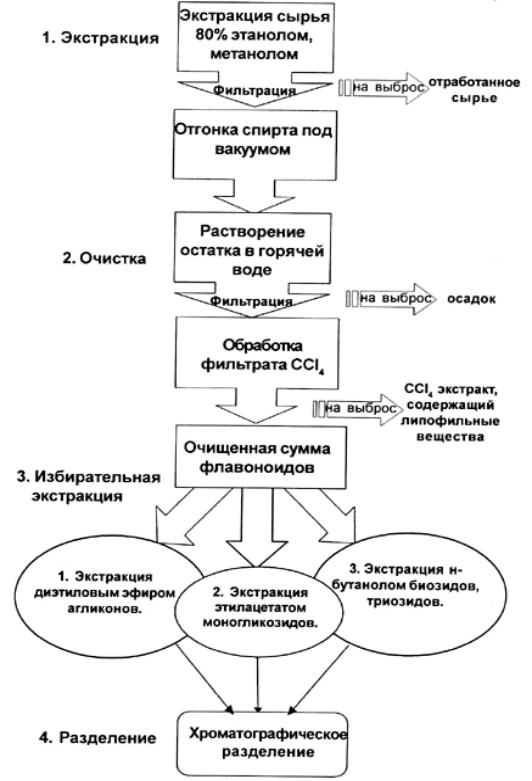
Схема 9
Схема выделения флавоноидов из ЛРС с использованием избирательной экстракции
178
6. Установление структуры выделенных соединений проводят с помощью физико-химических методов:
•определение температуры плавления;
•определение удельного вращения (гликозидов);
•сравнение УФ-, ИК-, масс-, ПМР-спектров со спектрами известных образцов.
КАЧЕСТВЕННЫЕ РЕАКЦИИ
Для обнаружения флавоноидов в ЛРС используют химические реакции и хроматографию. Химические реакции подразделяются на цветные и реакции осаждения.
I. Цветные реакции
1. Специфической реакцией на флавоноиды является цианидиновая проба (проба Шинода), основанная на восстановлении карбонильной группы атомарным водородом в кислой среде в присутствии металлического магния и образовании антоцианидинов. Продукты восстановления флавонов имеют окраску оранжевую, флавонолов, флаванонов - красно-фиолетовую. При использовании цинка положительную реакцию дают флавонолы и флавонол-3-гликозиды, а флаваноны не дают её. Цианидиновую реакцию не дают также изофлавоны, неофлавоноиды, халконы и ауроны. Халконы и ауроны образуют красное окрашивание при добавлении концентрированной хлористоводородной кислоты за счет образования оксониевых солей.
|
OH |
|
OH |
HO |
O |
HO |
O+ |
|
OH + Mg + HCl |
|
OH |
|
- H2O |
|
Cl |
|
|
OH |
|
|
OH |
|
|
OH |
O |
|
OH |
КВЕРЦЕТИН |
ЦИАНИДИН ХЛОРИД |
||
Цианидиновая реакция по Брианту позволяет определить агликоновую или гликозидную природу исследуемого вещества. К окрашенному раствору продукта цианидиновой реакции прибавляют равный объём н-октанола (или бутанола), разбавляют водой до разделения слоёв и встряхивают. Гликозиды остаются в воде, а агликоны переходят в слой органического растворителя.
2. Реакция со щелочами (аммиаком) - флавоноиды дают различную окраску от желтой до коричневой; халконы и ауроны со ще-
179
лочами дают красное окрашивание или ярко-желтое; антоцианидины - синее окрашивание.
3. Флавоноиды, благодаря карбонильным и фенольным гидроксигруппам, способны образовывать комплексы с солями металлов:
•с хлоридом железа окисного (III) флавоноиды образуют комплексы, окрашенные в различные цвета в зависимости от структуры (от зеленого до коричневого цвета);
•борно-лимонная реакция (реакция Вильсона) - 5- гидроксифлавоны и 5-гидроксифлавонолы взаимодействуют с борной кислотой в присутствии лимонной (или щавелевой), образуя комплекс ярко-желтого окрашивания с желто-зеленой флуоресценцией в УФсвете (образование батохромного комплекса).
Если флавонол или флавон не содержит гидроксил в 5 положении, то реакция протекает за счет гидроксила 3 положения;
OH
HO O
 OH
OH
OH
OO
B
OO
OO
•реакция с треххлористой сурьмой - 5-гидроксифлавоны и 5- гидроксифлавонолы, взаимодействуя с треххлористой сурьмой, образуют комплексные соединения, окрашенные в желтый или красный цвет;
OH
HO O
 OH
OH
OH
OO
Sb
Cl  Cl
Cl
• многие флавоноиды дают окрашенные комплексы желтого цвета и желто-зеленую флуоресценцию с 5% спиртовым раствором
алюминия хлорида, с 2% спиртовым раствором циркония хлорида.
Флавоноиды, имеющие две гидроксигруппы у С3 и С5, дают хелаты жёлтого цвета за счёт образования водородных связей между карбонильной и гидроксильными группами:
180
HO  O
O
OH
HO O
Al
Реакция с раствором алюминия хлорида довольно специфическая и часто используется в методиках количественного определения флавоноидов.
4. Флавоноиды со свободной 7-гидроксигруппой вступают в реакцию с солями диазония, образуя оранжевые или красные продукты азосочетания.
II. Реакции осаждения
Все флавоноиды с основным ацетатом свинца образуют осадки, окрашенные в ярко-желтый или красный цвет.
Средним ацетатом свинца осаждаются лишь флавоноиды, содержащие свободные орто-гидроксильные группы в 3', 4' -положениях кольца В.
III. Хроматография
Для обнаружения флавоноидов в растительном материале широко используется бумажная и тонкослойная хроматография. Обнаружение флавоноидов на хроматограммах проводят:
•по окраске пятен в видимом свете (антоцианы);
•по характеру свечения в УФ-свете: флавоны, флавонол-3-О- гликозиды, флаваноны и халконы обнаруживаются в виде темнокоричневых пятен, флавонолы и их 7-О-гликозиды - в виде желтых или желто-зеленых;
•по характеру свечения в УФ-свете после проявления 5%-ным спиртовым раствором хлорида алюминия и последующего прогревания хроматограммы при 105°С 2-3 мин: наблюдают пятна флавоноидов с интенсивной желтой и желто-зеленой флуоресценцией.
КОЛИЧЕСТВЕННОЕ ОПРЕДЕЛЕНИЕ
Для количественного определения флавоноидов в растительном сырье наибольшее распространение получили физико-химические методы, прежде всего ВЭЖХ (быстрота и точность определения), фотоколориметрия и спектрофотометрия.
181
1. Фотоколориметрический метод основан:
•на цветных реакциях комплексообразования с солями различных металлов (алюминия, циркония, хрома, сурьмы);
•на реакции с лимонно-борным реактивом;
•на реакции восстановления атомарным водородом в кислой среде в присутствии металлического магния или цинка.
2. Спектрофотометрический метод, основанный на способности флавоноидов поглощать свет в УФ-области спектра.
3. Хромато-спектрофотометрический метод - более совершенный метод количественного определения флавоноидов, используется в сочетании с хроматографией, что позволяет произвести очистку
иразделение суммы веществ на отдельные компоненты.
Реже используют:
4.Флюориметрический метод.
5.Полярографический метод.
6.Наличие фенольных гидроксилов, обуславливающих слабокислые свойства флавоноидов, позволяет использовать метод кис- лотно-основного титрования в неводных растворителях: диметилформамиде, диметилсульфоксиде, ацетоне.
ЗАГОТОВКА, СУШКА И ХРАНЕНИЕ СЫРЬЯ, СОДЕРЖАЩЕГО ФЛАВОНОИДЫ
Заготовку надземных частей проводят в фазу бутонизации или начала цветения, подземных – в конце вегетации.
Корзинки василька синего собирают в период полного цветения, выщипывая краевые и срединные трубчатые цветки, цветоложе с оберткой отбрасывают.
Во избежание изменения (потери) синей окраски цветки сушат в защищенном от солнца месте, под навесами или на чердаках с хорошей вентиляцией. После сушки из сырья удаляют цветки, потерявшие естественную окраску.
Цветки (боярышника, пижмы, бессмертника) собирают в начале цветения.
Цветки боярышника собирают, когда часть их еще не раскрылась. Цветки, собранные в конце цветения, темнеют при сушке; в случае сбора бутонов сырье долго не сохнет и буреет. Период цветения составляет 3-4 дня.
Соцветия пижмы заготавливают в начале цветения, когда они еще имеют углубления по центру. Срезают корзинки и части сложных щитковидных соцветий с цветоносом длиной не более 4 см (считая от верхних корзинок).
182
