
Patfiz_modul_1_ustny_FINAL
.pdf
лучи"). КУФ лучи поглощаются прежде всего белками, содержащимися в ядре клетки, ДУФ лучи - белками протоплазмы. Общее гуморальное действие УФ лучей связано с всасыванием и попаданием в кровоток биологически активных веществ, образующихся в коже Общее нервно-рефлекторное действие УФ лучей связано с раздражением обширного рецепторного аппарата кожи. Витаминообразующее действие УФ лучей заключается в стимуляции синтеза витамина Д.
Общее действие инфракрасного облучения проявляется антиспастическим действием, в частности на гладкомышечные органы брюшной полости, что сопровождается снижением болевых ощущений, особенно при хронических воспалительных процессах. Активные продукты распада белков наряду с нервными импульсами, возникающими в коже, распространяют местное действие инфракрасных лучей на весь организм. Эти нервные и гуморальные (жидкостные) влияния при умеренных дозах инфракрасной радиации нормализуют тонус вегетативной нервной системы, снимают чрезмерное напряжение, расслабляют тонус мышц, сосудов, оказывают болеутоляющее, противовоспалительное действие.
Фотосенсибилизация — явление повышения чувствительности организма (чаще кожи и слизистых оболочек) к действию ультрафиолетового или видимого излучений
Фотосенсибилизатор — природное или искусственно синтезированное вещество, способное к фотосенсибилизации биологических тканей, то есть увеличению их чувствительности к воздействию света.
13.Местное и общее действие термических факторов. Гипер и гипотермия: стадии развития, патогенез, клинические проявления, механизмы адаптации, последствия.
ГИПЕРТЕРМИЯ Гипертермия, или перегревание организма, — типовая форма расстройства теплового обмена, возникающая
в результате действия высокой температуры окружающей среды или нарушения процессов теплоотдачи организма. Она характеризуется срывом механизмов теплорегуляции и проявляется повышением температуры тела выше нормы.
Причины гипертермии:
высокая температура окружающей среды;
факторы, препятствующие теплоотдаче, что сопровождается увеличением образования доли так называемой свободной энергии, выделяющейся в виде тепла;
влияние разобщителей процессов окисления и фосфорилирования в митохондриях клеток, что может быть следствием:
o — первичного расстройства механизмов терморегуляции, например при кровоизлиянии в область гипоталамуса, участвующего в регуляции температурного режима организма;
o — нарушения процессов отдачи тепла в окружающую среду, например у тучных людей, при
ношении влагонепроницаемой одежды или высокой влажности воздуха.
Эти факторы могут действовать содружественно и повышать возможность возникновения гипотермии. Важными условиями, способствующими развитию гипертермии, являются:
факторы, снижающие эффективность процессов теплоотдачи — значительная влажность воздуха, воздухо- и влагонепроницаемая одежда;
воздействия, повышающие активность реакций теплопродукции, например интенсивная мышечная работа;
возраст — гипертермия легче развивается у детей истариков, у которых понижена эффективность системы терморегуляции;
некоторые заболевания — гипертоническая болезнь, сердечная недостаточность, гипертиреоз, ожирение, вегетососудистая дистония.
Механизмы развития гипертермии.
Различают две стадии гипертермии — компенсации (адаптации) и декомпенсации (деадаптации) механизмов терморегуляции организма.
Стадия компенсации характеризуется активацией экстренных механизмов адаптации организма к перегреванию. Эти механизмы направлены на увеличение теплоотдачи и снижение теплопродукции. В результате температура тела хотя и повышается, однако остается в пределах верхней границы нормального диапазона.
Стадия декомпенсации характеризуется срывом и неэффективностью как центральных, так и местных механизмов терморегуляции. Это обусловливает нарушение температурного гемостаза организма, что является главным звеном патогенеза стадии.
Интенсивность и степень декомпенсации механизмов теплорегуляции определяются многими факторами.
Ведущее значение среди них имеют два:
скорость и величина повышения температуры окружающей среды — чем они выше, тем быстрее и сильнее нарастают расстройства жизнедеятельности организма;
тренированность организма повторяющимися эпизодами высокой внешней температуры. При повторном воздействии на организм умеренно повышенной температуры резистентность к ней
возрастает. Это обеспечивается формированием состояния адаптации к перегреванию. Такое состояние характеризуется активацией системных и местных механизмов «терморезистентности».
Критической температурой тела, обусловливающей гибель организма, является 42—44 «С. Смерть может наступить и при более низкой температуре. Это определяется тем, что при гипертермии организм подвергается действию не только чрезмерной температуры, но и других факторов, вторично формирующихся в организме: некомпенсированных сдвигов pH, изменений содержания ионов и жидкости; накопления избытка токсичных продуктов обмена веществ; последствий недостаточной функции органов и физиологических систем — сердечно-сосудистой, внешнего дыхания, крови, почек, печени и др.
ГИПОТЕРМИЧЕСКИЕ СОСТОЯНИЯ
Кгипотермическим состояниям относят:
гипотермию;
управляемую (искусственную) гипотермию, или медицинскую гибернацию.
ГИПОТЕРМИЯ
Гипотермия — типовая форма расстройства теплового обмена организма, возникающая в результате действия на него низкой температуры внешней среды или значительного снижения теплопродукции в нем и характеризующаяся нарушением механизмов теплорегуляции. что проявляется снижением температуры тела ниже нормы.
Причины гипотермии:
низкая температура внешней среды;
параличи мышц или уменьшение их массы, например при атрофии в результате кровоизлияния в мозг;
крайняя степень истощения организма.
Условия, способствующие возникновению гипотермии:
повышенная влажность воздуха;
увеличение скорости движения воздуха (ветер);
влажная или мокрая одежда;
попадание в холодную воду, что сопровождается быстрым охлаждением организма, поскольку вода примерно в 4 раза более теплоемка и в среднем в 25 раз более теплопроводна, чем воздух. В связи с
этим замерзание в воде может наблюдаться при сравнительно высокой температуре. Индивидуальная резистентность организма к охлаждению значительно снижается под действием длительного голодания, физического переутомления, алкогольного опьянения, а также при различных заболеваниях, травмах и экстремальных состояниях.
Механизмы гипотермии.
Развитие гипотермии — процесс стадийный. В основе ее формирования лежат более или менее длительное перенапряжение и срыв механизмов терморегуляции организма. В связи с этим выделяют две стадии гипотермии.
1.Стадия компенсации характеризуется активацией экстренных адаптивных механизмов, направленных на уменьшение теплоотдачи и увеличение теплопродукции. К числу этих механизмов относятся:
изменение поведения, направленное на «уход» от воздействия холода;
снижение эффективности процессов теплоотдачи;
активация процессов теплопродукции;
«включение» стрессорной реакции.
Благодаря комплексу указанных изменений температура тела хотя и понижается, но еще не выходит за рамки нижней границы нормы. Температурный гомеостаз организма сохраняется.
2.Стадия декомпенсации процессов терморегуляции организма является результатом срыва
центральных механизмов регуляции теплового обмена. На этой стадии температура тела падает ниже нормального уровня и продолжает снижаться. Температурный гомеостаз организма нарушается.
При нарастании действия охлаждающего фактора наступает замерзание и смерть организма. Непосредственными причинами смерти при глубокой гипотермии являются прекращение сердечной деятельности и остановка дыхания.
Медицинская гипотермия
Управляемая, или медицинская, гипотермия — метод управляемого снижения температуры тела или его части с целью уменьшения интенсивности обмена веществ, уровня функций тканей, органов, физиологических систем и повышения их устойчивости к гипоксии.
Управляемая гипотермия используется в медицине в двух разновидностях: общей и местной. Общая управляемая гипотермия применяется при выполнении операций в условиях значительного снижения или даже временного прекращения кровообращения. Этот метод применяется при операциях на так называемых сухих органах: сердце, головном мозге, легких, крупных сосудах, при использовании искусственного кровообращения.
Локальная управляемая гипотермия отдельных органов или тканей (головного мозга, печени и др.) используется при необходимости проведения оперативных вмешательств или других манипуляций на этих органах для коррекции кровотока, пластических процессов и других целей.
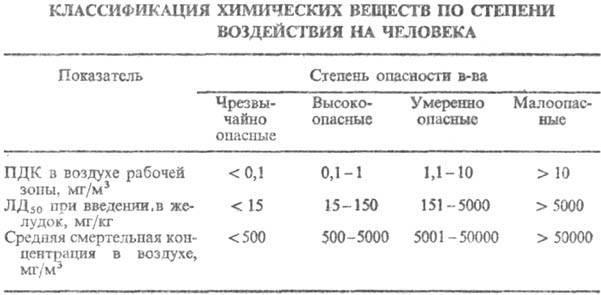
14.Интоксикация: определение понятия, виды, специфические и неспецифические механизмы. Показатели токсичности химических веществ. Патогенетические механизмы дезинтоксикации.
Токсико́з, интоксикация (греч. τοξικόρ — ядовитый) — болезненное состояние, обусловленное действием на организм экзогенных токсинов (напр., микробных) или вредных веществ эндогенного происхождения (напр., при токсикозе беременных, тиреотоксикозе).
В отличие от слова отравление, слово интоксикация в русском языке имеет более узкий, профессиональный смысл, и описывает собственно явление, но не внешнее воздействие (сравните:
«отравление Распутина»). Различают два периода в течение токсикоза.
Первый период — период генерализованной реакции. Он имеет различные варианты течения: токсикоз с энцефалическим синдромом, токсическую энцефалопатию нейротоксикоз, кишечный токсикоз, токсикоз с обезвоживанием (токсикоз с интенстинальным синдромом), токсикоз Кишша (гипермотильный токсикоз), молниеносную форму токсикоза, синдром Уотерхауса-Фридериксена (токсикоз с острой надпочечниковой недостаточностью).
Второй период — период локализации патологического процесса может быть охарактеризован следующими вариантами — синдромом Рея (токсикозом с печеночной недостаточностью), синдромом Гассера, Гемолитико-Уремическим синдромом (токсикозом с острой почечной недостаточностью) и токсикосептическим состоянием.
Удетей факторами риска возникновения токсикоза являются родовые травмы или наличие врожденных и наследственных заболеваний ЦНС, нарушения обмена веществ, предшествующие вакцинации, перенесенные инфекции и т. д.
Во время генерализованной реакции в картине токсикоза доминируют неврологические расстройства, состояние «неестественного» сна чередуется с периодами возбуждения. С развитием коматозного состояния может возникать полная утрата сознания.
В сердечно-сосудистой системе будут преобладать нарушения периферического кровотока, «мраморность» кожи, тахикардия, громкие, хлопающие тоны сердца, снижение АД, диурез. Дисфункции желудочно-кишечного тракта при токсикозах проявляются рвотой, поносом, парезом кишечника, анорексией.
Поражение печени и почек при токсикозе характерно и постоянно. Непременными компонентами клинической картины токсикоза являются патология водно-электролитного обмена отклонения в кислотно-основном состоянии. Геморрагический синдром выражен в различной степени: от единичных петехий на коже и слизистых оболочках до профузного кровотечения свидетельствующего о диссеминированном внутрисосудистом свертывании.
По характеру воздействия токсичного вещества на организм выделяют такие виды интоксикации:
Интоксикация острая (acute intoxication) - патологическое состояние организма, являющееся результатом однократного или кратковременного воздействия; сопровождается выраженными клиническими признаками
Интоксикация подострая (subacute intoxication) - патологическое состояние организма, являющееся результатом нескольких повторных воздействий; клинические признаки менее выражены по сравнению с интоксикацией острой
Интоксикация сверхострая (over-acute intoxication) - острая интоксикация, характеризующаяся поражением центральной нервной системы, признаками которого являются конвульсии, нарушение координации; летальный исход наступает в течение нескольких часов
Интоксикация хроническая (chronic intoxication) - патологическое состояние организма, являющееся результатом длительного (хронического) воздействия; не всегда сопровождается выраженными клиническими признаками.
Эффективная дезинтоксикация организма осуществляется путем уменьшения концентрации токсических веществ в жидкостных секторах организма, усиления процессов связывания, нейтрализации и транспорта к органам физиологической дезинтоксикации, интенсификации процессов их выведения.
При этом лечебные мероприятия обязательно должны быть направлены не только на токсические вещества, непосредственно циркулирующие в крови, но также и на те из них, которые находятся во внутриклеточном и межклеточном пространствах.
Учитывая целесообразность комплексного воздействия на патогенетические механизмы синдрома эндогенной интоксикации, в настоящее время наибольшего эффекта можно ожидать от применения средств и методов трансфузионной дезинтоксикационной терапии. Различные сочетания препаратов донорской крови, плазмозамещающих и солевых растворов позволяют оказывать комплексное влияние на патологический процесс.
С их помощью можно добиться реального эффекта уменьшения концентрации токсических веществ во всех жидкостных секторах организма, интенсифицировать движение жидкости с растворенными в ней токсическими веществами по направлению от клетки к сосудистому руслу, стимулировать диурез, превращать токсические вещества в неактивные комплексные соединения, улучшить функциональное состояние печени и почек, усилить процессы микроциркуляции, уменьшить степень метаболических нарушений в тканях, ликвидировать возникшие нарушения гемодинамического и биохимического гомеостаза.
Такие методы трансфузионной терапии, как искусственная гемодилюция и форсированный диурез, оказывают широкий спектр благоприятных воздействий на организм, позволяют успешно и рационально решать задачи дезинтоксикационной терапии. Разработанный нами вариант метода форсированного диуреза, основанный на последовательном и чередующемся применении трансфузионных средств с повышенными и пониженными коллоидно-осмотическими свойствами в сочетании с сильными диуретическими препаратами, позволяет интенсифицировать обмен воды между всеми жидкостными секторами организма, усилить элиминацию токсических веществ в циркулирующую кровь с последующим их быстрым выведением из организма вместе с мочой.
15.Экзогенная и эндогенная интоксикации (примеры). Механизмы развития клинических признаков интоксикации. Пути попадания в организм токсинов и механизмы дезинтоксикации.
Эндогенная интоксикация (ЭнИ) – это полиэтиологичный и полипатогенетичный синдром, характеризующийся накоплением в тканях и биологических жидкостях эндогенных токсических субстанций (ЭТС) – избытка продуктов нормального или извращенного обмена веществ или клеточного реагирования. Она представляет собой сложное многокомпонентное явление, включающее:
-источник токсемии, обеспечивающий образование ЭТС;
-биологические барьеры, предупреждающие прорыв эндогенных токсинов за пределы источника;
-механизмы переноса этих токсических продуктов к клеткаммишеням, к органам биотрансформации и/или экскреции;
-механизмы иммобилизации и депонирования, биотрансформации (нейтрализации) и экскреции токсических продуктов;
-эффекторные ответы на интоксикацию в виде так называемой
вторичной токсической агрессии, в результате которой ЭнИ в значительной мере теряет свою специфичность.
Хотя эндогенная интоксикация полиэтиологична, можно выделить следующие первичные механизмы ее развития:
-продукционный или обменный, обусловленный избыточной продукцией эндогенных токсических субстанций (разлитой перитонит, острый панкреатит, пневмония);
-резорбционный, когда происходит резорбция токсических веществ из ограниченного очага инфекции, распадающихся тканей (кишечная непроходимость, флегмоны мягких тканей, абсцессы и т. д.);
-реперфузионный, при котором в системный кровоток поступают вещества, накопившиеся в длительно ишемизированных тканях, а также выделившиеся из клеток этих тканей при их повреждении активным кислородом и избытком свободных радикалов на фоне несостоятельности антиоксидантной защиты
(шок, реперфузионный синдром, операции с применением аппарата искусственного кровообращения и т.д.);
-ретенционный, при котором накопление ЭТС происходит в результате нарушения их выделения естественными органами детоксикации (острая почечная (ОПН) и печеночная (ОПечН) недостаточность);
-инфекционный, в результате поступления микроорганизмов, продуктов их обмена и распада из очага инвазивной инфекции или путем транслокации из извращенно контаминированного желудочнокишечного тракта. В развитии острого эндотоксикоза одновременно или последовательно могут участвовать несколько механизмов образования ЭТС и накопления их во внутренней среде организма. Классификация экзогенных И основана на природе вызывающих их ядов (отравление дихлорэтаном, мышьяком и т. д.) или содержащих их продуктов (пищевые отравления). Эндогенные И классифицируются в зависимости от заболевания, послужившего источником их возникновения (травматическая, радиационная, инфекционная, гормональная И), или физиологической системы,
расстройство которой привело к накоплению в организме токсических продуктов (кишечная, почечная И).
И обычно наступает в результате действия циркулирующих в крови токсических веществ; циркуляция
вкрови эндогенных ядов чаще обозначается как токсемия, а циркуляция токсинов – как токсинемия. Часто используют термины, указывающие вещество, находящееся в крови в избытке (хотя и свойственное организму) - напр., азотемия. Термином «токсикоз» иногда пользуются для названия заболеваний, вызванных экзогенными ядами, например, алиментарный токсикоз, протеотоксикоз (в случае отравления экзогенными белками). Токсикозами иногда называют синдромы, развивающиеся вследствие избыточного поступления в кровь гормона, например, щитовидной железы – тиреотоксикоз, а также при осложнениях беременности, связанных с явлениями аутоинтоксикации – токсикозы беременных и др.По клиническому течению И делят на острые и хронические. Тяжесть И определяется величиной токсической дозы и реактивностью организма. Соответственно выделяют И легкой, средней и тяжелой степени.
Клинические проявления эндогенных и экзогенных И имеют свои особенности. Течение эндогенной И
взначительной степени определяется характером основного заболевания. Так, например, для диффузного токсического зоба характерны стойкая тахикардия, похудание, экзофтальм – симптомы токсического действия избыточного количества тиреоидных гормонов (тиреотоксикоз). При хронической уремии отмечаются явления воспаления в местах выделения азотистых шлаков; в гортани, глотке, желудочно-кишечном тракте, на коже обнаруживаются скопления кристаллов мочевины («уремическая пудра»). При хронической эндогенной И больные отмечают недомогание, раздражительность, разбитость, головную боль, головокружение, тошноту; наступает истощение, снижается резистентность организма. В ряде случаев эндогенная И может протекать в форме тяжелого острого отравления (рвота, ступор, коматозное состояние). Такое течение характерно для острой почечной недостаточности, гепатаргии, токсемического шока, острой ожоговой токсемии.
Течение экзогенной И определяется, в основном, токсикодинамикой яда, его дозой, способом попадания в организм, функциональным состоянием организма. Избирательность действия различных ядов обусловливает возникновение тех или иных синдромов: бронхоспазм, токсический отек легких, судороги. Тяжелая экзогенная И может протекать с нарушением дыхания и гемодинамики, преобладанием почечной и печеночной недостаточности, может наблюдаться коматозное состояние; при отравлении некоторыми ядами возможны интоксикационные психозы.
При длительном действии ядов в малых концентрациях (часто ниже минимально токсических доз) вначале возникают неспецифические симптомы в виде разнообразных нарушений функций преимущественно нервной и эндокринной систем, позднее присоединяются симптом специфических системных поражений (напр., марганцовый паркинсонизм, остеопороз при хроническом отравлении соединениями фтора и др.). Хроническая И некоторыми нейротропными ядами избирательного действия может с самого начала сопровождаться специфическими симптомами (миоз при отравлении мускарином, эзерином и подобными им веществами, сухость во рту и мидриаз при отравлении атропином). Иногда в процессе хронической И могут возникнуть бурно протекающие симптомы (например, свинцовая колика).
16.Патофизиологические аспекты табакокурения, алкоголизма, наркомании. Патогенетические механизмы привыкания, нарушений в организме и последствия
Этиология наркоманий и токсикоманий Причины
• Средства, вызывающие наркоманию:
♦Опиаты (героин, морфин, препараты опийного мака).
♦Стимуляторы ЦНС (кокаин, марихуана и другие препараты индийской конопли).
♦Галлюциногены (диэтиламид лизергиновой кислоты, мескалин и др.).
• Токсикоманические средства, применяемые с немедицинской целью.
♦Некоторые химические реактивы (например, летучие органические растворители).
♦Бытовые химические вещества (например, инсектициды, клеи, репелленты).
♦Этанол.
♦ЛС, не относящиеся к наркотикам (например, транквилизаторы).
Общий патогенез нарко- и токсикоманий
Наркотики и токсикоманические вещества имеют различия в структуре и механизме действия. Вместе с тем
формирование психической и физической зависимости, реализация их эффектов в организме имеет ряд общих патогенетических закономерностей.
Патологическое влечение к повторному употреблению психоактивного вещества
•Приѐм наркотика или токсикоманического вещества вызывает индивидуальные, более или менее выраженные, положительные эмоции. Это побуждает к повторному использованию данного вещества (феномен «подкрепления»).
•Каждый эпизод искусственно вызванного состояния комфорта способствует формированию патологической системы. Функция этой системы имеет целью приѐм очередной (подкрепляющей) порции вещества для достижения психологического и физического комфорта.
•К основным компонентам патологической системы подкрепления относятся структуры ствола мозга (в их числе locus ceruleus - голубоватое место, располагающееся на дне четвѐртого желудочка), лимбическая система. Медиаторами патологической системы подкрепления являются дофамин, норадреналин, серотонин, эндогенные опиоиды.
Формирование психической и физической зависимости
•Психическая зависимость - состояние, характеризующееся развитием дискомфорта (например, депрессии, тревоги, глубокой тоски) при прекращении поступления в организм психоактивного вещества, которое обеспечивает чувства удовлетворения, психического и физического подъѐма.
•Физическая зависимость - состояние, характеризующееся выраженными острыми нарушениями физического состояния, глубокими расстройствами деятельности ЦНС, органов, тканей и их систем при прекращении поступления в организм психоактивного вещества.
•Синдром абстиненции - состояние, развивающееся при прекращении введения в организм психоактивного вещества на фоне физической зависимости от него. Острый период абстиненции длится до 4-5 нед. Характеризуется комплексом признаков психических, вегетативных и физических расстройств.
Изменение психического состояния: беспокойство, неудовлетворѐнность, тоска, дискомфорт, злобность. Вегетативные и физические расстройства: мышечные боли, судороги мышц ног, мышечная слабость, тошнота, рвота, понос, боли в желудке и кишечнике, колебания АД, потливость, тахикардия, бессонница
17.Основные виды и причины повреждения клетки. Признаки повреждения клетки. Основные этапы и механизмы повреждения и гибели клетки. Некробиоз, некроз, апоптоз. механизмы их развития.
Некроз, апоптоз
Кморфологическим признакам повреждения клеток относят: • набухание (увеличение) и вакуолизацию клетки (еѐ ядра, цитоплазмы органелл (особенно митохондрий); • изменение мембраны клетки, ядра и органелл (лизосом, пероксисом, митохондрий, шероховатого и/или гладкого эндоплазматического ретикулума, рибосом, полисом, комплекса Гольджи и др.); • деструктивные изменения ядра (его размеров, формы, структуры); • уменьшение числа функционирующих органелл (рибосом, митохондрий, эндоплазматического ретикулума и др.); • снижение количества рецепторов клеточных и внутриклеточных мембран; • нарушение межклеточных контактов; • расстройства контактов клеток с межклеточными структурами; • повреждение генетических структур клетки (генов, хромосом, генома).
Кфункциональным признакам повреждения клеток относят: • изменение физико-химических и биоэлектрических свойств мембран (например, увеличение электропроводности ткани, снижение электрического сопротивления клеточных мембран); • повышение проницаемости мембран клеток и органелл для микро- и макромолекул (ионов, моно-, ди- и полимеров белков, липидов, углеводов); • появление и увеличение в крови цитоплазматических ферментов (нуклеаз, липаз, кислой фосфатазы, аспартат и аланинаминотрансфераз, лактатдегидрогена-зы, креатинкиназы и др.) в результате повреждения клеток, особенно их мембран; • изменение тинкториальных свойств к леток (усиление способности клеток к окрашиванию витальными красителями в результате повышения как сорбционных свойств повреждѐнной клетки, так и проницаемости их мембран); • уменьшение подвижности клеток; • снижение активности клеточных и внутриклеточных рецепторов; • нарушение процесса деления (извращение функции ядра, митохондрий и других внутриклеточных и внеклеточных структур); • нарушение биохимических процессов в клетках и межклеточных структурах (главным образом, снижение потребления кислорода, содержания кальция в митохондриях и процесса окислительного фосфорилирования, что приводит к расстройствам как энергетического, так и пластического обменов); • появление новых функций клеток и др.
МЕХАНИЗМЫ ПОВРЕЖДЕНИЯ КЛЕТОК Молекулярные механизмы повреждения клеток, приводящие к их
смерти, очень сложны. Существуют четыре наиболее чувствительные внутриклеточные системы:
-поддержание целости клеточных мембр'ан, от которой зависит ионный и осмотический гомеостаз клетки и ее органелл;
-аэробное дыхание, связанное с окислительным фосфорили-рованием и образованием аденозинтрифосфата (АТФ);
-синтез ферментов и структурных белков;
-сохранение единства генетического аппарата клетки. Структурные и биохимические элементы клетки тесно взаимосвязаны. Например, нарушение аэробного дыхания повреждает натриевый насос мембраны, который поддерживает ионно-жидкостный баланс клетки, что приводит
к нарушению внутриклеточного содержания ионов и воды.
18.Информационные аспекты повреждения клетки: нарушения сигнализации, рецепции сигналов, пострецепторных механизмов связи, клеточных программ.
НАРУШЕНИЯ РЕЦЕПТОРНОГО АППАРАТА: снижение (повышение) числа рецепторов, изменение их аффинитета, появление новых, нарушение обновления, нарушение передачи сигнала с рецепторов в клетку.
ПОВРЕЖДЕНИЕ ПЛАЗМАТИЧЕСКОЙ МЕМБРАНЫ: типичные повреждения: перекисное окисление, фосфолипазой
активируемый гидролиз мембран, механоосмотическое растяжение и адсорбция на мембране полиэлектролитов.
Это ведет к: изменению функции рецепторов, ионных каналов, пиноцитоза, к выходу внутриклеточных метаболитов (синдром цитолиза
– АДФ, ионы, ферменты, субстраты клеток); изменяет мембранный потенциал (ведет к набуханию клеток из-за нарушения транспортных систем ионов) к баллонной дистрофии и сглаживанию градиентов ионов; вход ионов Na+ и Са2+ активирует мембранную фосфилипазу А и изменяет синтез и баланс лейкотриенов – простагландинов.
19. Механизмы гипоксического повреждения клеток.
При резко выраженной гипоксии адаптационные механизмы могут оказаться недостаточными, происходит декомпенсация, характеризующаяся выраженными биохимическими, функциональными и структурными расстройствами. Чувствительность различных тканей и органов к повреждающему действию гипоксии сильно варьирует. В условиях полного прекращения доставки кислорода сухожилия, хрящи и кости сохраняют свою жизнедеятельность в течение многих часов; поперечно – полосатые мышцы - около 2-х часов; миокард, почки и печень - 20-40 мин; тогда как в коре головного мозга и в мозжечке в этих условиях, уже через 2,5-3 мин появляются очаги некроза, а через 6-8 мин происходит гибель всех клеток коры головного мозга. Несколько большей устойчивостью обладают нейроны продолговатого мозга - их деятельность макет восстановиться спустя 30 мин после прекращения доставки кислорода.
В основе всех нарушений обмена веществ при гипоксии лежит понижение образования или полное прекращение образования макроэргических фосфорных соединений, которое ограничивает способность клеток выполнять нормальные функций и поддерживать состояние внутриклеточного гомеостаза. При недостаточном поступлении в клетки кислорода усиливается процесс анаэробного гликолиза, не он может лишь в незначительной степени компенсировать ослабление окислительных процессов. В особенности это касается клеток ЦНС, потребность которых в синтезе макроэргических соединений наиболее высока. Под действием гипоксии повышается проницаемость капилляров мозга, что ведет к его отеку. Миокард также характеризуется слабой способностью к энергообеспечению за счет анаэробных процессов. Гликолиз может обеспечить потребность миокардиоцитов в энергии лишь в течение нескольких минут. Запасы гликогена в миокарде быстро истощаются. Содержание тиколитических ферментов в миокардиоцитах незначительно. Уже через 3-4 мин после прекращения, доставки к миокарду кислорода сердце теряет способность создавать артериальное давление, необходимое для поддержания кровотока в мозге, вследствие чего в нем возникают необратимые изменения.
Гликолиз не только является неадекватным способом освобождения энергии, но и оказывает отрицательное действие на другие метаболические процессы в клетке, т.к. в результате накопления молочной и пировиноградной кислот развивается метаболический ацидоз, который уменьшает активность тканевых ферментов; значительно снижается активность моноаминооксидазы. При резко выраженном дефиците макроэргов расстраивается функция энергозависимых мембранных насосов. Вследствие этого нарушается регуляция перемещения ионов через клеточную мембрану. Происходит повышенный выход из клеток калия и избыточное, поступление внутрь них натрия. Это ведет к понижению мембранного потенциала и изменению нервномышечной возбудимости, которая первоначально повышается, а затем ослабляется и утрачивается. Вслед за ионами натрия в клетки устремляется вода, это вызывает их набухание. Кроме натрия, в клетках создается избыток кальция в связи с нарушением функции энергозависимого кальциевого насоса. Повышенное поступление кальция в нейроны обусловлено открытием дополнительных кальциевых каналов, под действием глутамата, образование которого при гипоксии возрастает. Ионы кальция активируют фосфолипазу А2, которая разрушает липидные комплексы клеточных мембран, что еще в большей степени нарушает работу мембранных насосов и функцию митохондрий.
Развивающийся при острой гипоксии стресс-синдром, наряду с ранее упомянутым положительным эффектом глюкокортикоидов, оказывает выраженное катаболическое действие на белковый обмен, вызывает отрицательный азотистый баланд, повышает расходование жировых запасов организма.
Повреждающее действие на клетки оказывают продукты перекидного окисления липидов, которое в условиях гипоксии усиливается. Образующиеся при этом процессе активные формы кислорода и другие свободные радикалы повреждают наружную и внутреннюю клеточные мембраны, в том числе мембрану лизосом. Этому способствует и развитие ацидоза. В результате этих воздействий лизосомы освобождают находящиеся в них гидролитические ферменты, оказывающие повреждающее действие на клетки вплоть до развития аутолиза.
Развитие и проявления энергодефицита в клетке. РАССТРОЙСТВА ОБМЕНА ВЕЩЕСТВ
•Содержание АТФ и креатинфосфата при гипоксии любого типа прогрессирующе снижается вследствие подавления процессов биологического окисления (особенно — аэробных) и сопряжения их с фосфорилированием.
Содержание АДФ, АМФ и креатина нарастает вследствие нарушения их фосфорилирования.
•Концентрация неорганического фосфата в тканях увеличивается. Причины:
Повышенный гидролиз АТФ, АДФ, АМФ и креатинфосфата.
Подавление реакций окислительного фосфорилирования.
Процессы тканевого дыхания в клетках подавлены вследствие дефицита кислорода, недостатка субстратов обмена веществ, подавление активности ферментов тканевого дыхания.
Гликолиз на начальном этапе гипоксии активируется.
Причины:
Дефицит АТФ и снижение его ингибирующего влияния на ключевые ферменты гликолиза.
Активация гликолитических ферментов продуктами гидролиза АТФ: АДФ и АМФ.
Проявления:
Снижение содержания гликогена и глюкозы в клетках.
Увеличение внутриклеточного содержания молочной и пировиноградной кислот.
Последнее является также результатом торможения их окисления в дыхательной цепи и ресинтеза из них гликогена, требующего энергии АТФ.
Содержание Н+ в клетках и биологических жидкостях прогрессирующе нарастает и развивается ацидоз вследствие торможения окисления субстратов, особенно — лактата и пирувата, КТ и в меньшей мере
— жирных кислот и аминокислот.
Биосинтез нуклеиновых кислот и белков подавлен вследствие дефицита энергии, необходимой ддя этих процессов.
Параллельно активируется протеолиз, обусловленный активацией в условиях ацидоза протеаз, а также неферментного гидролиза белков.
Азотистый баланс становится отрицательным. Это сочетается с повышением уровня остаточного азота в плазме крови и аммиака в тканях. Причины: активация реакций протеолиза и торможение процессов протеосинтеза.
Жировой обмен характеризуется:
Активацией липолиза вследствие повышения активности липаз и ацидоза.
Торможением ресинтеза липидов. Причина: дефицит макроэргических соединений.
Накоплением в результате вышеуказанных процессов избытка КТ (ацетоуксусной, р-оксимасляной кислот, ацетона) и жирных кислот в плазме крови, межклеточной жидкости, клетках. При этом ВЖК оказывают разобщающее влияние на процессы окисления и фосфорилирования, что усугубляет дефицит АТФ.
Обмен электролитов и жидкости в тканях существенно нарушен. Причины:
Дефицит АТФ, энергия которой необходима для АТФаз: №+,К+-АТФазы, Са2+-зависимой АТФазы и др.
Повреждение мембран и их ионных каналов, обеспечивающих энерго- и электрозависимый перенос, а также пассивный транспорт ионов.
Изменение содержания в организме гормонов, регулирующих обмен ионов: минералокортикоидов,
кальцитонина и др. Проявления:
Нарушение соотношения ионов в клетках:
Трансмембранного (обычно в условиях гипоксии клетки теряют К+, в цитозоле накапливаются Na+ и Са2+, в митохондриях — Са2+).
Между отдельными ионами (например, в цитозоле уменьшается соотношение K+/Na+, К+/Са2+).
Увеличение в крови содержания Na+, Cl-, отдельных микроэлементов. Изменения содержания разных ионов различно. Оно зависит от степени гипоксии, преимущественного повреждения того или иного органа, изменений гормонального статуса и других факторов.
Накопление избытка жидкости в клетках (набухание клеток). Причины:
Увеличение осмотического давления в цитоплазме клеток в связи с накоплением в них Na+, Са2+ и некоторых других ионов, а также в результате гидролиза крупных молекул органических веществ (например, гликогена, белка).
Повышение онкотического давления в клетках в результате распада полипептидов, ЛП и других белоксодержащих молекул, обладающих гидрофильными свойствами.
•В тканях и органах могут развиваться и другие нарушения метаболизма. Во многом они зависят от причины, типа, степени и длительности гипоксии, преимущественно поражѐнных при гипоксии органов и тканей и ряда других факторов.
Немедленные и долговременные механизмы приспособления и адаптации к гипоксии
Действие на организм фактора, вызывающего гипоксию любого типа, сопровождается включением
взаимосвязанных процессов двух категорий: обусловливающих.развитие гипоксии и обеспечивающих адаптацию организма к гипоксии и направленных на поддержание гомеостаза в данных условиях.
Общая характеристика процессов адаптации к гипоксии. При развитии даже умеренной гипоксии сразу формируется поведенческая реакция, направленная на поиск среды существования, оптимально обеспечивающей уровень биологического окисления.Возникшая гипоксия служит системообразующим фактором: в организме формируется динамическая функциональная система по достижению и поддержанию оптимального уровня биологического окисления в клетках.
Система реализует свои эффекты за счет активации доставки кислорода и субстратов метаболизма к тканям и включения их в реакции биологического окисления. В структуру системы входят легкие, сердце, сосудистая система, кровь, системы биологического окисления и регуляторные системы.
Условно адаптивные реакции подразделены на две группы: экстренной адаптации и долговременной адаптации. Острые реакции, возникающие при остро развивающейся гипоксии, выражаются в первую очередь в изменении функции органов дыхания и кровообращения. Происходит увеличение минутного объема сердца за счет как тахикардии, так и возрастания систолического объема, повышаются артериальное давление, скорость кровотока и возврат венозной крови к сердцу, что способствует ускорению доставки кислорода к тканям. В случае тяжелой гипоксии происходит централизация кровообращения - значительная часть крови устремляется к жизненно важным органам. Расширяются сосуды мозга. Гипоксия является мощным сосудорасширяющим фактором для коронарных сосудов. Объем коронарного кровотока значительно возрастает при снижении в крови содержания кислорода до 8-9%. Вместе с тем суживаются сосуды мышц и органов брюшной полости. Кровоток через ткани регулируется наличием в них кислорода, и чем ниже его концентрация, тем больше крови притекает к этим тканям. Сосудорасширяющим действием обладают продукты распада АТФ (АДФ, АМФ, неорганический фосфат) а также СОг, Н* - ионы, молочная кислота. При гипоксии их количество возрастает. В условиях ацидоза понижается возбудимость (3-адренорецепторов по отношению к катехоламинам, что также способствует расширению сосудов.
Срочные приспособительные реакции со стороны органов дыхания проявляются его учащением и углублением, что способствует улучшению вентиляции альвеол. Происходит включение в акт-дыхания резервных альвеол. Увеличивается кровоснабжение легких. Гипервентиляция альвеол обусловливает развитие гипокапнии, которая повышает сродство гемоглобина к кислороду и ускоряет оксигенацию притекающей к легким крови. В течение двух суток от начала развития острой гипоксии в эритроцитах возрастает содержание 2,3- дифосфоглицерата (ДФГ) и АТФ, что способствует ускорению отдачи кислорода тканям.
К числу реакций на. острую гипоксию относится увеличение массы циркулирующей крови за счет опорожнения кровяных депо и ускоренного вымывания эритроцитов из костного мозга; благодаря этому повышается кислородная емкость крови..
Приспособительные реакции на уровне испытывающих кислородное голодание тканей выражаются в повышении сопряженности процессов, окисления и фосфорилирования и. в активации гликолиза, за счет которого могут удовлетворяться в течение некоторого времени энергетические потребности клеток. При усилении гликолиза в тканях-накапливается молочная кислота, развивается ацидоз, который ускоряет диссоциацию оксигемоглобина в капиллярах. В условиях острой гипоксии снижается функция, а значит, и потребность в кислороде многих органов и тканей, не принимающих непосредственного участия в обеспечении организма кислородом.
Долговременные компенсаторно-приспособительные реакции возникают при хронической гипоксии на почве различных заболеваний, при длительном пребывании в гордо, при специальных тренировках в барокамерах. В этих условиях наблюдается увеличение количества эритроцитов и гемоглобина вследствие активации эритропоэза под действием эритропоэтина, усиленно выделяемого почками при их гипоксии. В результате увеличиваются кислородная емкость крови и ее объем. В эритроцитах повышается содержание .2,3- ДФГ, понижающего сродство гемоглобина к кислороду* что ускоряет его отдачу тканям. Увеличивается дыхательная поверхность и жизненная емкость легких вследствие образования новых альвеол. У людей, находящихся в состоянии хронической гипоксии, увеличивается васкуляризация периферических тканей. Одним из признаков этого является увеличение размеров концевых фаланг с утратой нормального угла ногтевого ложа («барабанные палочки»).
Изменения функции органов дыхания и кровообращения, возникающие при острой гипоксии, являются в основном рефлекторными. Они обусловлены раздражением дыхательного центра и хеморецепторов дуги аорты и коронарной зоны низким напряжением кислорода в артериальной крови. Эти рецепторы чувствительны также
к
изменениям содержания СО2 и Н+- ионов, но в меньшей степени, чем дыхательный центр. Тахикардия может быть результатом прямого действия гипоксии на проводящую систему сердца.
Сосудорасширяющим действием обладают продукты распада АТФ и ряд других ранее упомянутых тканевых факторов, количество которых при гипоксии возрастает.
Гипоксия является сильным стрессовым фактором, под действием которого происходит активация гипоталамо- гипофизарно-адреналовой системы, увеличивается выделение в кровь глюкокортикоидов, которые активируют ферменты дыхательной цели и повышают стабильность клеточных мембран, в том числе мембраны лизосом.
Это снижает опасность выделения из последних в цитоплазму гидролитических'ферментов, способных вызвать аутолиз клеток.
При хронической гипоксии происходят не только функциональные Сдвиги, но и структурные изменения, имеющие большое компенсаторно-приспосббйтельное значение. Установлено, что дефицит макроэргических фосфорных соединений, обусловленный гипоксией, вызывает активацию синтеза нуклеиновых кислот и белков. Итогом этих биохимических сдвигов является усиление в тканях пластических процессов, лежащих в основе гипертрофии миокардиоцитов и дыхатѐйьной мускулатуры, новообразования альвеол и новых сосудов. В результате повышает работоспособность аппарата внешнего дыхания и кровообращения. Вместе с тем
функционирование этих органов становится более экономичным вследствие повышения мощности системы энергообеспечения в клетках (увеличение числа митохондрий, повышение активности дыхательных ферментов).
Установлено, что при длительной адаптации к гипоксии уменьшается продукция тиреотропного и тиреоидного гормонов; это сопровождается снижением основного обмена и уменьшением потребления кислорода различными Органами, в частности сердцем, при неизменной внешней работе. Активация синтеза нуклеиновых кислот и белков при адаптации к хронической гипоксии обнаружена и в головном мозге и способствует улучшению его функции.
Состояние устойчивой адаптации к гипоксии характеризуется уменьшением гипервентиляции легких, нормализацией функции сердца, снижением степени гипоксии, устранением стресс-синдрома. Происходит активация стресс-лимитирующих систем организма, в частности многократное повышение содержания опиоидных пептидов в надпочечниках, а также в мозге животных, подвергнутых острой и подострой гипоксии. Наряду с антистрессорным действием, опиоидныѐ пептиды понижают интенсивность энергетического обмена и потребность тканей в кислороде. Усиливается активность ферментов, устраняющих повреждающее действие продуктов перекисного окисления липидов (супероксиддисмутазы, каталазы). Установлено, что приадаптаций к гипоксии повышается резистентность организма к действию других повреждающих факторов, различного рода стрессоров. Состояние устойчивой адаптации может сохраняться в течение многих лет.
20. Механизмы свободно-радикального повреждения клетки. Механизмы повреждения клеток
На ранних этапах действия неблагоприятных факторов на клетку включаются механизмы матричного синтеза белков, а именно активируются те или иные факторы транскрипции, вызывающие синтез матричных РНК. В результате этого лроисходит синтез активных белковых факторов - ферментов, вызывающих совершенно определенные изменения в функционировании клеток, а иногда их самоликвидацию (апоптоз).
Кислород - зависимые механизмы
Одной из первых реакций на действие повреждающих факторов является активация кислород-зависимых механизмов - образование активных форм кислорода, которые вызываю пероксидацию молекул, в первую очередь, липидов с активацией мембранных фосфолипаз, детергентным действием лизофосфолипидов и свободных жирных кислот.
Перекисным окислением липидов (ПОЛ) называется свободнорадикальное окисление ненасыщенных жирных кислот, входящих в состав фосфолипидов клеточных мембран. Инициаторами ПОЛ являются свободные радикалы, среди которых наибольшее значение имеют 0*2- супероксидный анион - радикал; ОН*- гидроксильный радикал; Н- - водородный радикал; Ог • * кислород,' у которого один из электронов перешел на более высокий энергетический уровень.
В процессе повреждения клетки возможны два механизма активации ПОЛ.
Первый механизм - избыточное образование первичных свободных радикалов. В этой ситуации имеющиеся в клетке антиоксидантные системы не в состоянии «потушить» реакции ПОЛ. По данному механизму происходит активация ПОЛ в случае повреждающего воздействия на клетку ультрафиолетовых лучей, ионизирующей радиации, гипероксии, некоторых ядов, в частности четыреххлористого углерода, в условиях сильного стресса (образование свободных радикалов из катехоламинов).
Второй механизм активации ПОЛ - нарушение функционирования антиоксидантных систем клетки. В этом случае инициаторами ПОЛ являются первичные свободные радикалы, образующиеся в процессе естественно протекающего обмена веществ. Антиоксидантная недостаточность может быть обусловлена наследственными и приобретенными нарушениями синтеза антиоксидантных ферментов (супероксиддисмутазы, каталазы, глутатионпероксидазы, глутатионредуктазы); дефицитам железа, меди, селена, необходимых для функционирования этих' ферментов; гиповитаминозами Е, С; нарушениями пентозного цикла и цикла Кребса, в реакциях которых образуются НАДФН и НАДН, обеспечивающие восстановление истинных и вспомогательных антиоксидантов. Действие детергентов также может приводить к антиоксидантной недостаточности, вследствие чего нарушается строение липидного бислоя мембраны и открывается доступ свободных радикалов к обычно структурным в гидрофобном слое ненасыщенным жирным кислотам. Независимо от механизмов активации ПОЛ в клетке развиваются тяжелые изменения, связанные с нарушением барьерной и матричной функций клеточных мембран.
Активация мембранных фосфолипаз. В патогенезе повреждения клетки большое значение имеет чрезмерная активация фосфолипазы вг - фермента, осуществляющего гидролитическое отщепление ненасыщенной жирной кислоты - одного из двух гидрофобных хвостов молекулы фосфолипида.
Освободившееся под действием фосфолипазы вг ненасыщенные жирные' кислоты (арахидоновая, пектиновая) расходуются на образование физиологически активных соединений - простагландинов и лейкотриенов. Оставшаяся часть молекулы фосфолипида (лизофосфолипид) имеет лишь один жирнокислотный «хвост», вследствие чего обладает способностью к мицеллообразованию и является очень сильным детергентом.
1 С детергентнЫМ действием лизофосфолипидов связано повреждение клеточных мембран в условиях чрезмерной активации фосфолипазы Аг. Основным фактором, вызывающим такую активацию, является высокая концентрация ионов Са в цитоплазме "клетки.
Свободные жирные кислоты в больших концентрациях, так же как и лизофосфолипиды, оказывают детергентное действие и вызывают нарушение липидного бислоя мембраны. Можно выделить 4 основных механизма повышения содержания , свободных жирных кислот в клетке:
• усиленное поступление свободных жирных кислот в клетку при гиперлипидемии, что ("Наблюдается при активации липолиза жировой ткани, в частности, при стрессе, сахарном диабете;
