
- •Рабочая тетрадь
- •«Химия» для практических работ и самостоятельной работы студента
- •15.02.08 Технология машиностроения
- •1.3. Цели и задачи учебной дисциплины – требования к результатам освоения дисциплины:
- •Основные законы химии:
- •Основные теории химии:
- •Важнейшие вещества и материалы:
- •1. Аудиторная
- •2. Внеаудиторная.
- •Внеаудиторная самостоятельная работа студента:
- •Примерный порядок составления опорного конспекта
- •Практическое занятие № 1: «Химические элементы»
- •Практическое занятие № 2: «Химические формулы. Валентность»
- •Практическое занятие № 3: «Химические реакции»
- •Практическое занятие № 4: «Неорганические кислоты и их применение в машиностроении»
- •Практическое занятие № 5: «Соли и их применение в машиностроении»
- •Практическое занятие № 6: «Применение воды и растворов в машиностроении»
- •Практическое занятие № 7: «Реакции ионного обмена»
- •Молекулярные, полные ионные и сокращённые ионные уравнения реакций
- •Практическое занятие № 8: «Основания и их применение в машиностроении»
- •Практическое занятие № 9: «Оксиды»
- •Практическое занятие № 10: «Химия и специальность 15.02.08 Технология машиностроения»
- •Практическое занятие № 12: «Определение свойств химического элемента по его положению в Периодической системе»
- •Практическое занятие № 14: «Составление уравнений окислительно-восстановительных реакций»
- •Практическое занятие № 15: «Изомерия органических соединений»
- •Практическое занятие № 16: «Природные источники углеводородов. Экскурсия на азс»
- •Авиационные бензины
- •Дизельное топливо
- •Влияние на здоровье человека
- •Нормативные документы:
- •Расчёты:
- •Классификация углеводов
- •Патология углеводного обмена
- •Классификация липидов
- •Биологическое значение жиров для организма
- •Патология обмена жиров (липидов)
- •Особые механические свойства
- •Классификация
- •Оценка письменных работ обучающихся
- •Заключение
Практическое занятие № 7: «Реакции ионного обмена»
Ответьте письменно на вопросы и задания. В конце работы сделайте вывод.
1 При каких условиях ионные реакции протекают до конца?
Приведите в каждом случае пример и составьте уравнения этих реакций в молекулярном, полном и сокращённом ионном виде.
Реакции ионного обмена протекают до конца в следующих случаях:
1)
Образуется осадок.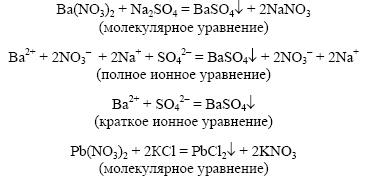
2)
Выделяется
газ.
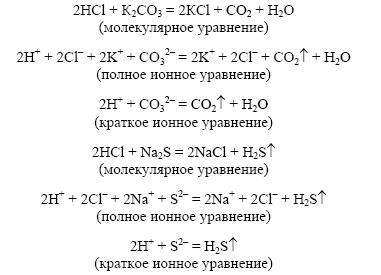
3)
Образуется
малодиссоциированное соединение.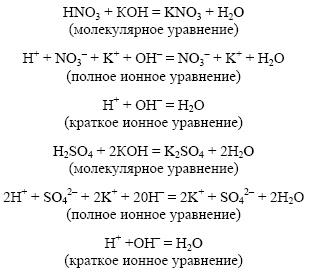
Если в растворе нет таких ионов, которые могут связываться между собой, реакция обмена не протекает до конца, т.е. является обратимой.
Молекулярные, полные ионные и сокращённые ионные уравнения реакций
|
Реагирующие вещества |
УРАВНЕНИЯ РЕАКЦИЙ | ||
|
в молекулярном виде |
полные ионные |
сокращённые ионные | |
|
Хлорид калия и нитрат свинца (II) |
1. В результате реакции образуется осадок: КСl + Рb(NO3)2 →
|
Выше всё это есть! |
|
|
Карбонат калия и соляная кислота |
2. В результате реакции образуется газ: К2СО3 + НСl →
|
|
|
|
Гидроксид натрия и азотная кислота
|
3. В результате реакции образуется малодиссоции-рующее вещество – вода: NaОН + H NO3 →
|
|
|
Напишите уравнения процессов диссоциации ортофосфорной кислоты, гидроксида калия, сульфата алюминия.
Ортофосфорная кислота Н3РО4=3Н+РО4 (степень окисления Н + : РО4 3-) Гидрооксид калия КОН = К+ОН Степень окисления К + ; ОН- Сульфат аллюминия Аl2(SO3)2 = 2Al+ 3SO4 степень окисления Al 3+ SO4 2-
Вывод: я ответил на вопросы, тем самым сделал практическую работу.
4.12.15.
Практическое занятие № 8: «Основания и их применение в машиностроении»
Ответьте письменно на вопросы и задания. В конце работы сделайте вывод.
Какие вещества называют основаниями и как их классифицируют?
Напишите одну- две структурные формулы известных вам оснований.
Основание- это сложные вещества, содержащие гидроксильную группу OH.
Классификация:
По количеству гидроксильной группы: OH.
По наличию кислорода: Н.
По типу соединений (органика или неорганика).
По растворимости в воде.
Напишите химические формулы известных вам оснований и назовите их.
Определите валентность химического элемента в соединениях.
|
Название и химический символ химического элемента |
Валентность химического элемента в соединениях |
Химическая формула |
Название | |
|
Калий |
К |
I |
КОН |
Гидроксид калия |
|
Натрий
|
Na |
1 |
NaOH |
Гидроксид натрия |
|
Железо
|
Fe |
2 |
Fe(OH)2 |
Гидроксид железа 2 |
|
Железо
|
Fe |
3 |
Fe(OH)3 |
Гидроксид железа 3 |
|
Медь
|
Cu |
1 |
CuOH |
Гидроксид меди 1 |
|
Алюминий
|
Al |
3 |
Al(OH)3 |
Гидроксид алюминия |
|
Кальций
|
Ca |
2 |
Ca(OH)2 |
Гидроксид меди |
|
Барий
|
Ba |
2 |
Ba(OH)2 |
Гидроксид бария |
Составьте уравнения реакций:
Гидроксида натрия с соляной кислотой. NaOH+HCl=NaCl=H2O – хлорид натрия+вода
Гидроксида железа (III) с серной кислотой. 2Fe(OH)3+3H2SO4=Fe2(SO4)3+6H2O – сульфат железа 3 + вода.
Напишите уравнения реакция для следующих превращений:
Са → СаО → Са(ОН)2 → СаСl2
Подпишите названия получившихся веществ.
Ca+O2=CaO – кальций+кислород=оксид калиция
CaO+H2O=Ca(OH)2 – оксид кальция+вода=гидроксид кальция
Ca(OH)2+HCl=CaCl2+H2O – гидроксид кальция+соляная кислота=хлорид кальция+вода
Объясните, какое свойство гашёной извести позволяет её использовать в строительстве, в технике как связующий материал. Ответ подтвердите уравнением реакции.
Ca(OH)2+CO2=CaCO3 гашёная известь реагирует с углекислым газом воздуха и получается нерастворимый мел (известняк).
Где ещё применяются основания в машиностроении?
В машиностроении, в строительстве кислород используется для сварки и резки металлов. Горючий газ ацетилен, сгорая в токе кислорода позволяет получить температуру в 300°С.
2C2H2+5O2=4CO2+2H2O+теплота ацетилен.
Главными потребностями кислорода, конечно, является энергетика, металлургия и химическая промышленность.
Электрические и тепловые станции, работающие на угле нефти или природном газе, используют атмосферный кислород для сжигания топлива.
Вывод: я закрепил тему основания и ответил на вопросы.
