
lab_opt / Лаб раб № 75
.pdfМинистерство образования российской федерации
Курский государственный технический университет
Кафедра теоретической и экспериментальной физики
ИССЛЕДОВАНИЕ ЛИНЕЙЧАТЫХ СПЕКТРОВ С ПОМОЩЬЮ СТИЛОСКОПА
Методические указания к выполнению лабораторной работы № 75 по физике твёрдого тела для студентов инженерно-технических специальностей
Курск 2002
Составители: А.А. Родионов, В.И. Разумов, А.Е. Кузько
УДК 53
Рецензенты:
Кандидат физико-математических наук, доцент кафедры физики В.Н. Бурмистров, Кандидат технических наук, доцент кафедры физики Г.Т. Сычёв
Исследование линейчатых спектров с помощью стилоскопа: Методические указания к выполнению лабораторной работы №75/ Курск. гос. техн. ун-т; Сост.: А.А. Родионов, В.И. Разумов, А.Е. Кузько. Курск, 2002. 11 с.
Содержат сведения о физических основах спектрального анализа. Служат для ознакомления с методикой качественного спектрального анализа металлов и сплавов.
Предназначены для студентов инженерно– технических специальностей.
Текст печатается в авторской редакции
Подписано в печать |
. Формат 60×84 1/16. Печать офсетная |
|
Усл.печ.л. 3,13. Уч.-изд.л. 3,37. Тираж 100 экз. Заказ |
. Бесплатно |
|
Курский государственный технический университет. Издательско– полиграфический центр Курского государственного технического университета. 305040 Курск, ул. 50 лет Октября, 94.
3
Лабораторная работа № 75.
Исследование линейчатых спектров с помощью стилоскопа
Цель работы: ознакомиться с физическими основами спектрального анализа, определить по спектру излучения качественный состав исследуемого образца.
Принадлежности: стилоскоп, металлические образцы.
Теоретическое введение
Попытки перенести в физику атома понятия и законы физики макроскопических тел натолкнулись на глубокие трудности, связанные с неприменимостью многих классических понятий к микромиру. Для их преодоления потребовалось коренным образом пересмотреть представления классической механики.
Для объяснения поведения электронов в атомах была создана квантовая механика с ее новым пониманием динамических свойств частиц.
Рассмотрим простейший атом – атом водорода, состоящий из протона и электрона, связанных электромагнитными силами. В квазиклассической и квантовой механике задача описания такой системы решена точно.
Квазиклассическое решение приводит к так называемой планетарной резерфордовской модели атома: электрон движется по круговой или эллиптической орбите вокруг ядра под действием сил электростатического притяжения к ядру, подобно тому, как планеты обращаются вокруг Солнца под действием сил гравитационного притяжения. Однако по законам классической электродинамики вращающийся вокруг ядра электрон должен непрерывно излучать электромагнитные волны и вследствие этого терять свою энергию.
Радиус его орбиты должен непрерывно уменьшаться, и электрон через короткое время должен был бы упасть на ядро. Таким образом, выводы классической теории противоречат наблюдаемой стабильности атомов. Кроме того, спектр атомов не непрерывен, а состоит из узких спектральных линий (линейчатые спектры), т.е. атом испускает и поглощает электромагнитные волны лишь избранных, определенных частот, характерных для данных химических элементов.
4
Существенный вклад в теорию атома внес Н. Бор, положив в ее основу два постулата:
1.Существуют стационарные состояния атома, характеризуемые
дискретным набором «разрешенных» значений энергии: W1, W2, W3… . В этих состояниях атом не излучает энергию. Изменение энергии атома возможно лишь при квантовом – скачкообразном переходе из одного стационарного состояния в другое.
2.Атом излучает и поглощает электромагнитное излучение определенной частоты νnm в виде кванта – фотона с энергией hνnm(h-постоянная Планка), переходя из одного стационарного состояния с энергией Wn в другое с энергией Wm, при этом
hνnm=Wn – W m |
(Wn > Wm). |
(1) |
При испускании фотона атом переходит в состояние с меньшей |
||
энергией, при поглощении – |
с большей. |
Набор возможных |
дискретных частот ν квантовых переходов и определяет линейчатый спектр атома.
Для вычисления возможных дискретных значений энергий стационарных состояний атома водорода Бор рассмотрел классическое движение электрона вокруг ядра, дополнив его «квантовым условием»: момент количества движения электронов на «разрешенной» (устойчивой) орбите должен быть кратен величине
ħ=h/2π. Для плоской круговой орбиты это значит |
|
mvr = nħ; n=1,2,3, |
…(2) |
где m-масса электрона. v-скорость его движения по орбите радиуса r. Из этого условия легко найти радиусы rn разрешенных орбит и полную энергию (кинетическую mv2/2 и потенциальную –ke 2/rn, где k = 1 4πεo ) электрона Wn на таких орбитах, если учесть, что сила
4πεo ) электрона Wn на таких орбитах, если учесть, что сила
кулоновского притяжения к ядру (равная для водорода ke2/r2n) – |
|||||||||||||||
является центростремительной силой mv2/r . |
|
|
|
|
|||||||||||
|
|
|
|
|
|
|
|
|
|
n |
|
|
|
|
|
|
|
|
r = |
|
H2 |
|
n |
2 = r n 2 |
|
|
|
(3) |
|||
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
n |
2 |
|
0 |
|
|
|
|
|
||||
|
|
|
|
|
me |
|
|
|
|
|
|
|
|
||
W |
= |
mv2 |
− k |
e2 |
|
= − |
me4k 2 |
|
= − |
13,60 |
э . |
(4) |
|||
|
|
|
|
||||||||||||
n |
2 |
|
|
rn |
|
|
|
2H2n2 |
|
n2 |
|
|
|||
|
|
|
|
|
|
|
|
|
|||||||
Возможные дискретные значения энергии электрона в атоме |
|||||||||||||||
водорода W1,W2,W3… |
, соответствующие n=1,2,3,…, |
показаны |
на |
||||||||||||

5
рис.1. Их называют уровнями энергии атома. Чем больше n, тем дальше от ядра находится электрон, и тем выше лежит соответствующий уровень энергии (т.к. энергия Wn электрона в атоме отрицательна, Wn< 0, что отвечает связанному состоянию атома). Наименьшая возможная энергия W1, называется основным уровнем. Эта энергия, взятая с обратным знаком, +13,60 эВ, представляет собой энергию ионизации атома водорода – энергию необходимую для отрыва от ядра электрона, находящегося на основном уровне. Уровни с n ³ 2 называются возбужденными. При отсутствии внешних воздействий атом находится в основном состоянии, т.е. электрон вращается на ближайшей к ядру орбите.
При переходе электрона с уровня Wn на уровень Wm (Wn>Wm) происходит испускание, а при обратном переходе – поглощение фотона с частотой
νnm= |
Wn − Wm |
= сR( |
1 |
- |
1 |
) . |
(5) |
|
m2 |
n2 |
|||||
|
h |
|
|
|
|||
Постоянная Ридберга R выражается через постоянные m, e, h, c и измеряется в м-1, с − скорость света, R = 1,0973731 м−1 .
Спектр атома водорода четко разбивается на группы – спектральные серии.
∞
6
5
4
3
2
1
Лаймана

Серии
Бальмера |
(–13,6 |
эВ) |
Пашена |
Брекета |
Пфунда |
|
|
|
|
Рис. 1
В ультрафиолетовой области по формуле (5) для m=1 n=2,3…
наблюдается серия Лаймана; |
в видимой – серия |
Бальмера (m=2, |
|
n=3,4…); |
в инфракрасной – |
Пашена (m=3,n=4,5…); |
Брекета (m=4, |
n=5,6…); |
Пфунда (m=5, n=6…) |
и т.д. |
|
6
Все эти серии возникают при переходе электронов с верхних на нижние уровни, как показано на рис. 1. Для более сложных, например атома гелия, теория Бора не могла объяснить количественно спектры, что свидетельствовало о ее непоследовательности. Правильное объяснение спектров всех атомов вещества возможно лишь с позиций квантовой теории.
Атомы вещества в изолированном состоянии дают линейчатые спектры, которые характерны только для каждого из них. Поэтому, изучая спектры излучения сложных веществ, можно по спектрам испускания определить их состав.
Для всякого элемента могут наблюдаться спектральные линии нейтральных атомов (дуговые спектры) и спектральные линии ионизированных атомов (искровые спектры). Спектр нейтрального атома условились обозначать римской цифрой I, спектры однократно, двукратно … ионизированных атомов соответственно II,III,….
Например для CrI, CrII, CrIII- говорят о первом, втором, третьем спектрах хрома. Следует помнить, что значение цифры всегда на единицу больше кратности ионизации: так СrIII означает спектр дважды ионизированного атома. Малому количеству атомов вещества соответствуют слабые линии спектральных серий, большому количеству яркие линии.
Экспериментальная часть
Спектр, излучаемый изолированными атомами химического элемента, строго постоянен и состоит из нескольких характерных спектральных линий. Каждая линия соответствует переходу электрона в атоме между конкретной парой энергетических уровней. Задача качественного спектрального анализа состоит в определении по спектру образца наличия в нем тех или иных химических элементов. Для проведения анализа необходимо часть вещества образца превратить в атомный газ, рассмотреть спектр этого газа и обнаружить в спектре линии, соответствующие определенному элементу. Приборы, служащие для проведения спектрального анализа, называются стилоскопами. В стилоскопе между электродом прибора и исследуемым образцом создается дуга. Атомы образца испаряются и поступают в пламя дуги. Свет дуги при помощи оптической системы превращается в параллельный пучок, который

7
попадает на диспергирующие призмы. Полученный в них спектр и наблюдается в ходе эксперимента.
3 |
2 |
1 |
|
|
7 |
|
4 |
|
9 |
5 |
6 |
|
8 |
|
|
|
Рис.2 Установка для спектрального анализа
Установка для изучения химического состава металлических образцов (рис.2) состоит из стилоскопа 1 (СЛУ), источника света 2 от дугового (искрового) разряда между стандартным электродом (медным диском) и электродом образца, источника питания 3 и рельса с подставками 8. Излучение от источника света через защитное стекло падает на поворотную призму в осветительной головке 4. Вращением ручки 5 осуществляют поворот призмы при настройке. В окуляр с указателем 7 наблюдают исследуемые спектры. Маховичок со шкалой 6 служит для перемещения указателя окуляра по линиям наблюдаемых спектров и определения их длин волн по дисперсионной кривой (рис.4). Ручки 9 «дуга/искра» и «ёмкость» источника питания 3 предназначены для переключения режимов работы и подключения дополнительной ёмкости при спектральном анализе трудновозбудимых образцов.
Внимание!
Включение установки производится в присутствии старшего лаборанта или преподавателя.
Ручки 9 «ДУГА/ИСКРА» и «ЁМКОСТЬ», во избежание обгорания контактов, можно переключать только при выключенном тумблере “ ПУСК” на источнике света!
Без заземления, во избежание поражения электрическим током, работать на установке нельзя!
8
Во время работы стилоскопа нельзя прикасаться к головке стилоскопа и электроду!
Менять образец на столике можно только при выключенном приборе.
Запрещается смотреть незащищёнными глазами на дугу (искру). По окончанию работы и в перерывах между анализами блок
питания необходимо выключать.
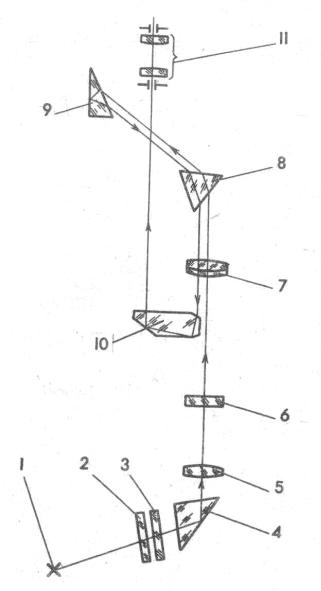
Оптическая схема стилоскопа СЛУ изображена на рисунке 3. Свет от дуги 1 призмой 4 направляется на линзу 5, которая формирует изображение источника на пластинку 6 с щелевой диафрагмой, установленной в фокальной плоскости объектива 7. Параллельный пучок света попадает на разлагающие его в спектр (диспергирующие) призмы 8, 9. Большой катет призмы 9 посеребрён, поэтому лучи отражаются от него, проходят в обратном направлении через призмы на объектив, затем призмой 10 направляются на окуляр 11, где наблюдается спектр. Для защиты призмы 4 от атмосферных паров, пыли и брызг расплавленного метал-
ла используется постоянное Рис.3 Оптическая схема стилоскопа защитное стекло 3 и сменное СЛУ
защитное стекло 2.
9
Эксперимент проводится в следующей последовательности:
1.Дисковый электрод прибора и образец зачищаются, и образец кладется на столик над электродом.
2.Устанавливается расстояние между образцом и электродом 3
мм.
3.Включить прибор. Вращением ручки 5 (рис.2), или небольшими наклонами стилоскопа добиться требуемой яркости наблюдаемого спектра. При необходимости, вращением окуляра 7, добиться максимальной резкости изображения.
Убедиться в наличии линейчатого спектра, полученного от дугового (искрового) разряда между образцом исследуемого металла и стандартным дисковым медным электродом.
4.По указанию преподавателя обнаружить наличие в спектре исследуемого образца спектральных линий соответствующих излучению ионов хрома (Cr), марганца (Mn) и др. Перемещая указатель окуляра по линиям спектра вращением маховичка 4, убедиться по показаниям шкалы маховичка в присутствии спектральных линий заданных химических элементов. Записываем все наличные элементы сплава и цвета их линий.
Примечание. Использовать лабораторные спектры и известные длины волн указанных преподавателем химических элементов, которые находятся в описании методики спектрального анализа сталей на стилоскопе СЛУ (прилагается к стилоскопу), а также дисперсионную кривую стилоскопа (рис.4). (1 ангстрем = 10-10 м).
5. Ознакомиться с методикой количественного спектрального анализа.
Контрольные вопросы
1.Модель атома Резерфорда-Бора. Постулаты Бора. Объяснение спектральных термов водорода и водородоподобных атомов с точки зрения теории Бора.
2.Спектральные серии атома водорода. Понятие о спектрах испускания и поглощения.
3.Спектр испускания паров металлов, различие между сплошным и линейчатыми спектрами, характерные линии спектров.

10
4. Как можно было бы провести качественный спектральный анализ, если бы шкала с символами химических элементов отсутствовала?
5.Принципиальное устройство стилоскопа и его назначение.
о
Длина волны, А
6500
6000
5500
5000
4500
4000
0 |
25 |
50 |
75 |
100 |
25 |
50 |
75 |
100 |
|
1- й оборот |
|
|
2-й оборот |
Деления шкалы |
|||
|
|
|
|
|
|
|
||
маховичка
Рис.4 Дисперсионная кривая стилоскопа СЛУ.
