
- •«Национальный исследовательский
- •Томский политехнический Университет»
- •Е.В. Михеева, н.П. Пикула, а.П. Асташкина
- •Коллоидная химия
- •Оглавление
- •Глава 1 дисперсные системы
- •1.1. Общая характеристика дисперсных систем
- •1.1.1. Признаки объектов коллоидной химии
- •1.1.2. Специфические особенности высокодисперсных систем
- •1.2. Классификации дисперсных систем
- •1.2.1. Классификация по размерам частиц дисперсной фазы
- •1.2.2. Классификация по агрегатному состоянию дисперсной фазы и дисперсионной среды
- •1.2.3. Классификация по силе межфазного взаимодействия дисперсной фазы и дисперсионной среды
- •1.2.4. Классификация по подвижности частиц дф (по структуре)
- •1.2.5. Классификация по фазовой различимости
- •1.2.6. Классификация по топографическому признаку (по форме частиц)
- •1.3. Методы получения дисперсных систем
- •1.3.1. Диспергационные методы
- •1.3.2. Конденсационные методы
- •1.3.2.1. Физические конденсационные методы
- •1.3.2.2. Химические конденсационные методы
- •2. Реакции обмена
- •3. Реакции окисления
- •1.3.3. Метод пептизации
- •1.4. Методы очистки дисперсных систем
- •Вопросыи задания для самоконтроля
- •Глава 2 термодинамика поверхностных явлений
- •2.1. Классификация поверхностных явлений
- •2.2. Свободная поверхностная энергия и поверхностное натяжение
- •2.2.1. Физический смысл поверхностного натяжения
- •2.2.2. Термодинамическое определение поверхностного натяжения
- •2.2.3. Единицы измерения поверхностного натяжения
- •2.3. Влияние различных факторов на величину поверхностного натяжения
- •2.3.1. Влияние химической природы вещества
- •2.3.2. Влияние температуры
- •2.3.3. Влияние природы граничащих фаз
- •2.3.4. Влияние природы и концентрации растворенного вещества
- •2.4. Межмолекулярные и межфазные взаимодействия
- •2.4.1. Когезия
- •2.4.2. Адгезия
- •2.4.3. Растекание одной жидкости по поверхности другой
- •2.4.4. Смачивание
- •2.4.4.1. Анализ уравнения Юнга
- •2.4.4.2. Флотация
- •2.5. Особенности искривленной поверхности раздела фаз
- •2.5.1. Уравнение Лапласа
- •2.5.2. Капиллярное давление. Течение жидкости в капиллярах
- •2.6. Методы определения поверхностного натяжения
- •2.6.1. Метод наибольшего давления пузырька газа (метод Ребиндера)
- •2.6.2. Сталагмометрический метод (метод счета капель)
- •2.6.3. Метод капиллярного поднятия жидкости
- •2.7. Влияние кривизны поверхности на давление насыщенного пара
- •2.7.1. Уравнения Томсона (Кельвина)
- •2.7.2. Капиллярная конденсация
- •2.7.3. Изотермическая перегонка
- •Вопросыи задания для самоконтроля
- •Глава 3 адсорбция
- •3.1. Основные понятия и определения
- •3.1.1. Количественные способы выражения величины адсорбции
- •3.1.2. Классификации адсорбции
- •1. Классификация по природе границы раздела
- •2. Классификация по типу взаимодействия адсорбата и адсорбента
- •3.1.3. Основные экспериментальные зависимости адсорбции
- •3.2.Адсорбция на границе твердое тело – газ
- •3.2.1. Теория мономолекулярной адсорбции Лэнгмюра
- •3.2.2. Эмпирическое уравнение адсорбции Фрейндлиха
- •3.2.3. Теория полимолекулярной адсорбции Поляни
- •3.2.4. Дальнейшие представления о многослойной адсорбции. Теория бэт
- •3.2.5. Адсорбция на пористых адсорбентах
- •3.2.6.Адсорбенты и их характеристики
- •3.3.Адсорбция на границе жидкость – газ
- •3.3.1. Фундаментальное уравнение адсорбции Гиббса
- •3.3.2. Свойства поверхностно-активных (пав) и поверхностно-инактивных (пив) веществ
- •3.3.3. Строение адсорбционного слоя на границе раствор–газ
- •3.3.4. Уравнение Шишковского
- •3.3.5. Поверхностная активность. Правило Дюкло – Траубе
- •3.3.6. Расчет гиббсовской адсорбции из изотермы поверхностного натяжения методом графического дифференцирования
- •3.3.7.Применение уравнения изотермы Лэнгмюра к адсорбции на границе жидкость–газ. Расчет молекулярных характеристик исследуемого пав
- •3.3.8. Мицеллообразование в растворах коллоидных пав
- •3.3.9. Классификации пав
- •3.3.10. Солюбилизация
- •3.3.11. Практическое значение пав
- •3.3.12. Проблемы биоразлагаемости промышленных пав
- •3.4.Адсорбция на границе твердое тело – раствор
- •3.4.1. Молекулярная адсорбция
- •3.4.2. Ионная адсорбция
- •3.4.3. Ионообменная адсорбция. Ионный обмен
- •Вопросыи задания для самоконтроля
- •Глава 4 электрические свойства дисперсных систем
- •4.1. Электрокинетические явления
- •4.1.1. Механизм образования двойного электрического слоя
- •1. Неравенство электрохимических потенциалов ионов в кристаллической решетке твердого тела и ионов в растворе
- •Адсорбционный механизм образования дэс
- •Механизм поверхностной диссоциации
- •2. Специфическая адсорбции ионов на поверхности твердой фазы
- •3. Ориентированная адсорбция поверхностно-активных веществ
- •4.2. Теории строения двойного электрического слоя
- •4.2.1. Экспериментальные факты, послужившие основой для создания теорий строения дэс
- •4.2.2. Теория строения дэс Гельмгольца – Перрена
- •4.2.3. Теория строения дэс Гуи – Чэпмена
- •4.2.4. Современная теория строения дэс Штерна
- •4.3. Электрокинетический потенциал
- •4.3.1. Определение электрокинетического потенциала из электрокинетических явлений
- •4.3.2. Практическое значение электрокинетических явлений
- •4.4. Строение коллоидных мицелл
- •4.4.1. Примеры мицелл гидрофобных золей в природе
- •Вопросы и задания для самоконтроля
- •Глава 5 устойчивость и коагуляция лиофобных дисперсных систем
- •5.1. Основные понятия и определения
- •5.1.1. Факторы агрегативной устойчивости лиофобных систем
- •5.2. Коагуляция
- •Стадии коагуляции
- •5.2.1. Кинетика коагуляции. Теория кинетики быстрой коагуляции Смолуховского
- •5.2.2. Коагуляция золей электролитами
- •Эмпирические правила электролитной коагуляции
- •5.3. Теория устойчивости лиофобных дисперсных систем длфо
- •5.3.1. Расклинивающее давление
- •Составляющие расклинивающего давления
- •5.3.2. Энергия электростатического отталкивания
- •5.3.3. Энергия молекулярного притяжения
- •5.3.4. Потенциальные кривые взаимодействия частиц
- •5.4. Закономерности коагуляции гидрофобных золей электролитами
- •5.4.1. Особые явления при коагуляции
- •Коагуляция смесью электролитов
- •5.4.2. Примеры коагуляции. Образование почв
- •5.4.3. Физико-химические методы очистки сточных вод
- •Вопросыи задания для самоконтроля
- •Глава 6 структурно-механические свойства дисперсных систем
- •6.1. Типы структур
- •6.2. Реологические свойства дисперсных систем
- •6.2.1. Вязкость жидких дисперсных систем
- •Вопросыи задания для самоконтроля
- •Глава 7 оптические свойства дисперсных систем
- •7.1. Рассеяние света в дисперсных системах
- •7.2. Поглощение света в дисперсных системах
- •7.3. Окраска дисперсных систем
- •Вопросыи задания для самоконтроля
- •Глава 8 молекулярно-кинетические свойства дисперсных систем
- •8.1. Осмос
- •8.2. Диффузия
- •8.3. Броуновское движение
- •8.4. Седиментационное равновесие
- •8.5. Седиментационный анализ
- •Вопросы и задания для самоконтроля
- •Глава 9 краткая характеристика основных дисперсных систем
- •9.1. Системы с жидкой дисперсионной средой
- •9.1.1. Суспензии и золи
- •Классификация суспензий
- •Получение суспензий
- •Значение суспензий
- •9.1.2. Эмульсии
- •Классификация эмульсий
- •Агрегативная устойчивость эмульсии и природа эмульгатора
- •9.1.3. Пены
- •9.2. Системы с газообразной дисперсионной средой
- •9.2.1. Аэрозоли
- •Классификации аэрозолей
- •Агрегативная устойчивость аэрозолей. Коагуляция
- •Методы разрушения аэрозолей
- •9.3. Системы с твердой дисперсионной средой
- •Вопросыи задания для самоконтроля
- •Перечень используемой литературы
- •Коллоидная химия
- •В авторской редакции
- •Отпечатано в Издательстве тпу в полном соответствии с качеством предоставленного оригинал-макета
5.2.2. Коагуляция золей электролитами
Причины, вызывающие коагуляцию очень разнообразны: действие теплоты или холода, электромагнитных полей, жестких излучений, механические воздействия, химические реагенты, время и т.д. Основным фактором, вызывающим коагуляцию, является действие на коллоидный раствор электролитов.
Эмпирические правила электролитной коагуляции
1. Все без исключения сильные электролиты при определенной концентрации могут вызвать коагуляцию коллоидного раствора.
2. Правило знака заряда: коагуляцию золя вызывает тот ион электролита, знак заряда которого противоположен заряду коллоидной частицы. Этот ион электролита называют ионом-коагулятором.
3. Каждый электролит по отношению к коллоидному раствору обладает порогом коагуляции.
Порог коагуляции (γ, Скр) – некоторая минимальная (критическая) концентрация электролита, достаточная для того, чтобы вызвать коагуляцию золя:
![]() , (5.14)
, (5.14)
где
![]() – порог коагуляции (критическая
концентрация электролита, вызывающая
коагуляцию золя), моль/л;V
– объем электролита, вызывающего
коагуляцию, мл; C
– концентрация электролита, моль/л; W
– объем
золя, мл.
– порог коагуляции (критическая
концентрация электролита, вызывающая
коагуляцию золя), моль/л;V
– объем электролита, вызывающего
коагуляцию, мл; C
– концентрация электролита, моль/л; W
– объем
золя, мл.
Коагулирующая способность (сила) электролита (P) – величина, обратно пропорциональная порогу коагуляции:
![]() . (5.15)
. (5.15)
4. Влияние заряда (валентности) иона коагулятора (правило Шульце – Гарди). Коагулирующая способность электролита возрастает с увеличением валентности иона-коагулятора.
![]() , (5.16)
, (5.16)
где
![]() – валентность (заряд) иона-коагулятора,n
= 2 6
– валентность (заряд) иона-коагулятора,n
= 2 6

5. Коагулирующая сила ионов-коагуляторов одной и той же валентности возрастает с увеличением радиуса иона-коагулятора (лиотропные ряды).


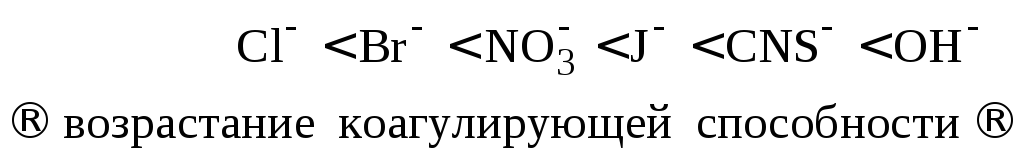
Пример 5.3. Золь гидроксида цинка получен путем сливания растворов ZnCl2 и NaOH. Определите знак заряда коллоидной частицы, напишите формулу мицеллы, если пороги коагуляции растворов электролитов следующие:
|
Электролит |
Na2SO4 |
Mg(NO3)2 |
Na3PO4 |
NaCl |
|
γ, моль/л |
0,05 |
3,0 |
0,004 |
3,0 |
Решение. Определим знак заряда частиц золя. Так как катионы всех электролитов-коагуляторов одновалентны, а их пороги коагуляции разные, что не соответствует правилу Шульце – Гарди, следовательно, коагуляцию золя вызывают не катионы, а анионы электролитов. В данном случае получается: чем выше заряд аниона, тем меньше порог коагуляции (справедливо правило Шульце – Гарди). Следовательно, согласно «правилу знака заряда», заряд коллоидной частицы положительный. Следовательно, потенциалопределяющие ионы – Zn2+, противоионы – Сl–.
Запишем строение мицеллы:
![]() .
.
Пример 5.4. Золь иодида серебра получен сливанием растворов KI и AgNO3. Определите знак заряда коллоидной частицы, напишите формулу мицеллы, если пороги коагуляции растворов электролитов следующие:
|
Электролит |
KCl |
KNO3 |
Ba(NO3)2 |
La(NO3)3 |
|
γ, моль/л |
5,2 |
5,1 |
0,08 |
0,007 |
Решение. Определим знак заряда частиц золя. Так как анионы всех электролитов-коагуляторов одновалентны, а их пороги коагуляции разные, что не соответствует правилу Шульце – Гарди, следовательно, коагуляцию золя вызывают не анионы, а катионы электролитов. В данном случае получается: чем выше заряд катиона, тем меньше порог коагуляции (справедливо правило Шульце – Гарди). Следовательно, согласно «правилу знака заряда», заряд коллоидной частицы отрицательный. Следовательно, потенциалопределяющие ионы – I–, противоионы – K+.
Запишем строение мицеллы:
![]() .
.
Пример 5.5. Золь гидроксида алюминия получен путем сливания растворов AlCl3 и NaOH. Определите знак заряда коллоидной частицы, напишите формулу мицеллы, если пороги коагуляции электролитов следующие:
|
Электролит |
Na2SO4 |
Mg(NO3)2 |
Na3PO4 |
NaCl |
|
γ, моль/л |
0,011 |
0,70 |
0,001 |
0,70 |
Решение. Определим знак заряда частиц золя. У Mg(NO3)2 и NaCl одинаковые пороги коагуляции, одинаковый заряд аниона, но разный заряд катиона. Следовательно, коагуляцию золя вызывают анионы электролитов.
В данном случае получается: чем выше заряд аниона, тем меньше порог коагуляции (справедливо правило Шульце – Гарди). Следовательно, согласно «правилу знака заряда», заряд коллоидной частицы положительный. Следовательно, потенциалопределяющие ионы – Al3+, противоионы – Сl–.
Запишем строение мицеллы:
![]() .
.
