
- •«Национальный исследовательский
- •Томский политехнический Университет»
- •Е.В. Михеева, н.П. Пикула, а.П. Асташкина
- •Коллоидная химия
- •Оглавление
- •Глава 1 дисперсные системы
- •1.1. Общая характеристика дисперсных систем
- •1.1.1. Признаки объектов коллоидной химии
- •1.1.2. Специфические особенности высокодисперсных систем
- •1.2. Классификации дисперсных систем
- •1.2.1. Классификация по размерам частиц дисперсной фазы
- •1.2.2. Классификация по агрегатному состоянию дисперсной фазы и дисперсионной среды
- •1.2.3. Классификация по силе межфазного взаимодействия дисперсной фазы и дисперсионной среды
- •1.2.4. Классификация по подвижности частиц дф (по структуре)
- •1.2.5. Классификация по фазовой различимости
- •1.2.6. Классификация по топографическому признаку (по форме частиц)
- •1.3. Методы получения дисперсных систем
- •1.3.1. Диспергационные методы
- •1.3.2. Конденсационные методы
- •1.3.2.1. Физические конденсационные методы
- •1.3.2.2. Химические конденсационные методы
- •2. Реакции обмена
- •3. Реакции окисления
- •1.3.3. Метод пептизации
- •1.4. Методы очистки дисперсных систем
- •Вопросыи задания для самоконтроля
- •Глава 2 термодинамика поверхностных явлений
- •2.1. Классификация поверхностных явлений
- •2.2. Свободная поверхностная энергия и поверхностное натяжение
- •2.2.1. Физический смысл поверхностного натяжения
- •2.2.2. Термодинамическое определение поверхностного натяжения
- •2.2.3. Единицы измерения поверхностного натяжения
- •2.3. Влияние различных факторов на величину поверхностного натяжения
- •2.3.1. Влияние химической природы вещества
- •2.3.2. Влияние температуры
- •2.3.3. Влияние природы граничащих фаз
- •2.3.4. Влияние природы и концентрации растворенного вещества
- •2.4. Межмолекулярные и межфазные взаимодействия
- •2.4.1. Когезия
- •2.4.2. Адгезия
- •2.4.3. Растекание одной жидкости по поверхности другой
- •2.4.4. Смачивание
- •2.4.4.1. Анализ уравнения Юнга
- •2.4.4.2. Флотация
- •2.5. Особенности искривленной поверхности раздела фаз
- •2.5.1. Уравнение Лапласа
- •2.5.2. Капиллярное давление. Течение жидкости в капиллярах
- •2.6. Методы определения поверхностного натяжения
- •2.6.1. Метод наибольшего давления пузырька газа (метод Ребиндера)
- •2.6.2. Сталагмометрический метод (метод счета капель)
- •2.6.3. Метод капиллярного поднятия жидкости
- •2.7. Влияние кривизны поверхности на давление насыщенного пара
- •2.7.1. Уравнения Томсона (Кельвина)
- •2.7.2. Капиллярная конденсация
- •2.7.3. Изотермическая перегонка
- •Вопросыи задания для самоконтроля
- •Глава 3 адсорбция
- •3.1. Основные понятия и определения
- •3.1.1. Количественные способы выражения величины адсорбции
- •3.1.2. Классификации адсорбции
- •1. Классификация по природе границы раздела
- •2. Классификация по типу взаимодействия адсорбата и адсорбента
- •3.1.3. Основные экспериментальные зависимости адсорбции
- •3.2.Адсорбция на границе твердое тело – газ
- •3.2.1. Теория мономолекулярной адсорбции Лэнгмюра
- •3.2.2. Эмпирическое уравнение адсорбции Фрейндлиха
- •3.2.3. Теория полимолекулярной адсорбции Поляни
- •3.2.4. Дальнейшие представления о многослойной адсорбции. Теория бэт
- •3.2.5. Адсорбция на пористых адсорбентах
- •3.2.6.Адсорбенты и их характеристики
- •3.3.Адсорбция на границе жидкость – газ
- •3.3.1. Фундаментальное уравнение адсорбции Гиббса
- •3.3.2. Свойства поверхностно-активных (пав) и поверхностно-инактивных (пив) веществ
- •3.3.3. Строение адсорбционного слоя на границе раствор–газ
- •3.3.4. Уравнение Шишковского
- •3.3.5. Поверхностная активность. Правило Дюкло – Траубе
- •3.3.6. Расчет гиббсовской адсорбции из изотермы поверхностного натяжения методом графического дифференцирования
- •3.3.7.Применение уравнения изотермы Лэнгмюра к адсорбции на границе жидкость–газ. Расчет молекулярных характеристик исследуемого пав
- •3.3.8. Мицеллообразование в растворах коллоидных пав
- •3.3.9. Классификации пав
- •3.3.10. Солюбилизация
- •3.3.11. Практическое значение пав
- •3.3.12. Проблемы биоразлагаемости промышленных пав
- •3.4.Адсорбция на границе твердое тело – раствор
- •3.4.1. Молекулярная адсорбция
- •3.4.2. Ионная адсорбция
- •3.4.3. Ионообменная адсорбция. Ионный обмен
- •Вопросыи задания для самоконтроля
- •Глава 4 электрические свойства дисперсных систем
- •4.1. Электрокинетические явления
- •4.1.1. Механизм образования двойного электрического слоя
- •1. Неравенство электрохимических потенциалов ионов в кристаллической решетке твердого тела и ионов в растворе
- •Адсорбционный механизм образования дэс
- •Механизм поверхностной диссоциации
- •2. Специфическая адсорбции ионов на поверхности твердой фазы
- •3. Ориентированная адсорбция поверхностно-активных веществ
- •4.2. Теории строения двойного электрического слоя
- •4.2.1. Экспериментальные факты, послужившие основой для создания теорий строения дэс
- •4.2.2. Теория строения дэс Гельмгольца – Перрена
- •4.2.3. Теория строения дэс Гуи – Чэпмена
- •4.2.4. Современная теория строения дэс Штерна
- •4.3. Электрокинетический потенциал
- •4.3.1. Определение электрокинетического потенциала из электрокинетических явлений
- •4.3.2. Практическое значение электрокинетических явлений
- •4.4. Строение коллоидных мицелл
- •4.4.1. Примеры мицелл гидрофобных золей в природе
- •Вопросы и задания для самоконтроля
- •Глава 5 устойчивость и коагуляция лиофобных дисперсных систем
- •5.1. Основные понятия и определения
- •5.1.1. Факторы агрегативной устойчивости лиофобных систем
- •5.2. Коагуляция
- •Стадии коагуляции
- •5.2.1. Кинетика коагуляции. Теория кинетики быстрой коагуляции Смолуховского
- •5.2.2. Коагуляция золей электролитами
- •Эмпирические правила электролитной коагуляции
- •5.3. Теория устойчивости лиофобных дисперсных систем длфо
- •5.3.1. Расклинивающее давление
- •Составляющие расклинивающего давления
- •5.3.2. Энергия электростатического отталкивания
- •5.3.3. Энергия молекулярного притяжения
- •5.3.4. Потенциальные кривые взаимодействия частиц
- •5.4. Закономерности коагуляции гидрофобных золей электролитами
- •5.4.1. Особые явления при коагуляции
- •Коагуляция смесью электролитов
- •5.4.2. Примеры коагуляции. Образование почв
- •5.4.3. Физико-химические методы очистки сточных вод
- •Вопросыи задания для самоконтроля
- •Глава 6 структурно-механические свойства дисперсных систем
- •6.1. Типы структур
- •6.2. Реологические свойства дисперсных систем
- •6.2.1. Вязкость жидких дисперсных систем
- •Вопросыи задания для самоконтроля
- •Глава 7 оптические свойства дисперсных систем
- •7.1. Рассеяние света в дисперсных системах
- •7.2. Поглощение света в дисперсных системах
- •7.3. Окраска дисперсных систем
- •Вопросыи задания для самоконтроля
- •Глава 8 молекулярно-кинетические свойства дисперсных систем
- •8.1. Осмос
- •8.2. Диффузия
- •8.3. Броуновское движение
- •8.4. Седиментационное равновесие
- •8.5. Седиментационный анализ
- •Вопросы и задания для самоконтроля
- •Глава 9 краткая характеристика основных дисперсных систем
- •9.1. Системы с жидкой дисперсионной средой
- •9.1.1. Суспензии и золи
- •Классификация суспензий
- •Получение суспензий
- •Значение суспензий
- •9.1.2. Эмульсии
- •Классификация эмульсий
- •Агрегативная устойчивость эмульсии и природа эмульгатора
- •9.1.3. Пены
- •9.2. Системы с газообразной дисперсионной средой
- •9.2.1. Аэрозоли
- •Классификации аэрозолей
- •Агрегативная устойчивость аэрозолей. Коагуляция
- •Методы разрушения аэрозолей
- •9.3. Системы с твердой дисперсионной средой
- •Вопросыи задания для самоконтроля
- •Перечень используемой литературы
- •Коллоидная химия
- •В авторской редакции
- •Отпечатано в Издательстве тпу в полном соответствии с качеством предоставленного оригинал-макета
4.3. Электрокинетический потенциал
Электрокинетический (дзета) потенциал – потенциал, возникающий на границе скольжения фаз при их относительном перемещении в электрическом поле.
Положение плоскости скольжения (линия АВ) в ДЭС не известно. Полагают, что плоскость скольжения проходит на расстоянии толщины плотной части ДЭС, и в этом случае ζ = φd; либо смещена в жидкую фазу, тогда ζ < φd. Часто принимают, что ζ = φd, поскольку теоретические закономерности, предсказанные для φd, хорошо подтверждаются на опыте в отношении ζ.
Электрокинетический потенциал отражает свойства ДЭС и определяется экспериментально из электрокинетических явлений. Порядок величин ζ в зависимости от состава фаз и концентрации электролита обычно составляет 0,01÷0,1 В.
4.3.1. Определение электрокинетического потенциала из электрокинетических явлений
Знак заряда коллоидной частицы, а также величину электрокинетического потенциала можно вычислить с помощью любого электрокинетического явления.
При наложении электрического поля происходит разрыв ДЭС по плоскости скольжения. Электрическая сила, действующая на частицу при наложении внешнего электрического поля, вызывающая движение заряженной частицы к противоположно заряженному электроду, уравновешивается силой трения возникающей в жидкости
Скорость перемещения коллоидной частицы в электрическом поле зависит:
от свойств дисперсионной среды (вязкости η, диэлектрической проницаемости ε);
строения ДЭС коллоидной частицы – величины ζ;
напряженности внешнего электрического поля Н.
Линейная скорость движения дисперсной фазы (дисперсионной среды) (U) отнесенная к единице напряженности электрического поля (Н), называется электрофоретической (электроосмотической) подвижностью (U0):
![]() , (4.2)
, (4.2)
где U0 – электрофоретическая подвижность, м2/В·с; U – линейная скорость движения границы золь – боковая жидкость, м/с; H – напряженность электрического поля, В/м.
Электрокинетический потенциал связан с электрофоретической (электроосмотической) подвижностью, уравнением Гельмгольца – Смолуховского:
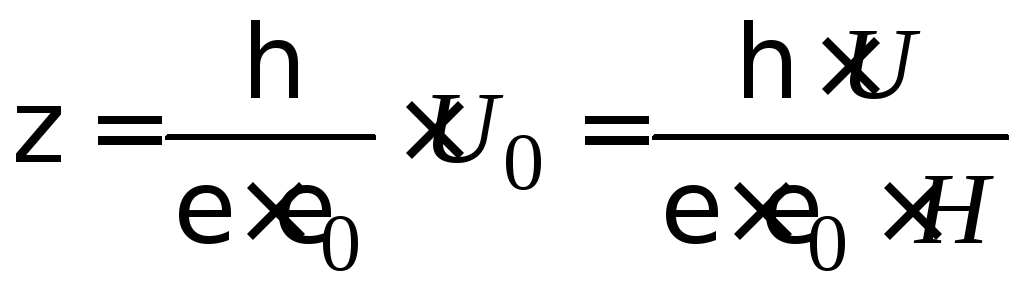 , (4.3)
, (4.3)
где
ζ – величина электрокинетического
потенциала, В; η – вязкость дисперсионной
среды, Н·с/м2;
ε – диэлектрическая проницаемость
среды, для водной среды равная 81
(безразмерная величина);
![]() – электрическая константа (диэлектрическая
проницаемость вакуума), равная 8,85·10–12
Ф/м; U
– линейная скорость движения границы
золь-боковая жидкость, м/с; H
– напряженность электрического поля,
В/м.
– электрическая константа (диэлектрическая
проницаемость вакуума), равная 8,85·10–12
Ф/м; U
– линейная скорость движения границы
золь-боковая жидкость, м/с; H
– напряженность электрического поля,
В/м.
Линейную скорость движения границы золь-боковая жидкость рассчитывают как отношение смещения границы раздела за время электрофореза:
![]() , (4.4)
, (4.4)
где h – смещение границы золь-боковая жидкость за время электрофореза, м; t – время электрофореза, с.
Напряженность электрического поля (градиент потенциала) рассчитывают как отношение приложенной разности потенциалов к расстоянию между электродами:
![]() , (4.5)
, (4.5)
где Е – приложенная разность потенциалов, В; l – расстояние между электродами, м.
Тогда уравнение Гельмгольца – Смолуховского для электрофореза запишется:
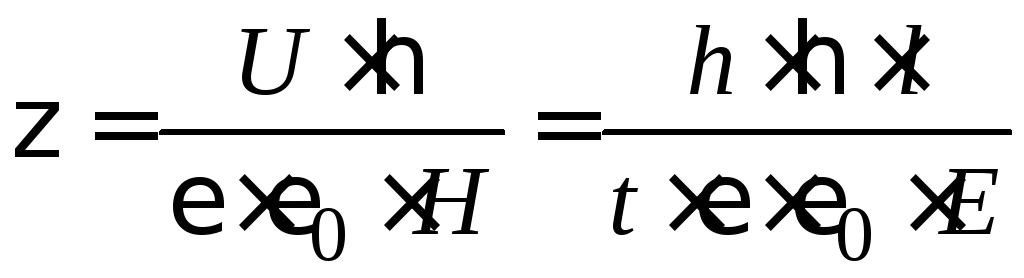 . (4.6)
. (4.6)
Расчет электрокинетического потенциала при электроосмосе ведут по уравнению:
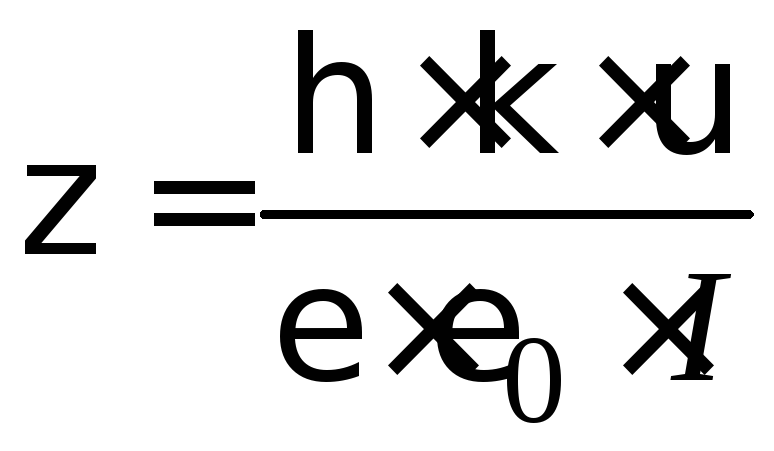 , (4.7)
, (4.7)
где
![]() – величина электрокинетического
потенциала, В;
– величина электрокинетического
потенциала, В;![]() – вязкость среды, Н·с/м2;
– вязкость среды, Н·с/м2;
![]() – диэлектрическая проницаемость среды,
для водной среды равная 81 (безразмерная
величина);
– диэлектрическая проницаемость среды,
для водной среды равная 81 (безразмерная
величина);![]() – электрическая константа (диэлектрическая
проницаемость вакуума), равная 8,85·10–12
Ф/м;
– электрическая константа (диэлектрическая
проницаемость вакуума), равная 8,85·10–12
Ф/м;
![]() – удельная электрическая проводимость,
Ом–1м–1;
– удельная электрическая проводимость,
Ом–1м–1;
![]() – объемная скорость электроосмоса,
м3/с;
I
– сила тока, А.
– объемная скорость электроосмоса,
м3/с;
I
– сила тока, А.
Объемная
скорость электроосмоса (![]() )
– скорость перемещения объема раствораV,
(м3)
в единицу времени t,
с:
)
– скорость перемещения объема раствораV,
(м3)
в единицу времени t,
с:
![]() . (4.8)
. (4.8)
Потенциал течения – возникновение разности потенциалов при продавливании через пористую диафрагму жидкости под действием внешней силы (давления).
Потенциал течения не зависит от площади и толщины диафрагмы, от количества протекающей жидкости, а зависит от давления, поддерживающего течение по уравнению:
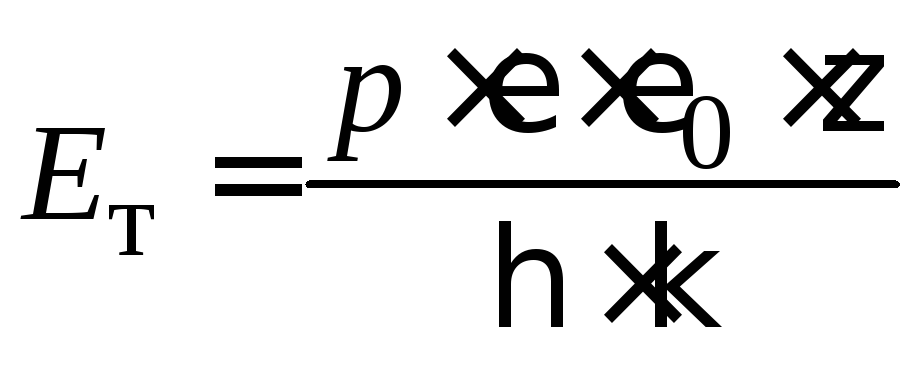 , (4.9)
, (4.9)
где
![]() – потенциал течения, В;
– потенциал течения, В;![]() – величина электрокинетического
потенциала, В;
– величина электрокинетического
потенциала, В;![]() – вязкость среды, Н·с/м2;
– вязкость среды, Н·с/м2;
![]() – диэлектрическая проницаемость среды,
для водной среды равная 81 (безразмерная
величина);
– диэлектрическая проницаемость среды,
для водной среды равная 81 (безразмерная
величина);![]() – электрическая константа (диэлектрическая
проницаемость вакуума), равная 8,85·10–12
Ф/м;
– электрическая константа (диэлектрическая
проницаемость вакуума), равная 8,85·10–12
Ф/м;
![]() – удельная электрическая проводимость,
Ом–1м–1;
р
– давление, приводящее жидкость в
движение, Н/м2.
– удельная электрическая проводимость,
Ом–1м–1;
р
– давление, приводящее жидкость в
движение, Н/м2.
Пример 4.1. Вычислите величину электрокинетического потенциала для латекса полистирола, если при электрофорезе смещение цветной границы за 60 мин составляет h = 2,6 см. Напряжение, приложенное в электродам Е = 115 В. Расстояние между электродами l = 55 см. Диэлектрическая проницаемость воды ε = 81, вязкость среды η = 1·10–3 Н·с/м2.
Решение. Для расчета электрокинетического потенциала воспользуемся уравнением (4.6):
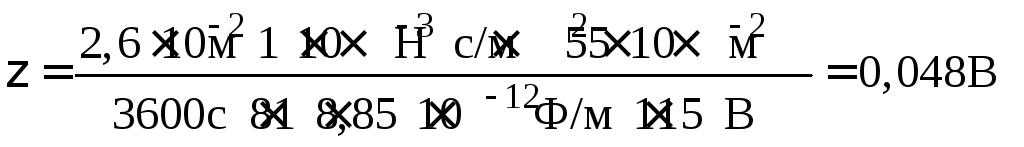 .
.
