- •«Национальный исследовательский
- •Томский политехнический Университет»
- •Е.В. Михеева, н.П. Пикула, а.П. Асташкина
- •Коллоидная химия
- •Оглавление
- •Глава 1 дисперсные системы
- •1.1. Общая характеристика дисперсных систем
- •1.1.1. Признаки объектов коллоидной химии
- •1.1.2. Специфические особенности высокодисперсных систем
- •1.2. Классификации дисперсных систем
- •1.2.1. Классификация по размерам частиц дисперсной фазы
- •1.2.2. Классификация по агрегатному состоянию дисперсной фазы и дисперсионной среды
- •1.2.3. Классификация по силе межфазного взаимодействия дисперсной фазы и дисперсионной среды
- •1.2.4. Классификация по подвижности частиц дф (по структуре)
- •1.2.5. Классификация по фазовой различимости
- •1.2.6. Классификация по топографическому признаку (по форме частиц)
- •1.3. Методы получения дисперсных систем
- •1.3.1. Диспергационные методы
- •1.3.2. Конденсационные методы
- •1.3.2.1. Физические конденсационные методы
- •1.3.2.2. Химические конденсационные методы
- •2. Реакции обмена
- •3. Реакции окисления
- •1.3.3. Метод пептизации
- •1.4. Методы очистки дисперсных систем
- •Вопросыи задания для самоконтроля
- •Глава 2 термодинамика поверхностных явлений
- •2.1. Классификация поверхностных явлений
- •2.2. Свободная поверхностная энергия и поверхностное натяжение
- •2.2.1. Физический смысл поверхностного натяжения
- •2.2.2. Термодинамическое определение поверхностного натяжения
- •2.2.3. Единицы измерения поверхностного натяжения
- •2.3. Влияние различных факторов на величину поверхностного натяжения
- •2.3.1. Влияние химической природы вещества
- •2.3.2. Влияние температуры
- •2.3.3. Влияние природы граничащих фаз
- •2.3.4. Влияние природы и концентрации растворенного вещества
- •2.4. Межмолекулярные и межфазные взаимодействия
- •2.4.1. Когезия
- •2.4.2. Адгезия
- •2.4.3. Растекание одной жидкости по поверхности другой
- •2.4.4. Смачивание
- •2.4.4.1. Анализ уравнения Юнга
- •2.4.4.2. Флотация
- •2.5. Особенности искривленной поверхности раздела фаз
- •2.5.1. Уравнение Лапласа
- •2.5.2. Капиллярное давление. Течение жидкости в капиллярах
- •2.6. Методы определения поверхностного натяжения
- •2.6.1. Метод наибольшего давления пузырька газа (метод Ребиндера)
- •2.6.2. Сталагмометрический метод (метод счета капель)
- •2.6.3. Метод капиллярного поднятия жидкости
- •2.7. Влияние кривизны поверхности на давление насыщенного пара
- •2.7.1. Уравнения Томсона (Кельвина)
- •2.7.2. Капиллярная конденсация
- •2.7.3. Изотермическая перегонка
- •Вопросыи задания для самоконтроля
- •Глава 3 адсорбция
- •3.1. Основные понятия и определения
- •3.1.1. Количественные способы выражения величины адсорбции
- •3.1.2. Классификации адсорбции
- •1. Классификация по природе границы раздела
- •2. Классификация по типу взаимодействия адсорбата и адсорбента
- •3.1.3. Основные экспериментальные зависимости адсорбции
- •3.2.Адсорбция на границе твердое тело – газ
- •3.2.1. Теория мономолекулярной адсорбции Лэнгмюра
- •3.2.2. Эмпирическое уравнение адсорбции Фрейндлиха
- •3.2.3. Теория полимолекулярной адсорбции Поляни
- •3.2.4. Дальнейшие представления о многослойной адсорбции. Теория бэт
- •3.2.5. Адсорбция на пористых адсорбентах
- •3.2.6.Адсорбенты и их характеристики
- •3.3.Адсорбция на границе жидкость – газ
- •3.3.1. Фундаментальное уравнение адсорбции Гиббса
- •3.3.2. Свойства поверхностно-активных (пав) и поверхностно-инактивных (пив) веществ
- •3.3.3. Строение адсорбционного слоя на границе раствор–газ
- •3.3.4. Уравнение Шишковского
- •3.3.5. Поверхностная активность. Правило Дюкло – Траубе
- •3.3.6. Расчет гиббсовской адсорбции из изотермы поверхностного натяжения методом графического дифференцирования
- •3.3.7.Применение уравнения изотермы Лэнгмюра к адсорбции на границе жидкость–газ. Расчет молекулярных характеристик исследуемого пав
- •3.3.8. Мицеллообразование в растворах коллоидных пав
- •3.3.9. Классификации пав
- •3.3.10. Солюбилизация
- •3.3.11. Практическое значение пав
- •3.3.12. Проблемы биоразлагаемости промышленных пав
- •3.4.Адсорбция на границе твердое тело – раствор
- •3.4.1. Молекулярная адсорбция
- •3.4.2. Ионная адсорбция
- •3.4.3. Ионообменная адсорбция. Ионный обмен
- •Вопросыи задания для самоконтроля
- •Глава 4 электрические свойства дисперсных систем
- •4.1. Электрокинетические явления
- •4.1.1. Механизм образования двойного электрического слоя
- •1. Неравенство электрохимических потенциалов ионов в кристаллической решетке твердого тела и ионов в растворе
- •Адсорбционный механизм образования дэс
- •Механизм поверхностной диссоциации
- •2. Специфическая адсорбции ионов на поверхности твердой фазы
- •3. Ориентированная адсорбция поверхностно-активных веществ
- •4.2. Теории строения двойного электрического слоя
- •4.2.1. Экспериментальные факты, послужившие основой для создания теорий строения дэс
- •4.2.2. Теория строения дэс Гельмгольца – Перрена
- •4.2.3. Теория строения дэс Гуи – Чэпмена
- •4.2.4. Современная теория строения дэс Штерна
- •4.3. Электрокинетический потенциал
- •4.3.1. Определение электрокинетического потенциала из электрокинетических явлений
- •4.3.2. Практическое значение электрокинетических явлений
- •4.4. Строение коллоидных мицелл
- •4.4.1. Примеры мицелл гидрофобных золей в природе
- •Вопросы и задания для самоконтроля
- •Глава 5 устойчивость и коагуляция лиофобных дисперсных систем
- •5.1. Основные понятия и определения
- •5.1.1. Факторы агрегативной устойчивости лиофобных систем
- •5.2. Коагуляция
- •Стадии коагуляции
- •5.2.1. Кинетика коагуляции. Теория кинетики быстрой коагуляции Смолуховского
- •5.2.2. Коагуляция золей электролитами
- •Эмпирические правила электролитной коагуляции
- •5.3. Теория устойчивости лиофобных дисперсных систем длфо
- •5.3.1. Расклинивающее давление
- •Составляющие расклинивающего давления
- •5.3.2. Энергия электростатического отталкивания
- •5.3.3. Энергия молекулярного притяжения
- •5.3.4. Потенциальные кривые взаимодействия частиц
- •5.4. Закономерности коагуляции гидрофобных золей электролитами
- •5.4.1. Особые явления при коагуляции
- •Коагуляция смесью электролитов
- •5.4.2. Примеры коагуляции. Образование почв
- •5.4.3. Физико-химические методы очистки сточных вод
- •Вопросыи задания для самоконтроля
- •Глава 6 структурно-механические свойства дисперсных систем
- •6.1. Типы структур
- •6.2. Реологические свойства дисперсных систем
- •6.2.1. Вязкость жидких дисперсных систем
- •Вопросыи задания для самоконтроля
- •Глава 7 оптические свойства дисперсных систем
- •7.1. Рассеяние света в дисперсных системах
- •7.2. Поглощение света в дисперсных системах
- •7.3. Окраска дисперсных систем
- •Вопросыи задания для самоконтроля
- •Глава 8 молекулярно-кинетические свойства дисперсных систем
- •8.1. Осмос
- •8.2. Диффузия
- •8.3. Броуновское движение
- •8.4. Седиментационное равновесие
- •8.5. Седиментационный анализ
- •Вопросы и задания для самоконтроля
- •Глава 9 краткая характеристика основных дисперсных систем
- •9.1. Системы с жидкой дисперсионной средой
- •9.1.1. Суспензии и золи
- •Классификация суспензий
- •Получение суспензий
- •Значение суспензий
- •9.1.2. Эмульсии
- •Классификация эмульсий
- •Агрегативная устойчивость эмульсии и природа эмульгатора
- •9.1.3. Пены
- •9.2. Системы с газообразной дисперсионной средой
- •9.2.1. Аэрозоли
- •Классификации аэрозолей
- •Агрегативная устойчивость аэрозолей. Коагуляция
- •Методы разрушения аэрозолей
- •9.3. Системы с твердой дисперсионной средой
- •Вопросыи задания для самоконтроля
- •Перечень используемой литературы
- •Коллоидная химия
- •В авторской редакции
- •Отпечатано в Издательстве тпу в полном соответствии с качеством предоставленного оригинал-макета
3.3.8. Мицеллообразование в растворах коллоидных пав
Мицеллообразующие (коллоидные) ПАВ – вещества, очень сильно снижающие величину поверхностного натяжения в области малых концентраций, и, практически, не влияющие на величину поверхностного натяжения в области больших концентраций, называются (кривая 4, рис. 3.19).
Молекулы коллоидных ПАВ состоят из большого гидрофобного углеводородного радикала и сильно гидратирующейся полярной группы. В растворах коллоидных ПАВ самопроизвольно образуются агрегаты из ориентированных молекул (мицеллы).
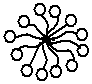
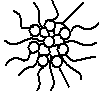
Мицелла – ассоциат дифильных молекул, лиофильные группы которых обращены к растворителю, а лиофобные группы собираются вместе, образуя ядро мицеллы. Различают: прямые и обратные мицеллы.
|
Рис. 3.34. Прямая мицелла
|
Прямые мицеллы – мицеллы ПАВ, образующиеся в водной среде (гидрофильные полярные группы снаружи, а гидрофобные углеводородные радикалы – внутри). |
|
Рис. 3.35. Обратная мицелла |
Обратные мицеллы – мицеллы ПАВ, образующиеся в неполярной жидкости (гидрофильные полярные группы внутри, а гидрофобные углеводородные радикалы – снаружи). |
Ориентирование дифильных молекул ПАВ в мицелле обеспечивает минимальное межфазное натяжение на границе мицелла – дисперсионная среда и тем самым термодинамическую устойчивость мицеллярного раствора.
Растворы коллоидных ПАВ являются лиофильными дисперсными системами, т.е. самопроизвольно образующимися с минимумом энергии Гиббса и термодинамически устойчивыми.
Коллоидные ПАВ обладают малой растворимостью в воде, что проявляется в их положительной поверхностной активности, а с ростом концентрации – в значительной ассоциации молекул, переходящей в мицеллообразование. Для изотерм поверхностного натяжения коллоидных ПАВ характерно более резкое понижение поверхностного натяжения с увеличением концентрации по сравнению с истинно растворимыми ПАВ и наличие излома на изотерме в области очень низких концентраций, соответствующих истинной растворимости (10–3÷10–6 моль/л). При дальнейшем повышении концентрации ПАВ в растворе поверхностное натяжение остается практически постоянным.
Концентрация в точке излома на изотерме поверхностного натяжения соответствует критической концентрации мицеллообразования (КММ). Выше КММ в растворе самопроизвольно протекают процессы образования мицелл, и истинный раствор переходит в ультрамикрогетерогенную систему (золь).
Более
резко точка излома выявляется на
изотерме, построенной в координатах
![]() для неионогенных ПАВ (рис. 3.36) и
для неионогенных ПАВ (рис. 3.36) и![]() для ионогенных ПАВ (ν – число ионов,
образующихся при диссоциации молекулы
ПАВ).
для ионогенных ПАВ (ν – число ионов,
образующихся при диссоциации молекулы
ПАВ).
Число молекул, составляющих мицеллу, называют числом ассоциации, а сумму молекулярных масс всех молекул в мицелле – мицеллярной массой.
Ориентирование дифильных молекул ПАВ в мицелле обеспечивает минимальное межфазное натяжение на границе мицелла – среда и тем самым термодинамическую устойчивость мицеллярного раствора.
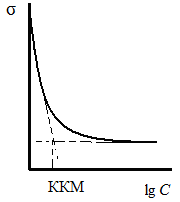
Рис. 3.36. Изотерма поверхностного натяжения в растворах коллоидных неионогенных ПАВ
При концентрации ПАВ в водном растворе, незначительно превышающих ККМ, в растворе образуются сферические мицеллы (мицеллы Гартли). Внутренняя часть этих мицелл состоит из переплетающихся углеводородных радикалов, а наружная образована гидратированными полярными группами. Сферические мицеллы могут содержать от 20 до 100 и более молекул ПАВ. С увеличением концентрации ПАВ сферические мицеллы, взаимодействуя между собой, деформируются и принимают цилиндрическую, дискообразную или пластинчатую форму (рис. 3.37).
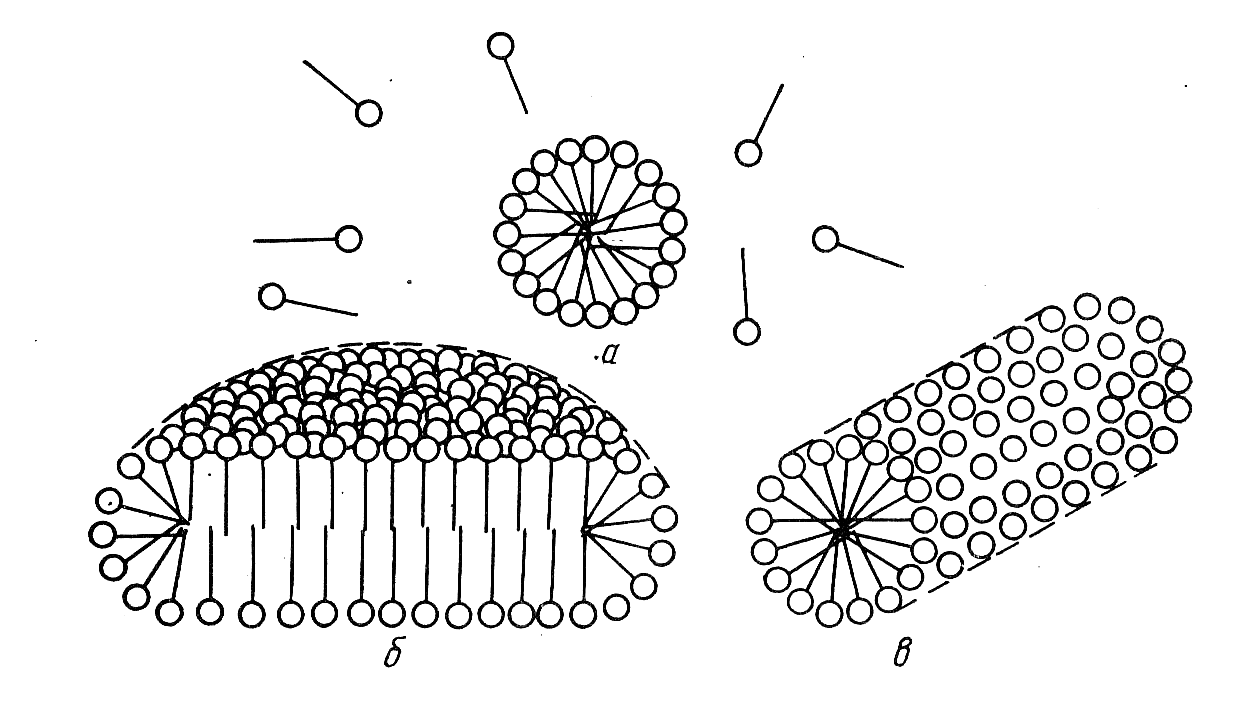
Рис. 3.37. Мицеллы коллоидных ПАВ: а– сферические;б– дискообразные;в– цилиндрические
При концентрациях, в 10–50 раз превышающих ККМ, молекулы ПАВ приобретают цепочечную ориентацию и могут образовывать жидкокристаллическую структуру. Последней стадией агрегации при дальнейшем увеличении концентрации ПАВ является образование геля и, в конце концов – твердого ПАВ.
В растворах коллоидных ПАВ количество вещества в мицеллярной форме во много раз превышает его количество в молекулярно-растворенном состоянии. Таким образом можно добиться большого содержания ПАВ в растворителе, несмотря на незначительную истинную растворимость ПАВ. Мицеллообразование в водных растворах характерно для ПАВ, в молекулах которых содержится более 8 атомов углерода.