
- •«Национальный исследовательский
- •Томский политехнический Университет»
- •Е.В. Михеева, н.П. Пикула, а.П. Асташкина
- •Коллоидная химия
- •Оглавление
- •Глава 1 дисперсные системы
- •1.1. Общая характеристика дисперсных систем
- •1.1.1. Признаки объектов коллоидной химии
- •1.1.2. Специфические особенности высокодисперсных систем
- •1.2. Классификации дисперсных систем
- •1.2.1. Классификация по размерам частиц дисперсной фазы
- •1.2.2. Классификация по агрегатному состоянию дисперсной фазы и дисперсионной среды
- •1.2.3. Классификация по силе межфазного взаимодействия дисперсной фазы и дисперсионной среды
- •1.2.4. Классификация по подвижности частиц дф (по структуре)
- •1.2.5. Классификация по фазовой различимости
- •1.2.6. Классификация по топографическому признаку (по форме частиц)
- •1.3. Методы получения дисперсных систем
- •1.3.1. Диспергационные методы
- •1.3.2. Конденсационные методы
- •1.3.2.1. Физические конденсационные методы
- •1.3.2.2. Химические конденсационные методы
- •2. Реакции обмена
- •3. Реакции окисления
- •1.3.3. Метод пептизации
- •1.4. Методы очистки дисперсных систем
- •Вопросыи задания для самоконтроля
- •Глава 2 термодинамика поверхностных явлений
- •2.1. Классификация поверхностных явлений
- •2.2. Свободная поверхностная энергия и поверхностное натяжение
- •2.2.1. Физический смысл поверхностного натяжения
- •2.2.2. Термодинамическое определение поверхностного натяжения
- •2.2.3. Единицы измерения поверхностного натяжения
- •2.3. Влияние различных факторов на величину поверхностного натяжения
- •2.3.1. Влияние химической природы вещества
- •2.3.2. Влияние температуры
- •2.3.3. Влияние природы граничащих фаз
- •2.3.4. Влияние природы и концентрации растворенного вещества
- •2.4. Межмолекулярные и межфазные взаимодействия
- •2.4.1. Когезия
- •2.4.2. Адгезия
- •2.4.3. Растекание одной жидкости по поверхности другой
- •2.4.4. Смачивание
- •2.4.4.1. Анализ уравнения Юнга
- •2.4.4.2. Флотация
- •2.5. Особенности искривленной поверхности раздела фаз
- •2.5.1. Уравнение Лапласа
- •2.5.2. Капиллярное давление. Течение жидкости в капиллярах
- •2.6. Методы определения поверхностного натяжения
- •2.6.1. Метод наибольшего давления пузырька газа (метод Ребиндера)
- •2.6.2. Сталагмометрический метод (метод счета капель)
- •2.6.3. Метод капиллярного поднятия жидкости
- •2.7. Влияние кривизны поверхности на давление насыщенного пара
- •2.7.1. Уравнения Томсона (Кельвина)
- •2.7.2. Капиллярная конденсация
- •2.7.3. Изотермическая перегонка
- •Вопросыи задания для самоконтроля
- •Глава 3 адсорбция
- •3.1. Основные понятия и определения
- •3.1.1. Количественные способы выражения величины адсорбции
- •3.1.2. Классификации адсорбции
- •1. Классификация по природе границы раздела
- •2. Классификация по типу взаимодействия адсорбата и адсорбента
- •3.1.3. Основные экспериментальные зависимости адсорбции
- •3.2.Адсорбция на границе твердое тело – газ
- •3.2.1. Теория мономолекулярной адсорбции Лэнгмюра
- •3.2.2. Эмпирическое уравнение адсорбции Фрейндлиха
- •3.2.3. Теория полимолекулярной адсорбции Поляни
- •3.2.4. Дальнейшие представления о многослойной адсорбции. Теория бэт
- •3.2.5. Адсорбция на пористых адсорбентах
- •3.2.6.Адсорбенты и их характеристики
- •3.3.Адсорбция на границе жидкость – газ
- •3.3.1. Фундаментальное уравнение адсорбции Гиббса
- •3.3.2. Свойства поверхностно-активных (пав) и поверхностно-инактивных (пив) веществ
- •3.3.3. Строение адсорбционного слоя на границе раствор–газ
- •3.3.4. Уравнение Шишковского
- •3.3.5. Поверхностная активность. Правило Дюкло – Траубе
- •3.3.6. Расчет гиббсовской адсорбции из изотермы поверхностного натяжения методом графического дифференцирования
- •3.3.7.Применение уравнения изотермы Лэнгмюра к адсорбции на границе жидкость–газ. Расчет молекулярных характеристик исследуемого пав
- •3.3.8. Мицеллообразование в растворах коллоидных пав
- •3.3.9. Классификации пав
- •3.3.10. Солюбилизация
- •3.3.11. Практическое значение пав
- •3.3.12. Проблемы биоразлагаемости промышленных пав
- •3.4.Адсорбция на границе твердое тело – раствор
- •3.4.1. Молекулярная адсорбция
- •3.4.2. Ионная адсорбция
- •3.4.3. Ионообменная адсорбция. Ионный обмен
- •Вопросыи задания для самоконтроля
- •Глава 4 электрические свойства дисперсных систем
- •4.1. Электрокинетические явления
- •4.1.1. Механизм образования двойного электрического слоя
- •1. Неравенство электрохимических потенциалов ионов в кристаллической решетке твердого тела и ионов в растворе
- •Адсорбционный механизм образования дэс
- •Механизм поверхностной диссоциации
- •2. Специфическая адсорбции ионов на поверхности твердой фазы
- •3. Ориентированная адсорбция поверхностно-активных веществ
- •4.2. Теории строения двойного электрического слоя
- •4.2.1. Экспериментальные факты, послужившие основой для создания теорий строения дэс
- •4.2.2. Теория строения дэс Гельмгольца – Перрена
- •4.2.3. Теория строения дэс Гуи – Чэпмена
- •4.2.4. Современная теория строения дэс Штерна
- •4.3. Электрокинетический потенциал
- •4.3.1. Определение электрокинетического потенциала из электрокинетических явлений
- •4.3.2. Практическое значение электрокинетических явлений
- •4.4. Строение коллоидных мицелл
- •4.4.1. Примеры мицелл гидрофобных золей в природе
- •Вопросы и задания для самоконтроля
- •Глава 5 устойчивость и коагуляция лиофобных дисперсных систем
- •5.1. Основные понятия и определения
- •5.1.1. Факторы агрегативной устойчивости лиофобных систем
- •5.2. Коагуляция
- •Стадии коагуляции
- •5.2.1. Кинетика коагуляции. Теория кинетики быстрой коагуляции Смолуховского
- •5.2.2. Коагуляция золей электролитами
- •Эмпирические правила электролитной коагуляции
- •5.3. Теория устойчивости лиофобных дисперсных систем длфо
- •5.3.1. Расклинивающее давление
- •Составляющие расклинивающего давления
- •5.3.2. Энергия электростатического отталкивания
- •5.3.3. Энергия молекулярного притяжения
- •5.3.4. Потенциальные кривые взаимодействия частиц
- •5.4. Закономерности коагуляции гидрофобных золей электролитами
- •5.4.1. Особые явления при коагуляции
- •Коагуляция смесью электролитов
- •5.4.2. Примеры коагуляции. Образование почв
- •5.4.3. Физико-химические методы очистки сточных вод
- •Вопросыи задания для самоконтроля
- •Глава 6 структурно-механические свойства дисперсных систем
- •6.1. Типы структур
- •6.2. Реологические свойства дисперсных систем
- •6.2.1. Вязкость жидких дисперсных систем
- •Вопросыи задания для самоконтроля
- •Глава 7 оптические свойства дисперсных систем
- •7.1. Рассеяние света в дисперсных системах
- •7.2. Поглощение света в дисперсных системах
- •7.3. Окраска дисперсных систем
- •Вопросыи задания для самоконтроля
- •Глава 8 молекулярно-кинетические свойства дисперсных систем
- •8.1. Осмос
- •8.2. Диффузия
- •8.3. Броуновское движение
- •8.4. Седиментационное равновесие
- •8.5. Седиментационный анализ
- •Вопросы и задания для самоконтроля
- •Глава 9 краткая характеристика основных дисперсных систем
- •9.1. Системы с жидкой дисперсионной средой
- •9.1.1. Суспензии и золи
- •Классификация суспензий
- •Получение суспензий
- •Значение суспензий
- •9.1.2. Эмульсии
- •Классификация эмульсий
- •Агрегативная устойчивость эмульсии и природа эмульгатора
- •9.1.3. Пены
- •9.2. Системы с газообразной дисперсионной средой
- •9.2.1. Аэрозоли
- •Классификации аэрозолей
- •Агрегативная устойчивость аэрозолей. Коагуляция
- •Методы разрушения аэрозолей
- •9.3. Системы с твердой дисперсионной средой
- •Вопросыи задания для самоконтроля
- •Перечень используемой литературы
- •Коллоидная химия
- •В авторской редакции
- •Отпечатано в Издательстве тпу в полном соответствии с качеством предоставленного оригинал-макета
2.4.4. Смачивание
Смачивание – взаимодействие жидкости с твердым или другим жидким телом при наличии одновременного контакта трех несмешивающихся фаз, одна из которых обычно является газом (воздух).
При нанесении небольшого количества жидкости на поверхность твердого тела или на поверхность другой жидкости, имеющей большую плотность, возможно два случая: в первом случае жидкость приобретает форму капли, в другом случае растекается. Рассмотрим первый процесс, когда капля не растекается по поверхности другого тела (рис. 2.4).

Рис. 2.4. Смачивание на границе раздела трех фаз
Рассмотрим каплю жидкости на поверхности твердого тела в условиях равновесия. Так как поверхностное натяжение можно рассматривать как энергию, приходящуюся на единицу площади, или как силу, действующую на единицу длины, то все рассмотренные составляющие поверхностной энергии можно выразить с помощью векторов сил.
На единицу длины периметра действуют три силы:
1. Поверхностная энергия твердого тела, стремясь уменьшиться, растягивает каплю по поверхности. Эта энергия равна поверхностному натяжению твердого тела на границе с воздухом σТГ.
2. Поверхностная энергия на границе твердого тела с жидкостью σТЖ стремится сжать каплю, т.е. поверхностная энергия уменьшается за счет снижения площади поверхности.
3. Поверхностная энергия на границе капли жидкости с воздухом σЖГ направлена по касательной к сферической поверхности капли.
Угол θ, образованный касательными к межфазным поверхностям, ограничивающим смачиваемую жидкость, и имеющий вершину на линии раздела трех фаз, называется краевым углом или углом смачивания.
Проекция вектора σЖГ на горизонтальную ось – произведение σЖГ · cos θ.
В условии равновесия:
σТГ = σТЖ + σЖГ·cosθ, (2.14)
отсюда
 . (2.15)
. (2.15)
Полученное соотношение (2.15) называют уравнением Юнга.
2.4.4.1. Анализ уравнения Юнга
1. Если σТГ > σТЖ, то cos θ > 0 и θ < 90° (краевой угол смачивания) острый – смачивание.
Пример: вода на поверхности металла, покрытого оксидной пленкой. Чем меньше угол θ и больше cos θ, тем лучше смачивание.
2. Если σТГ < σТЖ, то cos θ < 0 и θ > 90° (краевой угол смачивания тупой) – несмачивание.
Пример: вода на парафине или тефлоне.
3. Если σТГ = σТЖ, то cos θ = 0 и θ = 90° – граница между смачиваемостью и несмачиваемостью.
4.
Если
![]() ,
тоcos
θ = 1 и θ = 0° – полное
смачивание (растекание)
– капля
растекается в тонкую пленку.
,
тоcos
θ = 1 и θ = 0° – полное
смачивание (растекание)
– капля
растекается в тонкую пленку.
Пример: ртуть на поверхности свинца, очищенного от оксидной пленки.

Рис. 2.5. Несмачивание
Полного несмачивания, т.е. такого положения, когда θ = 180°, не наблюдается, т.к. при соприкосновении конденсированных тел поверхностная энергия всегда уменьшается.
Смачиваемость водой некоторых твердых тел характеризуется следующими краевыми углами: кварц – 0°, малахит – 17°, графит – 55°, парафин – 106°. Хуже всего смачивается водой тефлон, краевой угол смачивания – 120°.
Различные жидкости неодинаково смачивают одну и ту же поверхность. Согласно приближенному правилу – лучше смачивает поверхность та жидкость, которая ближе по полярности к смачиваемому веществу.
По виду избирательного смачивания все твердые тела делят на три группы:
Гидрофильные (олеофобные) материалы – лучше смачиваются водой, чем неполярными углеводородами: кварц, силикаты, карбонаты, оксиды и гидроксиды металлов, минералы (краевой угол меньше 90° со стороны воды).
Гидрофобные (олеофильные) материалы – лучше смачиваются неполярными жидкостями, чем водой: графит, уголь, сера, парафин, тефлон.
Таблица 2.3
Зависимость свойств поверхности от краевого угла смачивания
|
θ |
cos θ |
Процесс |
Поверхность |
|
θ = 0° |
cos θ = 1 |
Растекание |
Гидрофильная (олеофобная) |
|
θ < 90° |
cos θ > 0 |
Смачивание |
Гидрофильная (олеофобная) |
|
θ = 90° |
cos θ = 0 |
Граница между смачиваемостью и несмачиваемостью |
|
|
θ > 90° |
cos θ < 0 |
Несмачивание |
Олеофильные (гидрофобные) |
Получим зависимость между краевым углом смачивания и работой адгезии. Для этого заменим числитель в уравнении Юнга через работу адгезии из уравнения Дюпре (2.12):
 .
(2.16)
.
(2.16)
Уравнение (2.16) показывает, что краевой угол определяется конкуренцией двух факторов. Первый фактор – молекулярное притяжение жидкости к твердой поверхности: чем сильнее это притяжение, тем больше работа адгезии. Второй фактор – взаимное притяжение молекул жидкости, количественной мерой которого является поверхностное натяжение.
Из уравнения (2.16) следует, что при преобладании притяжения жидкости к твердой подложке (при WA > σЖГ), cos θ > 0, жидкость смачивает поверхность. Напротив, если сильнее взаимное притяжение молекул жидкости (σЖГ > WA) , то cos θ < 0, случай несмачивания. Следовательно, жидкости с небольшим поверхностным натяжением лучше смачивают твердые тела, чем жидкости с небольшим поверхностным натяжением. Многие органические жидкости и сжиженные газы полностью смачивают большинство твердых материалов.
Пример 2.1. Рассчитайте коэффициент растекания жидкости СН2J2 по полиэтилену. Объясните знак коэффициента растекания.
![]() ,
θ = 46°.
,
θ = 46°.
Решение:
1. Рассчитаем работу когезии растекающейся жидкости по уравнению (2.11):
![]() .
.
2. Рассчитаем работу адгезии между СН2J2 и полиэтиленом, используя уравнение (2.16):
 ,
,
следовательно,
![]() .
.
Так
как
![]() ,
то
,
то ,отсюда
,отсюда
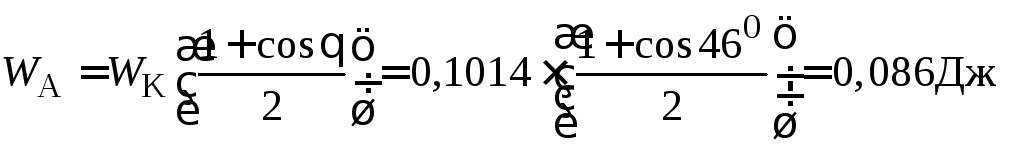 .
.
3. Рассчитаем коэффициент растекания по уравнению (2.13):
![]() ,
,
следовательно, СН2J2 по полиэтилену не растекается.
Рассмотренные закономерности смачивания выполняются на всех поверхностях жидкостей и только на идеально гладких поверхностях твердых тел. На поверхностях реальных твердых тел обязательно имеются шероховатости, неоднородности, поры, трещины и т.д. Основное следствие шероховатости – площадь такой поверхности (Sш) больше, чем площадь гладкой подложки (S0). Отношение Sш/S0 = К называют коэффициентом шероховатости К > 0.
Влияние шероховатости на краевой угол описывается уравнением Венцеля – Дерягина:
![]() . (2.17)
. (2.17)
Из уравнения (2.17) следует, что для смачивающих жидкостей (cosθ > 0) шероховатость приводит к уменьшению краевых углов (cos θш > cos θ). В случае несмачивания шероховатость вызывает увеличение краевых углов (cosθш < cosθ). Таким образом, на гидрофильных поверхностях шероховатость улучшает смачивание, на гидрофобных – ухудшает. Пример: ворсинки на перьях водоплавающих птиц значительно увеличивают шероховатость их поверхности, это способствует тому, что перья практически не смачиваются водой.
Смачиваемость частиц пыли водой оказывает влияние на эффективность мокрых пылеуловителей, особенно при работе с рециркуляцией. Гладкие частицы пыли смачиваются лучше, чем частицы с неровной поверхностью, т.к. последние в большой степени оказываются покрытыми адсорбированной газовой оболочкой, затрудняющей смачивание.
Пример 2.2. Определите краевой угол смачивания, образованный каплей воды на твердом теле, если поверхностное натяжение на границе воздух–твердое тело, вода–твердое тело и вода–воздух соответственно равны: 0,057; 0,020; 0,074 Дж/м2. Будет ли вода смачивать данную поверхность?
Решение:
По
закону Юнга:
 .
.
cos θ < 0 и θ > 90° – данная поверхность водой не смачивается.
