
Лекции по физике (1 семестр) / Сем1_ст_Лекция 10
.docЛЕКЦИЯ № 10
Раздел III. Молекулярная физика и термодинамика
– молекулярная (статистическая) физика;
– термодинамика.
Основные положения молекулярно-кинетической теории (МКТ):
1) все вещества состоят из частиц (молекулы, атомы, ионы);
2) все частицы участвуют в непрерывном хаотическом (броуновском) движении;
3) частицы взаимодействуют друг с другом.
Демонстрация №15. Модель Броуновского движения.
1. Термодинамические параметры.
Основное уравнение МКТ
-
Объем V – область пространства, занимаемая системой частиц.
[V] = м3 (см3, мм3, …), 1 л = 1 дм3 = 103 м3.
-
Давление Р – силовая характеристика, оно численно равно отношению силы нормального давления, действующей на поверхность со стороны частиц системы в результате столкновения их с поверхностью, к площади этой поверхности:
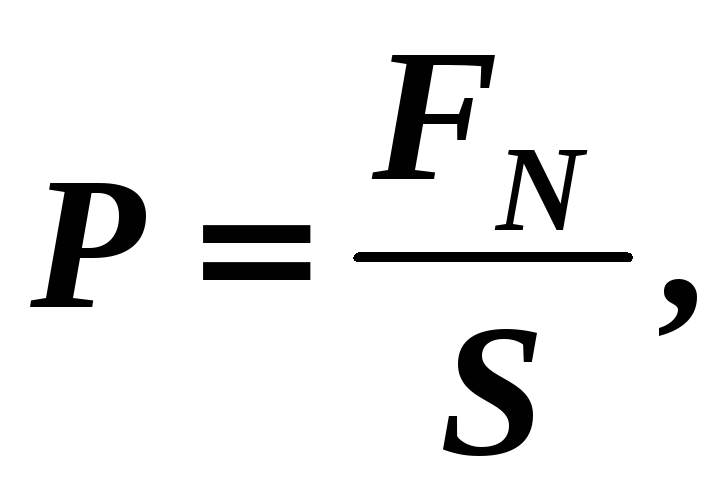 [P] =
Па.
[P] =
Па.
1 мм. рт. ст = 1 торр = 133 Па
1 атм = 1 бар = 760 мм рт. ст. = 105 Па
1 кГс/м2 = 9,8 Па манометр
барометр
При абсолютно упругом столкновении с поверхностью каждая частица передает ей двойной импульс.
Суммируя все переданные поверхности импульсы можно получить следующее уравнение для давления:
 (10-1)
(10-1)
где m0 – масса одной частицы, кг;
 – концентрация
частиц – количество частиц N
в
единице объема V,
м3;
– концентрация
частиц – количество частиц N
в
единице объема V,
м3;
![]() среднее значение
квадрата скорости частицы, м2/с2.
среднее значение
квадрата скорости частицы, м2/с2.
Уравнение (10-1) называют основным уравнением МКТ.
Вывод основного уравнения МКТ.



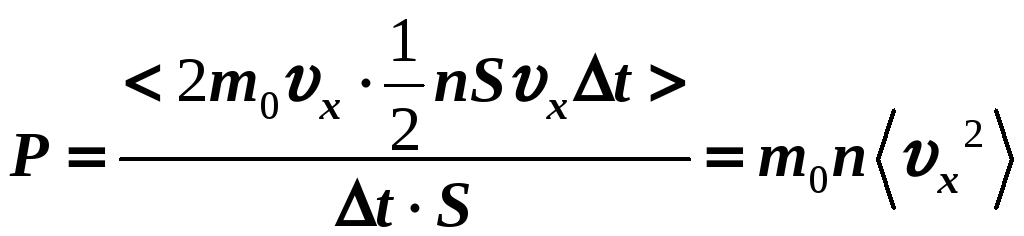
![]() и
и

тогда

основное уравнение МКТ.
Так как
 плотность вещества, кг/м3,
тогда
плотность вещества, кг/м3,
тогда
 .
(10-2)
.
(10-2)
И еще, зная, что
 средняя кинетическая энергия части-цы,
получим
средняя кинетическая энергия части-цы,
получим
 или
или
 (10-3)
(10-3)
3) Абсолютная температура Т.
Исторически: при нагревании все вещества расширяются, при охлаждении – сжимаются. Степень нагретости тела термометр температура t.
термометр Цельсия tC
0C – точка плавления льда,
100C – точка кипения воды;
термометр Фаренгейта tF
0F – точка замерзания смеси воды, льда и нашатыря или поваренной соли,
32F – точка плавления льда,
212F – точка кипения воды.
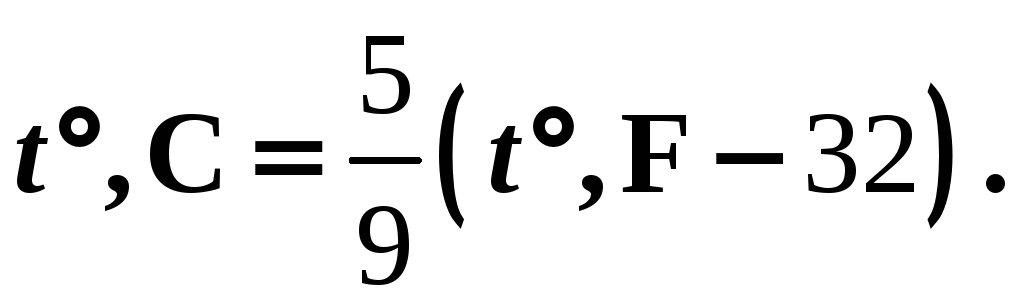
Томсон (Кельвин) предложил использовать газовый термометр со шкалой, имеющей абсолютный ноль.
 если
если
![]()
Тогда

н о,
если Р
0 при V
= const,
о,
если Р
0 при V
= const,
или, если V 0 при Р = const,
Т. о. абсолютный ноль температуры – это такая температура, при которой давление газа (объем) стремится к нулю при фиксированном объеме (давлении).
Но из (10-3) следует
 ,
тогда
,
тогда![]()
 (10-4)
(10-4)
где
![]()
число степеней свободы частицы.
число степеней свободы частицы.

![]() …
…
![]() Дж/К – постоянная
Больцмана.
Дж/К – постоянная
Больцмана.
Т. о. абсолютная температура Т – это энергетическая характеристика системы частиц, т.к. она пропорциональна средней кинетической энергии теплового движения частиц.
При Т
0 ![]()
0 (в классической физике), т. е. при
абсолютном нуле по шкале Кельвина Т
= 0 K
– это такая температура,
при которой
0 (в классической физике), т. е. при
абсолютном нуле по шкале Кельвина Т
= 0 K
– это такая температура,
при которой
![]() =
0.
=
0.
[T] = K, T, K = t,C + 273.
4) Энтропия S – количественная мера упорядоченности системы частиц.
H
[S]
= Дж/К
лед вода пар
S1 < S2 < S3
2. Идеальный газ.
Уравнение состояния идеального газа
Идеальный газ – газ, состоящий из молекул, размерами которых можно пренебречь по сравнению с расстоянием до других молекул, и для которых потенциальная энергия взаимодействия между молекулами во много раз меньше их кинетической энергии теплового движения (т. е. частицы такого газа – это материальные точки, участвующие только в упругих столкновениях между собой и со стенками сосуда).
Для м.т. i = iпост = 3, тогда из (10-3) и (10-4) имеем:
![]() или
или
![]() (10-5)
(10-5)
Наряду с массой используют понятие количества вещества .
[] = моль.
1 моль вещества – это такое количество любого вещества, в котором содержится 6,021023 молекул.
NA = 6,021023 моль1 число Авогадро.
М – молярная масса вещества = масса 1 моля вещества.
[M] = кг/моль.
Количество вещества :
 (10-6)
(10-6)
где N – количество частиц в веществе;
m – масса вещества.
Тогда для 1 моля
газа
 универсальная
газовая постоянная и из (10-5) получим:
универсальная
газовая постоянная и из (10-5) получим:
PV = RT,
а для любого количества вещества

получим
 (10-7)
(10-7)
– уравнение состояния идеального газа уравнение Клапейрона-Менделеева.
Так как
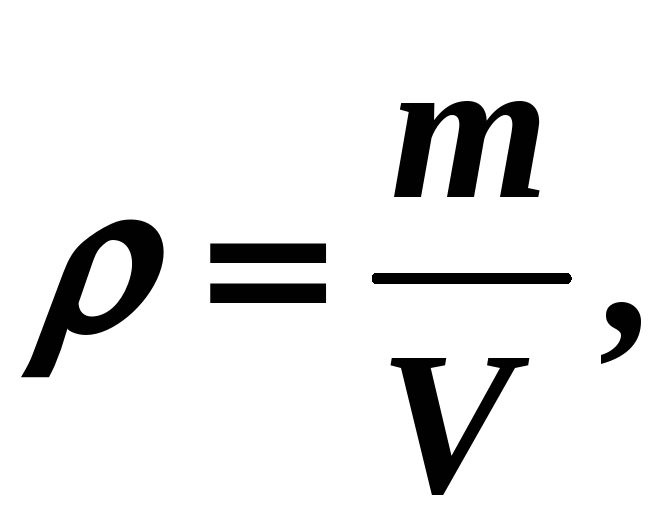 тогда
тогда
 (10-8)
(10-8)
Нормальные условия (Н.У.):
Р = 1 атм. = 760 мм рт.ст. = 105 Па,
t = 0C, Т = 273 К.
Тогда из (10-5)
n = 2,681025 м3 число Лошмидта
(для любого газа).
При Н.У. 1 моль любого газа занимает одинаковый объем
V = 22,4 л.
Масса одной молекулы
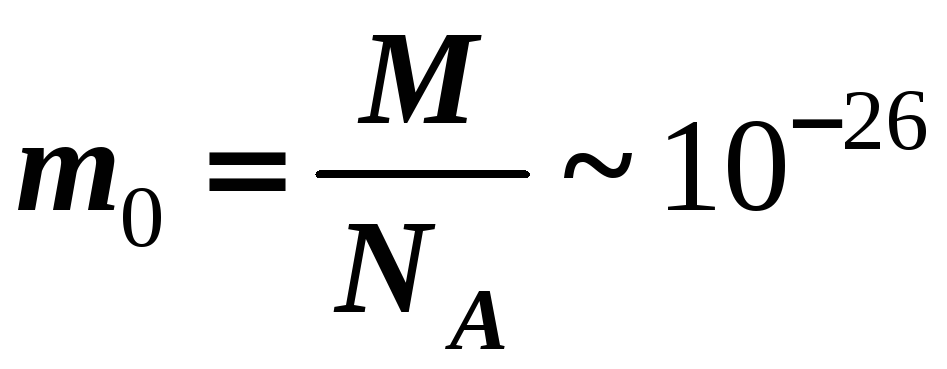 кг.
кг.
3. Изопроцессы
– равновесное состояние
– равновесный процесс
– изопроцессы
1) V = const – изохорный процесс P ~ T
 уравнение
изохорного процесса.
уравнение
изохорного процесса.

2) Р = const – изобарный процесс V ~ T

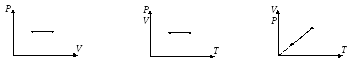 уравнение
изобарного процесса.
уравнение
изобарного процесса.
3) T = const – изотермический процесс PV = const
![]() уравнение
изотермического процесса.
уравнение
изотермического процесса.

Уравнение состояния идеального газа

– газовые законы Шарля, Гей-Люссака и Бойля-Мариотта.
– круговой процесс
(замкнутый цикл)
круговой процесс
(замкнутый цикл)
Если в каком-то
объеме находится смесь газов, то каждый
из газов произведет на стенки свое
отдельное давление, которое называют
парциальным
давлением
![]() .
.

![]()
![]()
![]()
![]()

![]()
![]()
![]()
Закон Дальтона.
![]() (10-9)
(10-9)
общее давление в смеси газов равно сумме парциальных давлений отдельных газов.


![]()
![]()
![]()
