
3_Skorost_reaktsy
.doc
ПЕРВОЕ ВЫСШЕЕ ТЕХНИЧЕСКОЕ УЧЕБНОЕ ЗАВЕДЕНИЕ РОССИИ

МИНИСТЕРСТВО ОБРАЗОВАНИЯ И НАУКИ РОССИЙСКОЙ ФЕДЕРАЦИИ
Федеральное государственное бюджетное образовательное учреждение высшего профессионального образования
«НАЦИОНАЛЬНЫЙ МИНЕРАЛЬНО-СЫРЬЕВОЙ УНИВЕРСИТЕТ «ГОРНЫЙ»
ЛАБОРАТОРНАЯ РАБОТА № 3
По дисциплине: Общая и неорганическая химия
(наименование учебной дисциплины согласно учебному плану)
Тема: Исследование скорости химических реакций и химического равновесия.
Автор:студент гр. ЭРС-14-1 /Бабырь.К.В/
(подпись)
(Ф.И.О)
ОЦЕНКА:
Дата:
ПРОВЕРИЛ Доцент /Лобачева. О.Л/
(должность) (подпись) (Ф.И.О)
Санкт-Петербург
2014
Цель работы: изучить зависимость скорости реакции от концентрации реагентов и температуры, а также ознакомиться с влиянием концентрации реагентов на химическое равновесие.
-
Порядок выполнения работы
Опыт №1. Влияние концентрации тиосульфаты натрия на скорость его разложения в кислой среде.
Табл. 1. Зависимость времени реакции от количества тиосульфата натрия.
-
Номер пробирки
С(Na2S2O3)
Время реакции t, с
1
1 (4)
117
2
2 (8/4)
49
3
3 (12/4)
37
Табл. 2. Результаты опыта.
-
№ пробирки
Концентрация
Na2S2O3
lnCотн
(Ci/C1)
Время реакции,τ, с
Скорость реакции, с-1
1
C1
0
117
8,5 . 10-3
2
2C1
0,693
49
20,4 . 10-3
3
3C1
1,10
37
27,1 . 10-3
Найдем значения скорости реакции:
![]()
![]()
![]()
1. График зависимости скорости реакции от концентрации тиосульфата натрия.
![]()
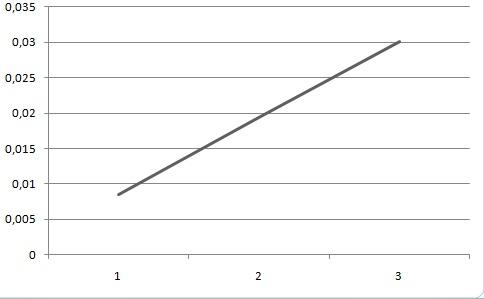
2. График зависимости логарифма относительной концентрации от времени протекания реакции.
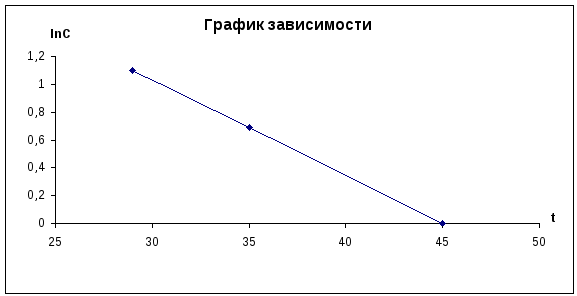
Опыт №2. Влияние температуры на скорость реакции разложения тиосульфата натрия в кислой среде.
-
№ пробирки
Число капель
Температура, С0
Время реакции,τ, с
Скорость реакции, с-1
Na2S2O3
H2SO4
1
10
10
5
180
0,006
2
10
10
15
100
0,01
3
10
10
25
60
0,02
При обработке результатов эксперимента воспользуемся правилом Вант-Гоффа:
При увеличении температуры на 10 K скорость химических реакций возрастает в 2 – 4 раза.
![]() ,
,
где γ – температурный коэффициент скорости реакции.
![]()
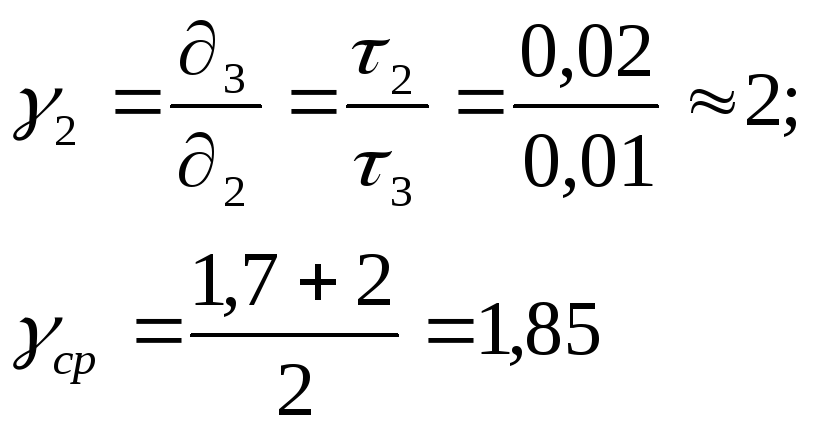
Путем проведения опыта было подтверждено эмпирическое правило Вант-Гоффа, только с незначительной погрешностью.
Теперь вычислим энергию активации реакции:
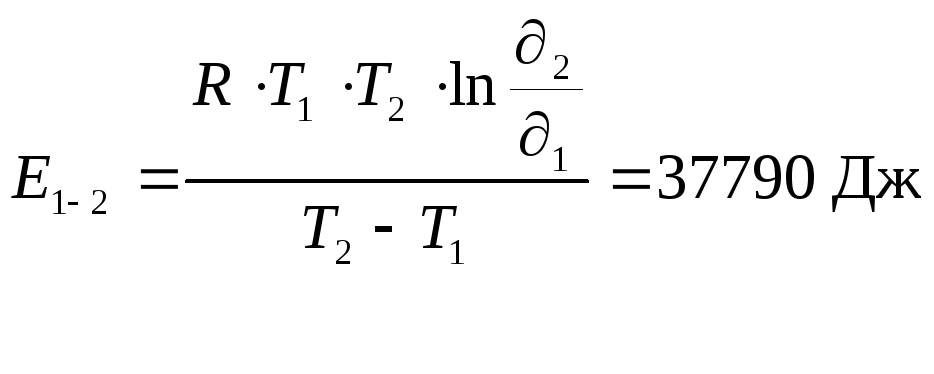
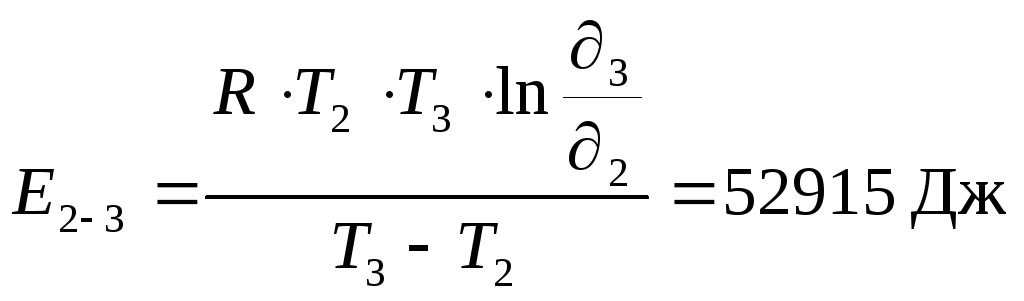
где R = 8,31 Дж/моль.K,
T – температура в K,
![]() i
= скорость химической реакции.
i
= скорость химической реакции.
Опыт №3. Влияние концентраций реагентов на равновесие обратимой реакции между хлоридом железа (III) и тиоцианатом аммония.
FeCl3 + 3NH4CNS = Fe(CNS)3 + 3NH4Cl
Налили в химический стаканчик по 5 мл 0,0025 н. Растворов хлорида железа (III) и тиоцианата аммония, перемешали и разлили в 4 пробирки.
-
Без добавок реакция прошла плавно и получился продукт оранжевой окраски.
-
Здесь мы добавили FeCl3 (конц.), продукт окрасился в темно-оранжевый цвет; химическое равновесие сместилось вправо.
-
После добавления NH4CNS (конц.) продукт окрасился в темно-красный цвет; химическое равновесие сместилось вправо.
-
Затем добавили NH4Cl, продукт окрасился в соломенный цвет, а химическое равновесие сместилось влево.
-
Выводы:
Проделав ряд экспериментов, мы можем сделать некоторые выводы. Из опыта №1 следует, что при увеличении концентрации тиосульфата натрия скорость его разложения в кислой среде возрастает. Эта прямо-пропорциональная зависимость отражена в графике зависимости скорости реакции от концентрации реагента.
В опыте №2 мы подтвердили правило Вант-Гоффа, и выяснили, что с повышением температуры возрастает скорость химических реакций, т. к. увеличивается число активных молекул, способных к химическому взаимодействию. Эта зависимость скорости хим. реакций от температуры прямо-пропорциональная.
В опыте №3 мы убедились, что концентрация реагирующих веществ влияет на химическое равновесие следующим образом:
-
если увеличить концентрацию реагентов, то хим. равновесие будет смещаться вправо;
-
если увеличить концентрацию продуктов реакции, то хим. равновесие сместиться влево.
-
№ пробирки
Число капель
Na2S2O3
H2O
H2SO4
Всего
1
4
8
1
13
2
8
4
1
13
3
12
-
1
13
![]()
-
Общие теоретические сведения
Средняя скорость реакции равна изменению молярной концентрации реагента в единицу времени при постоянстве объема системы. Единица измерения в СИ: моль/м3.c.
Скорость реакции пропорциональна числу столкновений между молекулами реагентов, которое определяется произведением их концентраций. Если в акте реакции участвуют несколько молекул одного из реагентов, то его концентрацию надо перемножить соответствующее количество раз, то есть возвести в степень. Для одностадийной реакции типа
![]()
скорость будет равна
![]() ,
,
где [A] и [B]
– молярные концентрации реагентов, k
– коэффициент пропорциональности,
называемый константой скорости реакции.
Константа скорости не зависит от времени
протекания реакции и концентрации
реагентов, но зависит от природы
участников реакции, температуры и
присутствия катализаторов. Если реакция
протекает в несколько стадий, то значения
![]() равны
стехиометрическим коэффициентам в
уравнении самой медленной стадии
реакции, лимитирующей скорость всего
процесса. Их называют частными порядками
реакции по данным реагентам. Общий
порядок реакции равен сумме частных
порядков:
равны
стехиометрическим коэффициентам в
уравнении самой медленной стадии
реакции, лимитирующей скорость всего
процесса. Их называют частными порядками
реакции по данным реагентам. Общий
порядок реакции равен сумме частных
порядков:
![]()
Табл.2 Зависимость времени реакции от температуры.
-
Номер пробирки
С(Na2S2O3)
Время реакции t, с
1
1 (4)
117
2
2 (8/4)
49
3
3 (12/4)
37
