
Методичка Орлинсон
.pdf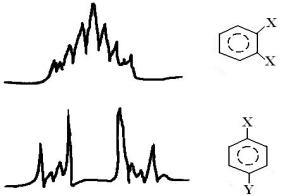
Рисунок 3.11 - Спектры ПMP орто- и пара-замещенных бензолов
3.3Спектроскопия магнитного резонанса ядер
Внастоящее время наряду с изучением ПМР-спектров органических соединений, широко проводятся исследования ЯМР-спектров ядер l3C, I9F, 31Р. Для химических сдвигов соответствующих сигналов в этих спектрах
существуют общие закономерности, что и ПМР-спектрах, однако на величины химических сдвигов существенное влияние оказывает более насыщенное электронное окружение, что приводит к повышению на порядок и больше величин химических сдвигов протонов.
3.3.1 13С-спектроскопия
Для наблюдения ЯМР на ядрах 13С используется специальная техника (с учетом того, что содержание изотопа 13С в природном углероде составляет 1,108 %): многократное прохождение сигнала (накопление), импульсная техника с Фурье-преобразователем. В качестве эталона для определения химических сдвигов здесь также обычно используется тетраметилсилан, сигнал которого принимается за 0. Интервал химических сдвигов 13С достигает порядка 500 м.д. спектры имеют более высокое разрешение в сравнении со спектрами ПМР, а также просты.
Спин-спиновое взаимодействие между ядрами 13С-13С в спектре не проявляется вследствие малой вероятности нахождения их в одной молекуле, а между ядрами 13С - 1Н наблюдается как в протонных спектрах, так и в спектрах 13С. В спектре 13С это взаимодействие подавляют гетероядерным двойным резонансом на протонах. Величины констант спин-спинового взаимодействия 13С - 1Н также существенно больше IН-Н, так I13С - 1Н ≈100 Гц.
60
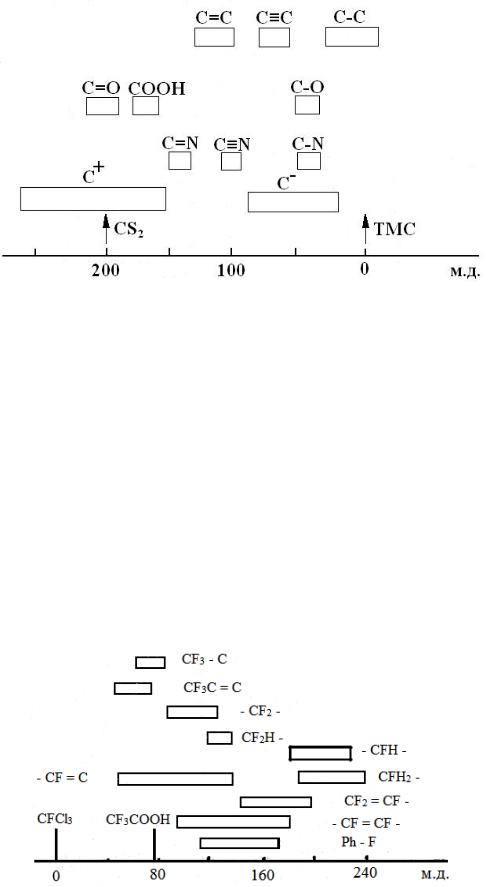
Рисунок 3.12 - Диаграмма химических сдвигов
3.3.2 19F – спектроскопия
При проведении спектроскопии ЯМР на ядре 19F в качестве эталона обычно используют ССl3F, положение сигнала которого принимают за 0. Величины химических сдвигов относительно нулевого сигнала смещены в сторону сильных полей. Их диапазон достигает значений 200 м.д. Константы I19 F-1H обычно больше по величине, чем Iн-н, и могут значительно отличаться. Так, для соединения ClCF2”’-CF 2”- CH 2F’ константы I H-F’=4.9
Гц, I H-F’’ =11.8 Гц, I H-F’’’ = 1 Гц.
Для соединения СН2=СF2
I F-F = 84, 7 Гц, I H-Fтранс = 52,4 Гц, I H-Fцис =20,1 Гц.
На рисунке 3.13 приведена диаграмма химических сдвигов.
Таким образом, спектры ЯМР - 19F широко используют для определения структуры фторсодержащих органических соединений.
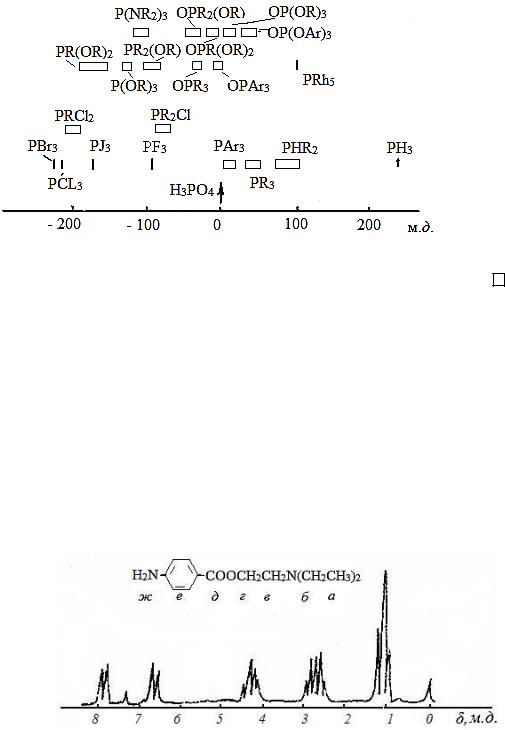
Рисунок 3.13 - Диаграмма химических сдвигов 19F
3.3.3 31Р – спектроскопия
61
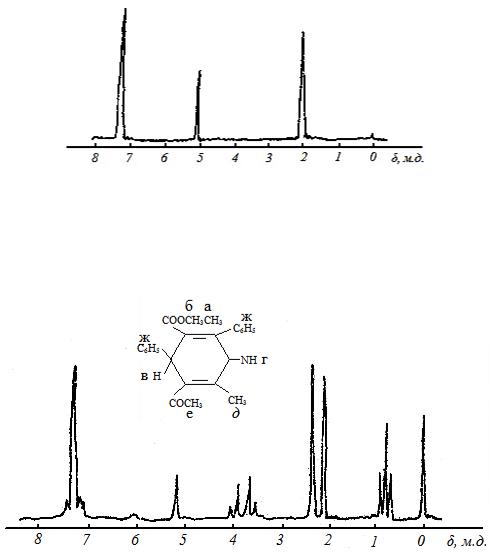
Спектры ЯМР - 3Р обычно снимаются в присутствии этанола 85% вязкого раствора Н3РО4. Сигналы различных фосфорорганических соединений имеют как положительные, так и отрицательные химические сдвиги в интервале до 500 м.д.
Рисунок 3.14 - Диаграмма химических сдвигов 31Р |
|
||
Вследствие спин-спинового взаимодействия ядер 31Р – |
Н в спектрах |
||
наблюдаются |
интенсивные |
мультиплеты. |
Константы |
I 31 P −31P ≈ 400 − 450 Гц, I 31 P −31Н значительно изменяются в зависимости от
валентного состояния атомов фосфора. Так, IH-P = 150-200 Гц, IH-P=O = 500700 Гц.
3.4Примеры
3.4.1.Сопоставьте спектр ПМР со структурой соединений:
а) n − H2 N − C6 H4COOCH2 N (C2 H5 )2 (рисунок 3.15).
Рисунок 3.15 - Спектр ПМР ( к примеру, 3.4.1 а)
В данном соединении имеется семь групп эквивалентных протонов. По таблице химических сдвигов этих протонов находим δ , м.д.:
62
а – 0,9 - 1,1; б – 2,3 – 3,2; в – 2,3 – 3,2; г – 3,9 – 4,3; д – 7,5; е – 6,5; ж –
4 – 8.
Реально сигналы (δ , м.д.):
а – 1,05 ( триплет за счет взаимодействия с СН2 - группой); б и в – квадруплет протонов (2,62) накладывается на триплет протонов в (2,82); г
– 4,33 триплет, искаженный за счет наложения сигнала протонов аминогруппы (δ =4,13 м.д.); д и е – 7,83; 6,63 – ароматические протоны паразамещенного бензола.
б) С6Н5СН2ООССН3 (рисунок 3.16.)
Рисунок 3.16 - Спектр ПМР (к примеру, 3.4.1 б)
С6Н5СН2ООССН3 в б а
δ , м.д.: а – 2,06 ( синглет); б – 5,08 ( синглет); в – 7, 31 ( синглет)
в)
Рисунок 3.17 - Спектр ПМР (к примеру, 3.4.1 в)
δ, м.д.: а – 0,83 ( триплет); б – 3,87 ( квадруплет);
в– 5,13 ( синглет); г – 6,15 ( шир.); д – 2,37 ( синглет);
е – 2,17 ( синглет); ж – 7,3 ( мультиплет).
3.4.2. На рисунке 3.18 приведен спектр одного из изомеров С3Н6Br=COOH. Какой это изомер?
63
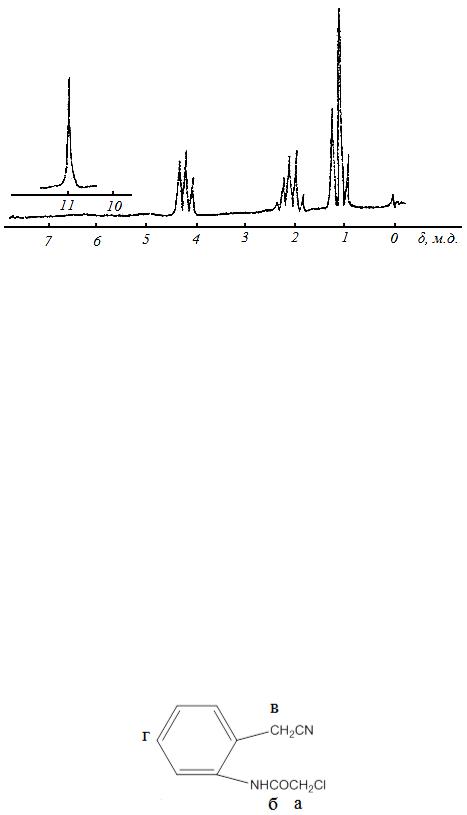
Рисунок 3.18 - Спектр ПМР( к примеру, 3.4.2
Сигнал 1,08 м.д. может соответствовать группе СН3, расщепление этого сигнала в триплет обусловлено соседней группой СН2. Следователь-
но, структура |
данного |
изомера – это λ - броммасляная кислота: |
|
СН3СН2СН(Br)COOH |
|
||
3.4.3. Какой ПМР – |
спектр можно ожидать для соединений: |
||
а) (СН3СН2О)3СН |
|
||
а б |
|
в |
|
δ , м.д.: а – 1,1-1,3 ( триплет); б – 2,3-2,6 ( квадрулет); в – 5, 3 |
|||
(синглет); |
|
|
|
б) СН3СООСН2СН3 |
|||
в |
б |
а |
|
δ , м.д.: а – 1,1-1,3 ( триплет); б – 3,9-4,3 ( квадрулет); в – 1,9-2,2 ( синг- |
|||
лет); |
|
|
|
в) (СН3)2СНСН2Br |
|
||
а |
б |
в |
|
δ , м.д.: а – 1,1-1,3 ( дуплет); б – 1,7-1,8 ( мультиплет); в – 3,2-3,6 ( ду-
плет); г)
δ , м.д.: а – 4,3 ( синглет); б – положение предсказать сложно; в – 3,7 (синглет); г – 7;
д) С6Н5-СН2-S-СН2СООН в б а г
δ , м.д.: а – 3,4 ( синглет); б – 3,7 ( синглет); в – 7; г – 10-11;
64
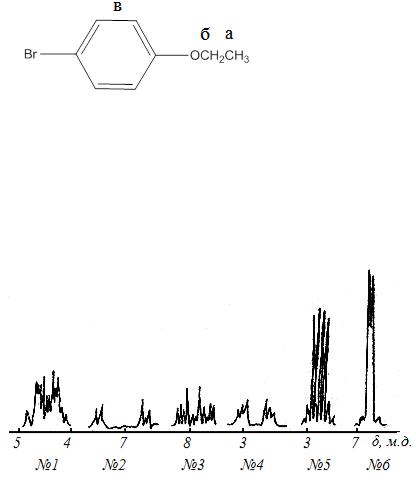
е) δ , м.д.: а – 1,9-2,2 ( синглет); б – 2,0-2,4 ( триплет); в – 3,3-3,4 ( три-
δ , м.д.: а – 1,9-2,2 ( синглет); б – 2,0-2,4 ( триплет); в – 3,3-3,4 ( три-
плет); г – 2,8-3,1 ( синглет);
ж)
δ , м.д.: а – 1,1-1,3 ( триплет); б – 3,9-3,4 ( квадруплет); в – 7.
3.4.4. Определить к какому типу протонов принадлежат спектры ПМР, приведенные на рисунке 3.19 (1-6). Идентифицируйте системы парадизамещенного бензола, алифатические группы, симметрично ортозамещенный бензол.
Рисунок 3.19 - Спектры ПМР к примеру 3.4.4
№№2,3 и 6 – ароматические протоны;
№№1,4 и 5 – алифатические протоны; п– дизамещенный бензол № 2;
СН2-СН2 – группа – № 4; симм-орто-бензол – № 6.
65
ГЛАВА 4 МАСС-СПЕКТРОМЕТРИЯ
Это один из наиболее чувствительных методов анализа, применяемых для исследования органических соединений. Часто применяется в комбинации с хроматографией. Для успешной интерпретации масс-спектров органических соединений требуется значение как общих, так и частных масс-спектральных характеристик различных классов этих соединений.
В основе масс-спектроскопии лежит способность органических молекул ионизироваться. Ионизация может происходить под действием электронного удара (ЭУ), интенсивного - коротковолнового излучения, при столкновении молекулы с возбужденными атомами и ионами или в сильном электрическом поле. Наиболее распространен метод ионизации электронами (ЭУ). Под действием потока электронов с энергией порядка 70 эВ за 10-15- 10-17 с происходит ионизация молекулы анализируемого вещества и образование ион-радикала М+:
М + ё + М+ + 2ё.
Если избыток внутренней энергии в М+ достаточен для разрыва межатомных связей, то происходит его распад с образованием осколочный ионов и нейтральных частиц.
4.1 Типы ионов, регистрируемых в масс-спектрах
Молекулярные ионы, имеющие время жизни более 10-5 с регистрируются в масс-спектре в виде сигнала, имеющим определенное массовое число (m/z) - отношение массы к заряду, равное молекулярной массе соединения. Интенсивность сигналов в масс-спектре зависит от стабильности М+ для соединений, имеющих сопряженные π -электронные системы. Массовое число пика М+ в масс-спектрах имеет цельночисленное значение, поэтому можно определить лишь молекулярную массу соединения в расчете на наиболее распространенные изотопы, входящие в молекулу элементов.
Образующийся в результате электронного удара молекулярный ион может подвергнуться дальнейшему распаду с образованием положительных ионов и радикалов, ион-радикалов и нейтральных молекул. Кроме разрыва отдельных связей, могут протекать внутримолекулярные перегруппировки.
Общую схему образования осколочных частиц из молекулы АВСД можно представить следующим образом:
66
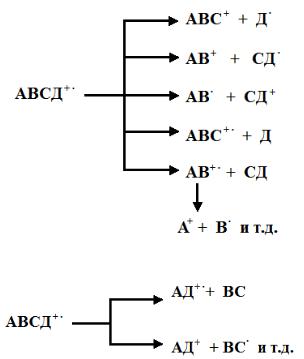
Образование молекулярного иона: АВСД+ + е →АВСД+ + 2е
Фрагментация:
Перегруппировки;
Ион-молекулярные столкновения: АВСД+ + АВСД →АВСДА+ + ВСД.
Таким образом, при ионизации молекулы возникает множество осколочных ионов.
Основные ионы, обуславливающие масс-спектр соединения, возникают непосредственно в ионизационной камере за 10-6 с. Если же ион распадается уже за пределами ионизационной камеры (между ионным источником и магнитным анализатором), то возникает так называемые местабильные ионы. В масс-спектре они проявляются в виде диффузионных пиков, отличающихся по форме от пиков основных ионов. Массовые числа диффузионных пиков, измерение в максимуме интенсивности обычно имеют дробные значения. Если массовое число m*
диффузионного пика удовлетворяет уравнению m* =m22 /m1 (где m1 -
более тяжелый ион, m2 - менее тяжелый ион), то это означает, что ион с массой m2 образуется при распаде иона с массой m1.
Иногда в масс-спектрах встречаются малоинтенсивные пики многозарядных ионов, возникающие вследствие элиминирования в процессе ионизации двух или трех электронов. Такое явление наблюдается при исследовании многоядерных ароматических соединений.
67

4.2. Некоторые масс-спектрометрические правила
4.2.1 «Азотное правило»
Большинство элементов, входящих в структуру органических соединений, имеют либо четную массу основных изотопов (С, О, S, Si РЬ и др.), либо нечетную массу и нечетные валентности (Н, F, Cl, Br, I, As и др.). Поэтому М+ соединений, составленные из любых комбинаций этих элементов, имеют четную массу. Только азот имеет четную массу и нечетную валентность.
Поэтому азотсодержащие соединения, имеющие в своей структуре нечетное число атомов азота, имеют нечетное массовое число М+, а соединения с четным числом атомов азота имеют четное массовое число М+.
В этом случае и основные ионы образуются по аналогичным правилам в зависимости от числа атомов азота в составе соединения и числа связей, разрывающихся при их образовании.
4.2.2 «Четно-электронное» правило
Ион-радикалы (нечетное число электронов) могут элиминировать радикалы, четно-электронные нейтральные молекулы, тогда как ионы (четное число электронов) могут терять лишь нейтральные четноэлектронные частицы, но не радикалы:
A - B+ ® A+ + B; A - B+ ® A+ + B;
A - B+ ® A+ + B; A - B+ ¹ A+ + B
4.2.3 Правило Стивенсона-Одье
При распаде молекул под действием ЭУ положительный заряд локализуется на фрагменте, обладающим наименьшей энергией ионизации (ЭИ), например:
ЭИ=10,5; ЭИ=10,8
4.2.4 Затрудненный разрыв связей, прилежащих к ненасыщенным системам
68

Разрыв связей, прилежащих к винильной, этинильной, арильной группам, обычно затруднен вследствие низкой стабильности образующихся ненасыщенных ионов или радикалов. В спектрах алифатических и ацетиленовых соединений имеются пики ионов, формально отвечающих разрыву С-С связей около двойной или тройной связи. Однако на самом деле их возникновение обусловлено сложными перегруппировками сопровождающимися миграцией кратных связей.
4.2.5Некоторые общие правила фрагментации
В-углеводородной цепи разрыв связи происходит легче всего у наиболее разветвленного атома углерода, например:
Вциклических углеводородах наиболее характерным будет разрыв а-связи, например:
- Для непредельных соединений наиболее вероятен β -разрыв, например:
CH3 −CH = CH −CH2 − −CH2 −CH3
Алкилзамещенные ароматические соединения дают наиболее интенсивные пики, соответствующие β -разрыву С— С -связей, например:
СН2— СH2—R
В соединениях, содержащих гетероатом, наиболее вероятным местом разрыва является связь С— С рядом с гетероатомом, например:
R—CH 2—X—R’
Образование перегруппировочных ионов часто сопровождается выделением низкомолекулярных стабильных соединений: СО, СН2=СН2, Н2О, NH3, HCN и др. Перегруппировки чаще всего связаны с миграцией водорода в молекуле. Например, в спектре диэтилового эфира наиболее интенсивный пик m/z=31. Его появление можно объяснить используя следующую схему:
69
