
- •Неравновесные явления
- •Тема 2: Реакции первого и второго порядка
- •Тема 3: Зависимость скорости реакции от температуры
- •Тема 4: Определение порядков химических реакции
- •Тема 5: Сложные химические реакции
- •Электрохимия
- •Тема 6: Электрическая проводимость и подвижность ионов
- •Тема 7: Теория электролитической диссоциации. Слабые и сильные электролиты
Электрохимия
Тема 6: Электрическая проводимость и подвижность ионов
Задача № 1
Для 0,01 М раствора хлорида калия ρ = 709,22 Ом·см. Вычислите удельную и молярную электрические проводимости.
Решение:
1)
![]()
2) Молярная электрическая проводимость рассчитывается по формуле
![]()
Задача № 2
Ток в 0,1 А в течение 2 час проходил через водный раствор цианида меди CuCN. На катоде выделилось 0,3745 г меди и наблюдалось выделение Н2 (н.у.: 1 атм, 273 0С). Какой выход по току при получении меди (ψСu) и каков объем выделившегося газа, если нет других побочных процессов?
Решение
Электрохимические реакции:
Основной процесс.

Побочный процесс:

Определим выход по току
По закону Фарадея:
![]()
![]()
Следовательно, на восстановление водорода пошло 100 – 78,4 = 21,6 % от общего количества тока I.
Рассчитываем массу водорода:

При н.у., полагая, что Н2 – идеальный газ, получаем:
![]()
Задача № 3
Анилин получается на свинцовом катоде в кислой среде по уравнению:
С6H5NO2 + 6e + 6H+ = C6H5NH2 + 2H2O
Выход по току 90%, напряжение 1 В. Найдите объем выделившегося водорода при Т = 298 К и Р = 0,9·105 Па, если получен 1 кг анилина. Определить расход энергии в кВт-час.
Решение:
1) Найдем расход энергии:
![]()
Из второго закона Фарадея выразим Iτ:

2) Расчет объема выделившегося Н2
![]()

Задача № 4
По нижеприведенным данным найти предельную электропроводность соли KClO3 при 18 0С:
-
электролит
NaClO3
KCl
NaCl
λ∞·104 Ом-1м2/моль
98,5
130,1
109
Чему равна подвижность хлорат – ионов, если число переноса для него в KClO3 равно 0,462
Дано:
Т = 180С = 291 К,
n_ = t_ = 0,462
________________________________________________
Найти: λ ∞.,KClO3 – ? λ ∞.,ClO3- – ?
Решение:
В основу расчета положен закон Кольрауша независимого движения ионов.
![]()
Числа переноса
![]()
![]()
![]()
Найти значение λ ∞.,KClO3 можно сходя из λ ∞.,NaClO3, λ ∞.,KCl, λ ∞.NaCl.


Задача № 5
Измерение электрической проводимости 0,03 М раствора СН3СООН проводился при l = 2·10-2 м и площади электродов s = 3·10-4 м2. При напряжении в 10 В через раствор идет ток I = 4,3·10-3 А при 298 К. Определить степень и константу диссоциации кислоты, если при этой температуре λ ∞,Н3О+ = 34,982 Ом-1м2/кмоль и λ ∞,СН3СОО- = 4,09 Ом-1м2/моль. Определить рН.
Решение:
1) СН3СООН+Н2О ↔ СН3СОО- + Н3О+ х1
2) Н2О + Н2О ↔ Н3О+ + ОН- х2
По 2 реакции [H3O+] = Kw0.5 = 10-7 моль/л, значительно меньше, чем по 1 реакции; рН определяется 1 реакцией
Рассчитываем α:
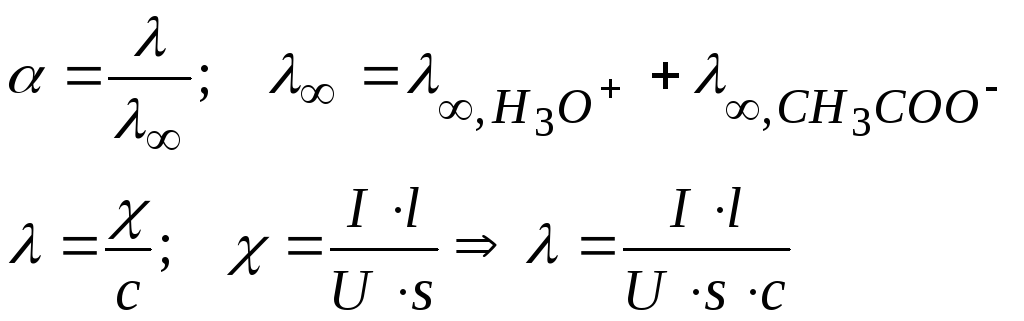

Рассчитываем Кдис:
![]()
рН раствора:
![]()
Тема 7: Теория электролитической диссоциации. Слабые и сильные электролиты
Сильные электролиты диссоциируют нацело; диссоциация слабых электролитов характеризуется степенью диссоциации
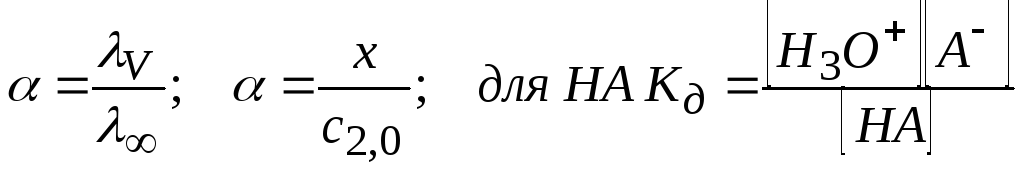
α – степень диссоциации слабого электролита;
У сильных электролитов α ≈ 1.
Задача 1
Найти показатель константы диссоциации пропионовой кислоты С2Н5СООН по следующим данным: электропроводность 0,135 М раствора этой кислоты при 18 0С равна 4,79·10-2 Ом-1м-1, а электропроводность 0,001 М раствора пропионата натрия равна 7,54·10-3 Ом-1м-1. Подвижность ионов натрия 44,4 Ом-1м2/моль, а протона водорода – 318·10-4 Ом-1м2/моль.
Решение
Запишем выражение для Кд кислоты:

![]()
|
С2Н5СООН + Н2О↔С2Н5СОО- + Н3О+ | ||
|
с0,к − х |
х |
х |
|
с0,к(1−α) |
с0,к·α |
с0,к·α |
Тогда
1)
![]() и
и![]()
2) Рассчитаем значение α = lV/l∞
![]()
![]()
Для расчета λ∞ нет значения l∞, С2Н5СОО-. Найдем его, зная электропроводность соли, считая, что при концентрации 0,001 моль/л раствор достаточно разбавлен.
Диссоциация соли происходит нацело «нацело»
С2Н5СООNa↔С2Н5СОО- + Na+
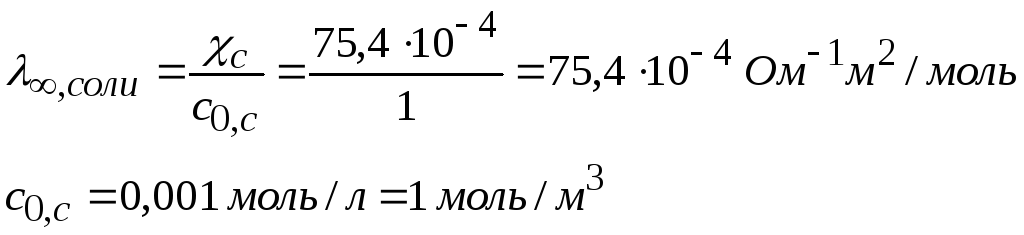
![]()
![]()
![]()
![]()
Расчет Кд пропионовой кислоты
![]()
В справочниках константы диссоциации Кд = Ка приводятся в шкале моль/л.
Кд по справочнику равно 1,34·10-5, рКа=4,874.
Задача № 2
Для уксусной кислоты рКа = 4,756, а для монохлоруксусной – 2,870. Найти степень диссоциации, концентрацию ионов гидроксония Н3О+ и значение рН 0,01 М растворов кислот. Какая необходима концентрация CH3COOH, чтобы кислотность ее раствора равнялась кислотности 0,01 молярного раствора СН2ClCOOH?
Решение:
Для одноосновных кислот:
![]()
Допускаем, что α<<1, тогда
![]()
СН3СООН:
рКа = рКд = 4,756; lgКа = − 4,756; Ка = 1,75·10-5
![]()
Если α ≈ 0, то нужно решать квадратное уравнение
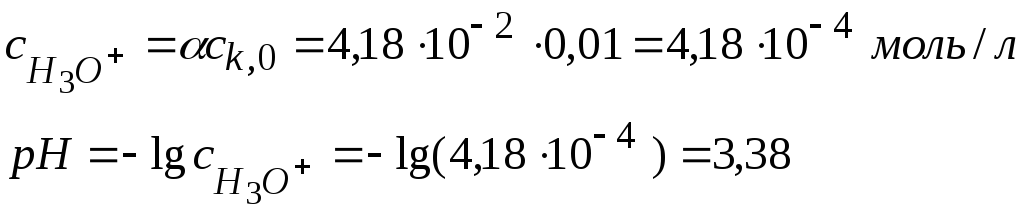
CH2ClCOOH: рКа = рКд = 2,870; Ка = 1,35·10-3
![]()



Задача № 3
Рассчитать концентрацию OH- в 0,1 М растворе гидроксида аммиака, содержащем 1 моль хлорида аммония. Покажите, как изменится рН раствора NH4OH при добавлении к нему NH4Cl.
Решение:
Из справочника
Кд,NH4OH
= 1,77·10-5,
слабодиссоциируемое соединение, поэтому
считается, что
![]()
Уравнения ионных реакций:


При добавлении 1 моль хлорида аммония, эта соль диссоциирует нацело (α=1)
![]()
Можно принять, что
![]()
![]()
Вывод: Добавление к раствору NH4OH хлорида аммония равновесие сдвигается влево, концентрация гидроксид – ионов уменьшается, рН становится меньше.
![]()
Задача № 4
Записать уравнения ионных уравнений, условие материального баланса и условие электронейтральности, а так же найти концентрацию всех типов частиц в 0,005 М водном растворе метиламина.
Решение:
Из справочника КВ = 4,17·10-4 – метиамин – слабое основание.
Уравнение ионных реакций:

Равновесные концентрации частиц:
![]()
Тогда

Сделаем допущения х1>>х2, отсюда

Решаем квадратное уравнение:
![]()
х1,2 не имеет физического смысла.
С учетом этого:
![]()
Условие электронейтральности:
![]()
Уравнение материального баланса по катиону:
![]()
Задача № 5
Удельная электропроводность чистой воды при 307 К составляет 9,62·10-6 Ом-1м-1. Вычислить константу ионизации, ионное произведение воды и рН.
Решение:
Реакция автопротолиза воды:
2Н2О ↔ Н3О+ + ОН-
(Со−х) х х
Константа автопротолиза воды

Константа ионизации воды

Ионное произведение воды Kw:
![]()
Удельная электропроводность воды
![]()
Подвижность при температуре Т можно найти через эмпирическую формулу:
![]()
где α – температурный коэффициент электропроводности
Рассчитаем λ∞,Т.
Из справочника:
![]()
![]()
![]()
![]()
Найдем х:
![]()
Вычислим концентрацию воды:

Вычислим искомые величины:
![]()
![]()
![]()
![]()
