
Звягина Учебное пособие
.pdf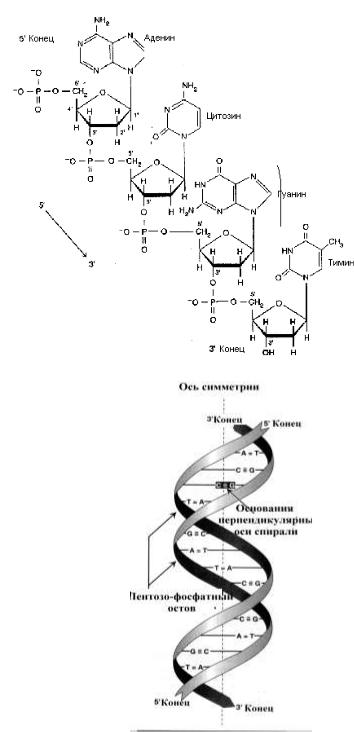
Под первичной структурой ДНК понимают линейную последовательность нуклеотидов, связанных между собой 3', 5' - фосфодиэфирной связью.
Вторичная структура ДНК
(1953 г., Д. Уотсон, Ф. Крик) — двойная спираль, построенная по принципам комплементарности (А
— Т, Г — Ц) и антипараллельности (3'-концу одной цепи соответствует 5'-конец другой). ДНК имеет общие закономерности, установленные Е.Чаргаффом:
- молярное соотношение |
Рисунок 4. Первичная структура ДНК |
|
|
аденина к тимину равно 1 (А=Т, или А/Т = 1); |
|
-молярное соотношение гуанина к цитозину |
|
равно1 (Г=Ц или Г/Ц=1); |
|
-сумма пуриновых нуклеотидов равна сум- |
|
ме пиримидиновых нуклеотидов; |
|
-отношение Г + Ц /А + Т неодинаково и |
|
называется коэффициентом специфичности. В |
|
ДНК некоторых видов преобладает суммарное |
|
количество аденина и тимина, это АТ-тип ДНК |
|
или, наоборот, преобладает сумма гуанина и ци- |
|
тозина, ГЦ-тип |
|
Структурная организация ДНК в хромосо- |
|
мах. |
|
Третичная структура ДНК образуется толь- |
|
ко в комплексе с белками хромосом и служит |
Рисунок 5. Вторичная струк- |
для компактной упаковки ДНК в ядре. На первом |
тура ДНК |
|
уровне образуется нуклеосомная нить, которая формируется при взаимодействии ДНК с белками – гистонами. Гистоны богаты аргинином и лизином, имеют заряд «+» (основные). Выделяют 5 классов гистонов — Н1, Н2А, Н2В, Н3, Н4. Нуклеосома содержит 8 молекул гистонов (по 2 каждого вида, кроме Н1), на них накручен отрезок двуспиральной ДНК (за счет остатков фосфорной кислоты, заряд «-
31

»).Связь между ними — ионная. Свободные от контакта с белками участки ДНК называются линкерными. Их длина различна. Эти участки либо свободны, либо связаны с гистоном Н1. Гистоны в клетках могут подвергаться модификации (фосфорилированию, метилированию, ацетилированию и т.д.). Это приводит к изменению их способности взаимодействовать с ДНК, что является одним из механизмов регуляции транскрипции генов.
В результате нуклеосомной организации хроматина двойная спираль ДНК укорачивается примерно в 7 раз.
Вторичным уровнем пространственной организации хромосом является образование из нуклеосомной нити хроматиновый фибриллы, что обеспечивает уменьшение размеров ДНК еще в 6-7 раз.
Третичный уровень организации хромосом обусловлен укладкой хроматиновой фибриллы в петли. В этом процессе принимают участие негистоновые белки. В результате такой упаковки линейные размеры ДНК уменьшаются примерно в 200 раз.
Физико-химические свойства ДНК. Различные факторы, нару-
шающие водородные связи (повышение температуры выше 800С, изменение рН, действие мочевины и др.), вызывают денатурацию ДНК. Двойная спираль ДНК при денатурации частично или полностью разделяется на составляющие ее цепи. При денатурации уменьшается высокая вязкость, характерная для растворов нативной ДНК. При восстановлении первоначальной двухспиральной структуры ДНК, в результате ренатурации, оптическое поглощение уменьшается. Это явление называют гипохромным эффектом.
Рисунок 6. Вторичная структура тРНК
Рибонуклеопротеиды. Уровни структурной организации. Химическая природа и биологические функции рибонуклеиновых кислот (матричная, транспортная, рибосомальная РНК).
Отличия от ДНК: по локализации (цитоплазма), по функциям (обеспечивает биосинтез белка), по размерам, по строению (содержит урацил (У) вместо тимина (Т), сахар — рибоза). РНК бывает нескольких типов — матричнаяРНК (мРНК),
32
рибосомальная (рРНК), транспортная (тРНК), гяРНК (гетерогенная ядерная РНК), мяРНК (малая ядерная РНК). м РНК выполняет функцию матриц белкового синтеза, рРНК выполняют роль структурных компонентов рибосом, тРНК участвует в транспорте необходимых (определенных матрицей) аминокислот к месту синтеза белка.
Вторичная структура тРНК напоминает вид клеверного листа. Образована за счет формирования водородных связей между комплементарными основаниями одной полинуклеотидной цепи. В тРНК выделяют следующие структурные участки: 1) акцепторный участок
– к свободной –ОН группе аденозина присоединяется аминокислота и доставляется к рибосоме, к месту синтеза белка; 2) Антикодоновая петля, на вершине которой располагается антикодон – специфический триплет нуклеотидов, который комплементарен кодону мРНК, кодирующему соответствующую аминокислоту; 3) псевдоуридиновая петля; 4) дигидроуридиновая петля, их роль еще мало изучена.
I.Вопросы для самоподготовки.
1.Что такое сложные белки?
2.Как можно классифицировать сложные белки?
3.Дайте характеристику фосфопротеинам.
4.Назовите биологические функции гликопротеинов.
1.Как можно классифицировать липопротеины.
2.Дайте характеристику каждого типа липопротеинов.
3.Что такое кофакторпротеины, их краткая характеристика.
4.Гемоглобины: химическая природа, функции.
5.Важнейшие производные гемоглобина.
6.Физиологические типы гемоглобина.
7.Аномальные типы гемоглобина.
8.Что такое гемоглобинопатии, их краткая характеристика.
9.Расскажите о строении иммуноглобулинов.
13. Компоненты НК, их строение.
14. Нуклеозид-5-трифосфаты, циклические нуклеотиды, их функции.
15. Дезоксирибонуклеопротеины. ДНК, уровни структурной организации и типы связей их стабилизирующие.
16. Структурная организация ДНК в хромосомах.
17. Рибонуклеопротеины. Уровни структурной организации РНК и ее функциональные виды (м-РНК, т-РНК, р-РНК).
18. Физико-химические свойства нуклеиновых кислот. Денатурация и ренативация ДНК.
33
II. Тестовые вопросы для самоподготовки
1.К сложным белкам относится...
а) гемоглобин б) АТФ в) альбумин
г) фенилаланин 2. Сложные белки, состоящие из белковой части и остатков фосфорной кислоты называются ...
а) липопротеины б) фосфопротеины в) гликопротеины г) гемпротеины
3. Процесс фосфорилирования белка катализируют ферменты ...
а) протеинсинтетаты б) протеинфосфатазы в) протеинкиназы г) протеинлиазы
4. При фосфорилировании активность гликогенфосфорилазы ...
а) увеличивается б) снижается в) не изменяется
5. Простетической (небелковой) частью в гликопротеинах являются...
а) липиды б) углеводы в) белки г) витамины
6. Каких видов липопротеинов не существует...
а) хиломикроны б) липопротеины очень низкой плотности (ЛПОНП)
в) липопротеины высокой плотности (ЛПВП)
г) липопротеины очень высокой плотности (ЛПОВП) 7. Липопротеины выполняют ... функцию
а) энергетическую б) субстратную в) транспортную г) коферментную
8. К физиологическим типам гемоглобина не относится ...
а) Hb S
б) Hb F
34
в) Hb А
г) Hb А2
9.Замена одной аминокислоты на другую в первичной структуре полипептидной цепи происходит при ...
а) гемолитической желтухе б) фенилкетонурии в) подагре
г) серповидно-клеточной анемии
10.Транспорт О2 из легких в ткани осуществляет ...
а) хлорофилл б) каталаза в) гемоглобин
г) нуклеопротеины.
11. В природе не встречается… РНК а) транспортная б) лизосомальная в) матричная г) рибосомальная
12. Перенос аминокислоты к месту синтеза белка осуществляет … а) рРНК б) мРНК в) тРНК г) иРНК
13. При взаимодействии цитозина и гуанина образуется … водородные связи
а) 2 б) 3 в) 4 г) 1
14. Первичная структура мРНК представляет собой … а) линейную цепь полирибонуклеотидов б) клеверный лист в) двойную спираль г) скелет рибосом
15. В состав РНК не входят … а) рибоза
б) остатки фосфорной кислоты в) азотистые основания г) дезоксирибоза
35
16. Вещество, состоящее из азотистого основания, рибозы и остатка фосфорной кислоты называется…
а) хроматин б) нуклеотид в) нуклеозид
г) нуклеопротеин 17. К пуриновым азотистым основаниям относятся…
а) цитозин, тимин б) урацил, тимин в) аденин, гуанин
г) дигидротимин, цитидин 18. Аденозинтрифосфат (АТФ) – это …
а) азотистое основание б) нуклеозид в) нуклеотид
г) нуклеопротеин 19. В молекулах нуклеиновых кислот остатки нуклеотидов соединены …связями.
а) фосфоангидридными б) N-гликозидными
в) 2 ´,3´-фосфодиэфирными г) 3 ´,5´-фосфодиэфирными
20. В молекуле ДНК число остатков аденина всегда равно числу остатков …
а) гуанина б) тимина в) цитозина
г) пиримидина 21. Между молекулой ДНК и гистонами в составе хромосомы формируются … связи
а) эфирные б) ионные
в) водородные г) пептидные
22. Нарушение пространственной структуры нуклеиновых кислот приводит к…
а) гипохромному эффекту б) гиперхромному эффекту
в) спирализации нуклеиновых кислот
36
г) возникновению электрохимического потенциала
Частный модуль 1.2. Ферменты.
После изучения частного модуля 1.2. студент должен:
Знать: особенности ферментативного катализа. Специфичность действия ферментов. Зависимость скорости ферментативных реакций от температуры, p , концентрации фермента и субстрата. Единицы измерения активности и количества ферментов. Изоферменты. Различия ферментного и изоферментного состава тканей. Органоспецифичные ферменты. Изменение активности ферментов при болезнях. ферментов. Регуляцию активности ферментов.
Уметь: применять ферменты в качестве аналитических реагенов в лабораторной диагностике (определение глюкозы, этанола, мочевой кислоты); оценивать информативность биохимических показателей анализа крови и мочи при патологических состояниях; самостоятельно находить достаточное количество информации для решения ситуационных задач.
Владеть: методами определения активности некоторых ферментов, с целью их использования в фарманализе; способностью самостоятельно проводить химический эксперимент и интерпретировать его результаты.
Общие представления о катализе. Сходство и различие между ферментами и неферментными катализаторами.
Ферменты (энзимы) – вещества белковой природы, обеспечивающие протекание биохимических реакций с высокой скоростью. Чтобы произошла химическая реакция, необходимы следующие условия:
1)молекулы должны сблизиться (столкнуться);
2)запас энергии молекул в момент столкновения должен быть достаточен для преодоления энергетического барьера реакции, причем высота этого барьера неодинакова для различных реакций.
Энергия активации (свободная энергия активации) – дополнительное количество кинетической энергии, которое необходимо сообщить молекулам вещества, чтобы они вступили в химическую реакцию, т.е. преодолели энергетический барьер. При достижении этого энергетического барьера в молекулах вещества происходят изменения, вызывающие перераспределение химических связей и образование новых соединений. Чем больше молекул обладает энергией, способной преодолеть энергетический барьер, тем выше скорость химической реакции. Это становится возможным в двух случаях, если: 1) придать реа-
37
гирующим веществам избыточную энергию (например, за счет увеличения температуры); 2) снизить высоту энергетического барьера, что становится возможным при ферментативном катализе за счет увеличения числа стадий химического процесса. Активирование ряда промежуточных реакций приводит к тому, что исходный энергетический барьер дробится на несколько более низких барьеров, преодолеть которые значительно легче.
Ферменты и небиологические катализаторы имеют следующие сходные признаки:
1.Они катализируют только энергетически возможные реакции (когда свободная энергия исходных веществ выше, чем у продуктов реакции).
2.Они никогда не изменяют направление реакции.
3.Они не расходуются в процессе реакции.
Отличия ферментов от небиологических катализаторов:
1.Скорость ферментативного катализа намного выше.
2.Ферменты обладают высокой специфичностью.
3.Ферменты катализируют реакции в "мягких" условиях, температуре около 370 , обычном давлении и рН среды, близком к нейтральной. Небиологические катализаторы "работают" при высоком давлении, температуре и крайних значениях рН.
4.Скорость протекания ферментативной реакции можно регулировать в отличие от небиологических катализаторов.
5.Для ферментативных реакций характерна следующая зависимость: чем больше концентрация фермента, тем выше скорость реакции.
Структурно-функциональная организация ферментов. Структура и функциональные группы активного центра фермента. Кофакторы (ионы металлов и коферменты) и их значение для функционирования фермента.
Все ферменты имеют белковую природу и делятся на простые и сложные. Простые ферменты состоят только из аминокислот. Сложные ферменты, кроме белковой части, содержат небелковую часть (кофермент). Кофермент часто называют кофактором или простетической группой. Коферменты выполняют следующие функции: а) являются посредниками между ферментом и субстратом; б) непосредственно участвуют в акте катализа, выполняя чаще всего роль промежуточного переносчика групп, участвующих в реакции; в) стабилизируют апофермент.
38

Коферментами обычно бывают ионы металлов или производные водорастворимых витаминов.
Каждый фермент имеет активный центр, который образуется из участков пептидной цепи (белковой части) и отдельных аминокислот, содержащих различные функциональные группы. Субстрат соединяется с активным центром в контактном (якорном) участке. После присоединения субстрата происходят конформационные (структурные) изменения молекулы фермента и субстрата и протекание хими-
ческой реакции в каталитическом участке.
Кроме активного центра у ферментов имеется аллостерический (регуляторный) участок, который пространственно разделен с активным центром. Вещества, соединяясь с аллостерическим центром, влияют на скорость катализируемой реакции либо ускоряют
ее протекание (активаторы), либо замедляют (ингибиторы).
Коферменты. Химическое строение и участие в окислительновосстановительных процессах НАД+, НАДФ+, ФМН, ФАД
Никотинамидные коферменты
Представляют собой динуклеотиды: Никотинамидадениндинуклеотид (НАД+) и Никотинамидадениндинуклеотид фосфат (НАДФ+).
39

НАД+ и НАДФ+ входят в состав каталитического центра никотинамидных дегидрогеназ и катализируют реакцию окисления субстрата.
Механизм действия ферментов. Стадия ферментативного катализа. Специфичность ферментов, ее виды (с примерами) и теории, их объясняющие.
Процесс ферментативного катализа можно разделить на три ста-
40
