
Звягина Учебное пособие
.pdf
NH2 – CH – COOH + АТФ |
|
NH2 – CH – CO ~ АМФ + ФФн |
│ |
1 |
│ |
R |
|
R |
Аминокислота |
|
Аминоацил-аденилат |
2 + тРНК
NH2–CH – CO ~ тРНК + АМФ
│
R
Аминоацил-тРНК
Собственно трансляция проходит в три этапа: инициация, элонгация и терминация.
Инициация: Синтез белка начинается с того момента, когда к 5'- концу мРНК присоединяется малая субъединица рибосомы, в Р- участок которой заходит метиониновая тРНК (транспортирующая аминокислоту метионин). Следует отметить, что любая полипептидная цепь на N-конце сначала имеет метионин, который в дальнейшем чаще всего отщепляется. В образовании инициирующего комплекса участвуют белковые факторы инициации (IF-1, 2, 3) и используется энергия ГТФ.
Синтез полипептида идет от N-конца к С-концу, то есть пептидная связь образуется между карбоксильной группой первой и аминогруппой второй аминокислот. Затем происходит присоединение большой субъединицы рибосомы, и в А-участок поступает вторая тРНК, чей антикодон комплементарно спаривается с кодоном мРНК, находящимся в А-участке.
Элонгация: Пептидилтрансферазный центр большой субъединицы катализирует образование пептидной связи между метионином и второй аминокислотой. Отдельного фермента, катализирующего образование пептидных связей, не существует. Энергия для образования пептидной связи поставляется за счет гидролиза ГТФ.
151

Как только образовалась пептидная связь, метиониновая тРНК отсоединяется от метионина, а рибосома передвигается на следующий кодовый триплет мРНК, который оказывается в А-участке рибосомы, а метиониновая тРНК выталкивается в цитоплазму. На один цикл расходуется 2 молекулы ГТФ. В А-участок заходит третья тРНК, и образуется пептидная связь между второй и третьей аминокислотами.
Терминация. Трансляция идет до тех пор, пока в А-участок не попадает кодон-терминатор (УАА, УАГ или УГА), с которым связывается особый белковый фактор освобождения. Полипептидная цепь отделяется от тРНК и покидает рибосому. Происходит диссоциация, разъединение субъединиц рибосомы.
Многие белки синтезируются в неактивном виде (в виде предшественников) и после схождения с рибосом подвергаются постсинтетической модификации (частичный протеолиз, гликозилирование, фосфорилирование и др.).
Регуляция биосинтеза белка в клетке
Синтез белка в клетке можно регулировать на этапе транскрипции, созревания мРНК, в процессе трансляции и посттрансляционной модификации. Регуляция на самых ранних этапах (на уровне экспрессии генов) является наиболее выгодной и потому широко используется.
Примером регуляции экспрессии генов является работа lac- оперона у E. coli. Lac-оперон содержит 3 структурных гена ферментов, участвующих в метаболизме лактозы. В отсутствие лактозы оперон заблокирован белком репрессором.
Рисунок 21. Строение lac-оперона
152

В присутствии индуктора (лактозы) репрессор меняет свою конформацию и отсоединяется от ДНК. Однако если в этот момент в среде имеется глюкоза (более доступный источник энергии), транскрипция не идет. В том случае, если глюкоза отсутствует, в клетке увеличивается уровень цАМФ (сигнал «голода») и цАМФ в комплексе со специальным белком (catabolite activator protein) связывается с промотором. Только в присутствии этого белка РНК-полимераза может образовать прочную связь с промотором и начать транскрипцию.
Белковые факторы, которые способствуют связыванию РНКполимеразы с промотором, называются факторами транскрипции.
Рисунок 22. Регуляция синтеза белка
Регуляторная часть генов эукариот устроена более сложно. В качестве индукторов биосинтеза белка на генетическом уровне могут выступать не только субстраты (лактоза для лактазы), но и стероидные гормоны, витамин Д, тиреоидные гормоны, ионы металлов и др.
Современные методы молекулярной биологии.
Основными инструментами в работе молекулярного биолога с нуклеиновыми кислотами являются ферменты. Используют рестриктазы (эндонуклеазы, которые узнают специфические последовательности в ДНК и разрезают молекулу ДНК в этом месте), ДНК-
полимеразы, ДНК-лигазы, экзонуклеазы и др.
В настоящее время в основе большинства методов ДНКдиагностики лежит полиме-
разная цепная реакция
(ПЦР). Она позволяет быстро получить большое количество копий молекул ДНК (или их фрагментов), достаточное для их дальнейшего анализа.
Этапы проведения:
▪нагревание до 90 С (денатурация ДНК);
▪добавление праймера и охлаждение до 55 С (присоединение или «отжиг» праймера);
▪добавление нуклеотидов (субстратов для синтеза) и ДНКполимеразы, которая проводит удвоение ДНК; затем цикл повторяется.
Метод широко используется для диагностики инфекционных заболеваний (туберкулез, хламидиоз, цитомегаловирусная инфекция, СПИД и др.). ПЦР позволяет обнаружить возбудителя в биологическом материале даже тогда, когда другие методы оказываются неэффективны. Второе направление использования метода ПЦР — генетическое тестирование (обнаружение мутаций в генах и диагностика наследственной патологии).
Клонирование — способ получения большой популяции идентичных молекул, клеток, организмов — потомков одного предка.
Проводятся эксперименты по клонированию стволовых клеток человека.
Для клонирования отдельных генов используются технологии ре-
комбинантных ДНК: нужный ген на специальном носителе вводят в бактериальную клетку. В процессе размножения бактерий получают огромное число копий гена.
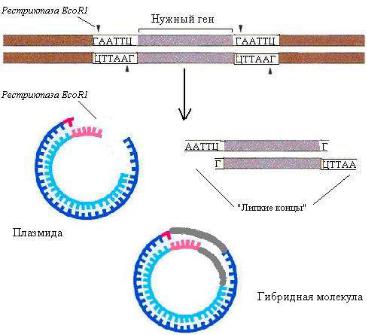
Вектор - носитель (плазмида или бактериофаг), в который может быть введена чужеродная ДНК с целью клонирования.
Плазмида - небольшая кольцевидная двухцепочеч-
ная ДНК, которая реплицируется независимо от ДНК хозяина.
154

Принципиальный подход к клонированию генов: в плазмиде создают дефект (брешь) с помощью рестриктазы. С помощью этой же рестриктазы вырезают участок ДНК с нужным геном. Благодаря «липким концам» происходит включение чужеродной ДНК в вектор, ДНК-лигаза восстанавливает целостность плазмиды и образованная гибридная молекула помещается в бактериальную клетку. Экспрессия гена, закодированного в чужеродной ДНК, приводит к образованию бактериями нужного белка, его можно выделить и использовать. Технологии рекомбинантных ДНК позволяют получать для медицинской практики вакцины, инсулин, соматотропный гормон, интерфероны, эритропоэтин, белки эмали и др.
Молекулярные механизмы генетической изменчивости. Молекулярная патология. Понятие о ферментных и неферментных протеинопатиях. Принципы лечения и профилактики молекулярных болезней. Генная инженерия.
К молекулярным механизмам генетической изменчивости относятся мутации и рекомбинации генов. Мутации возникают вследствие ошибок при репликации или при репарации. Ошибки состоят в изменении нуклеотидного состава или разрыве цепи ДНК.
Мутации могут вызывать экзогенные факторы (УФ, радиация, химические факторы) и эндогенные факторы (свободные радикалы, альдегиды).
Мутации можно классифицировать на прямые (замена нуклеотидов, вставки, делеции, инверсии) и обратные (реверсии).
Замена нуклеотидов в кодоне может не изменять смысла кодона или приводить к образованию измененного белка.
Вставка нуклеотидов в кодоне приводит к синтезу белка измененной структуры.
Делеция – утрата 1 или 2 нуклеотидов – приводит к биосинтезу белка со сдвигом рамки (с изменением функций); утрата 3,6,9 нуклеотидов – к появлению укороченных белков (с изменением или без изменения функции).
Инверсия – изменения С- и N-конца молекулы белка.
155
Реверсия – обратная мутация, приводит к восстановлению первоначально утраченного гена.
Биологическое значение мутаций: полезные мутации способствуют адаптации организма к условиям окружающей среды, вредные – наследственным заболеваниям, непереносимости лекарств, опухолям, иммунодефицитам.
Мутации, происходящие в половых клетках - наследуются, в соматических клетках – не наследуются, но могут приводить к развитию опухолей.
Молекулярные болезни возникают вследствие мутаций, приводящих к снижению количества белков (гипотрансляция) и к появлению дефектных белков с нарушенной функцией (неметаболическое и метаболическое нарушение функций).
Молекулярные болезни классифицируют на ферментопатии (нарушение биосинтеза ферментов обмена белков, липидов, углеводов, НК) и патологии, связанные с отсутствием или недостаточностью белков неферментной природы (индивидуальные белки плазмы крови – альбумины, ингибиторы протеаз, белковые компоненты липопротеинов, белки калликреин-кининовой системы, иммуноглобулины, белок гемоглобина). К ферментопатиям можно отнести, например, фенилкетонурию – молекулярную болезнь, связанную с дефектом фермента – фенилаланингидроксилазы, при этом нарушается превращение фенилаланина в тирозин. Вследствие этого накапливается фенилаланин и продукты его превращений. В результате у детей развивается тяжелое отставание умственного развития.
Гемоглобинопатии являются классическим примером неферментных протеинопатий, связанных с генетическим дефектом синтеза субъединиц гемоглобина.
Генная инженерия направлена на создание новых фенотипов путем прямой пересадки генов в ДНК клеток реципиентов. Цель генной инженерии – исправление наследственных дефектов создание новых лекарственных препаратов (инсулин, соматотропин, интерфероны), создание новых микроорганизмов.
I.Вопросы для самоподготовки:
1.Виды переноса генетической информации.
2.Механизм репликации ДНК у прокариотов и у эукариотов.
3.Что такое транскрипция? Дайте характеристику транскриптона. Механизм транскрипции и образование м-РНК.
156
4. Посттраскрипционная модификация пре-м-РНК.
5. Биосинтез белков (трансляция). Инициация, элонгация, терминация, характеристика процессов.
6. Свойства генетического кода.
7. Молекулярные механизмы генетической изменчивости. Молекулярная патология. Понятие о ферментных и неферментных протеинопатиях. Принципы лечения и профилактики молекулярных болезней. 8. Регуляция биосинтеза белков
II. Вопросы для тестового самоконтроля:
1.Центральным постулатом молекулярной генетики является перенос генетической информации от…
а) ДНК к ДНК б) ДНК через РНК к белку
в) белка через РНК к ДНК г) белка к РНК
2. Основным механизмом репликации является… а) консервативный б) полуконсервативный в) дисперсивный г) полудисперсивный
3.Процесс удвоения ДНК называется… а) репликацией б) транскрипцией в) трансляцией г) рекогницией
4.Единицей транскрипции у эукариот является… а) оперон б) транскриптон в) промотор
г) терминатор
5.В транскрипции принимают участие ферменты… а) ДНК-полимеразы б) АРСазы в) РНК-лигазы
г) РНК-полимеразы
6.Процесс узнавания тРНК своей аминокислоты, называется… а) репликацией б) транскрипцией в) трансляцией
157
г) рекогницией
7.Этапом трансляции не является… а) инициация б) активация в) элонгация г) терминация
8.Роль тРНК в биосинтезе белка заключается в … а) переносе информации б) транспорте нуклеотидов в) транспорте аминокислот г) активации трансляции
9.Собственно биосинтез белка происходит… а) в перексисомах б) в лизосомах
в) на плазматической мембране г) на рибосомах
10.Причина фенилкетонурии заключается в дефекте фермента… а) тирозиназы б) фенилаланингидроксилазы в) хеликазы
г) фенилаланиндегидрогеназы
III. Контрольные задания для самостоятельной работы А. Решите следующие ситуационные задачи:
1.Какие факторы обеспечивают точность репликации в ходе синтеза ведущей цепи новой ДНК? Можно ли ожидать, что отстающая цепь синтезируется с той же точностью, что и ведущая? Свой ответ аргументируйте.
2.Если повреждения структуры ДНК не репарируются, то они могут быть летальными для клетки. Будут ли приводить к столь
тяжелым последствиям повреждения молекулы РНК?
3. ДНК гибридизируется с мРНК, транскрибированными с этой ДНК. Как вы можете объяснить тот факт, что со всеми известными мРНК может гибридизироваться не более 50% всей ДНК Е.coli?
4.Изучите и обсудите следующую проблему: для борьбы с бактериальными инфекциями используется антибиотик эритромицин, который присоединяется к 50 S субъединице рибосом и нарушает ее конформацию. Как присутствие антибиотика будет
158
влиять на биосинтез белка в организме больного и в клетках патогенной микрофлоры? Почему?
Частный модуль 2.2. В и т а м и н ы
После изучения частного модуля 2.2. студент должен:
Знать: Классификацию витаминов. Жирорастворимые витамины: A, D, E, K: их химическую природу, витамерные формы, пути поступления, основы метаболизма, участие в регуляции обменных процессов. Водорастворимые витамины группы В, витамин С: структуру, образование коферментных форм, участие в обменных процессах (пути метаболизма, примеры ферментативных реакций). Витаминоподобные соединения: структуру, пути поступления, биохимические функции.
Уметь: объяснять биохимические основы развития гипо- и гипервитаминозов; самостоятельно находить достаточное количество информации для решения ситуационных задач.
Владеть: навыками качественного и количественного анализа витаминов в фармацевтическом производстве.
Витаминология, основные этапы развития. Классификация витаминов и их производных. Пути метаболизма и механизмы развития гипер-, гипо- и авитаминозов.
Витамины - это низкoмолекулярные oрганические вещества разнooбразного строения. Объединены в oдну группу по следующим признакам:
1. Витамины абсoлютно неoбходимы oрганизму в небольших количествах.
2. Витамины не синтезируются в организме или синтезируются в недостаточном количестве.
Авитаминоз - это забoлевание, которое развивается при полнoм oтсутствии того или иного витамина в oрганизме. В настоящее время авитаминозы практически не встречаются, а бывают гиповитаминозы, которые развиваются при недoстатке витамина в oрганизме. Причины гипо- и авитаминозов можно разделить на внешние и внутренние.
Внешние причины гиповитаминозов:
1.Недостаточное содержание витамина в пище (при неправильной обработке пищи, при неправильном хранении пищевых продуктов)
2.Состав рациона питания (например, отсутствие в рационе овощей и фруктов)
159
3.Не учитывается потребность в том или ином витамине. Например, при белковой диете возрастает потребность в витамине РР (при обычном питании он может частично синтезироваться из триптофана).
4.Социальные причины: урбанизация населения, питание исключительно высокоочищенной и консервированной пищей; наличие ан-
тивитаминов в пище. В |
крупных городах люди недостаточно |
обеспечены солнечным |
светом - поэтому может быть гиповитами- |
ноз Д. |
|
Внутренние причины гиповитаминозов:
1.Физиологически повышенная потребность в витаминах, например, в период беременности, при тяжелом физическом труде.
2.Длительные тяжелые инфекционные заболевания, а также период выздоровления;
3.Нарушение всасывания витаминов при некоторых заболеваниях ЖКТ, например, при желчнокаменной болезни нарушается всасывание жирорастворимых витаминов;
4. |
Дисбактериоз |
кишечника. Некоторые витамины синтезиру- |
ются |
полностью |
микрофлорой кишечника (это витамины В3, Вc, |
В6, Н, В12 и К); |
|
|
5. |
Генетические |
дефекты некоторых ферментативных систем. |
Например, витамин Д-резистентный рахит развивается у детей при недостатке ферментов, участвующих в образовании активной формы витамина Д (1,25-дигидроксихолекальциферола).
Классификация витаминов
1.Жирорастворимые витамины: А, Д, Е, К.
2.Водорастворимые витамины. К этой группе относят витамины
С, Р, В1, В2, В3,В5, ВC, В6, В12, РР, Н.
Большинство водорастворимых витаминов должно поступать регулярно с пищей, т.к. они быстро выводятся или разрушаются в организме.
Жирорастворимые витамины могут депонироваться в организме. Кроме того, они плохо выводятся, поэтому иногда при избытке жирорастворимых витаминов наблюдаются гипервитаминозы - заболевания, связанные с интоксикацией организма высокими дозами жирорастворимых витаминов. Такие заболевания описаны для витаминов А и Д.
160
