- •Приготовление фосфатного буферного раствора
- •Содержание
- •Принципы работы гематологических анализаторов
- •Метод определения гемоглобина[править | править вики-текст]
- •Метод подсчета клеток крови Метод разделения лейкоцитов на популяции Реагенты для гематологических анализаторов]
- •Изотонический разбавитель[править | править вики-текст]
- •Лизирующий раствор[править | править вики-текст]
- •Промывающие растворы[править | править вики-текст]
- •2. Полипотентные и дипотентные клетки-предшественницы:
- •3. Унипотентные клетки-предшественницы.
- •Класс морфологически распознаваемых клеток. Гранулоцитарный (миелоидный) росток.
- •Функции клеток гранулоцитарного ряда.
- •Моноцитарный росток.
- •Функции моноцитов-макрофагов.
- •Регуляция грануломоноцитопоэза.
- •Лимфоцитарный росток.
- •Функции клеток лимфоидного ряда.
- •Регуляция лимфопоэза.
- •Эритроцитарный росток.
- •Регуляция эритропоэза.
- •Мегакариоцитарный росток.
- •Функции тромбоцитов.
- •Регуляция мегакариоцитопоэза.
- •Эритроцитарный росток.
- •Ретикулоцитоз
- •Ретикулоцитопения
- •Виды анизоцитоза
- •Причины анизоцитоза
- •Мегакариоцитарный росток.
- •Функции тромбоцитов.
- •Регуляция мегакариоцитопоэза.
- •Клиническое значение
- •Клинико-диагностическое значение тромбоцитопений (по с.А. Луговской и соавт., 2002)
- •Иммунные тромбоцитопении
- •Тромбоцитозы
- •Методы определения длительности кровотечения
- •Определение длительности кровотечения по методу Айви
- •Автоматизированное исследование агрегации тромбоцитов (с применением агрегометра).
Требования к забору и подготовке биологического материала для проведения гематологических исследований.
Требования к транспортировке и хранению биологического материала для проведения гематологических исследований.
Правильное заполнение направления на исследование системы гемостаза:
Ф.И.О., возраст, пол пациента
Время забора крови для исследования
Клинический диагноз (кратко)
Гематокрит
Геморрагический синдром (носовые, маточные кровотечения и др.), тромбоз (указать локализацию), шок, полиорганная недостаточность, травмы, синдром длительного сдавления, ожог и др.)
Указать принимаемые лекарства, влияющие на параметры гемостаза с указание дозировки, способа и срока последнего введения
Соблюдаются временной интервал забора образца (крови), диетические и нагрузочные органичения:
Плановый забор крови проводят с 7 до 9 часов утра, в положении пациента лежа или сидя. При исследовании гемостаза в динамике забор крови желательно проводить в том же положении тела, что и предыдущий забор.
Кровь берут натощак, через 12—14 часов после последнего приема пищи.
Перед забором крови желателен отдых пациента в течение 15 минут.
Исключения: исследования гемостаза по cito, оценка АЧТВ.
Накануне планового исследования (в течение 24 часов) пациент воздерживается от значительных физических нагрузок, приема алкоголя. Желательно, чтобы накануне забора крови пациент не употреблял жирной пищи.
Оперативное вмешательство приводит к изменению показателей гемостаза на срок от нескольких дне до нескольких недель.
К факторам, влияющим е гемостаз относятся инъекции, вливания, переливания, пункции, биопсии, массаж, диализ, введение рентгеноконтрастных средств, иммуносцинтиография, иоизирующее излучение, эндоскопическое исследование, специальные диеты.
ПРАВИЛА ЗАБОРА КРОВИ
Кровь берут из периферической вены(чаще локтевой).
Забор крови производится только с использованием вакуумной системы забора в пробирки со специальной цветовой маркировкой в зависимости от используемого антикоагулянта (цитрат натрия 3,2%) в соотношении: 1 объем цитрата натрия к 9 объемам крови.
Для исследования уровня тромбоцитов кровь берут в пробирку с ЭДТА (сиреневая цветовая маркировка). Исследование уровня тромбоцитов назначают при отсутствии клинического анализа крови либо при получении в клиническом анализе крови патологических значений уровня тромбоцитов
Допустимо кратковременное наложение жгута, не более чем на 60 секунд. Жгут снимите сразу после того, как игла вошла в вену. Для забора крови на исследование свертывающей системы важно, что нельзя массировать вены, стучать по ним.
Используйте иглу для забора крови с внутренним диаметром 0,7—1 мм (размер 19—22).
Использование шприца недопустимо из-за активации тромбоцитов и факторов свертывания крови турбулентным движением крови и ее смешивания с воздухом (вспенивания). Оно исключается при использование вакуумных контейнеров.
После введения иглы в вену присоедините вакуумный контейнер, кровь начнет поступать в контейнер самотеком.
Кровь для коагулологического исследования берите во вторую пробирку, первую используйте для других исследований, например, биохимических. Если первой должна быть набрана пробирка, предназначенная для исследования свертывающей системы, первые 5 мл крови наберите в пустую пробирку и выбросьте, чтобы предотвратить попадание в пробу тканевого тромбопластина.
Кровь немедленно после взятия аккуратно перемешайте без вспенивания с антикоагулянтом (переверните пробирку 3—4 раза).
После забора биологического материала проверьте образец крови. Аккуратная проверка образцов крови позволяет избежать следующих ошибок: неправильное соотношение объемов кровь/цитрат; частично свернувшаяся кровь.
Кровь доставляют в лабораторию в течение 45 минут после ее забора. При транспортировке кровь нельзя сотрясать. Нельзя допускать транспортировку образцов крови при температуре меньше 4°С и выше 30°С.
Фельдшер-лаборант (медицинский технолог) осуществляет:
входной контроль доставленной крови, включающий: 1)проверку правильности заполнения направительного бланка. 2)проверку достаточности доставленного объема крови по метке на пробирке, 3)проверку образца на отсутствие сгустков при медленном наклоне пробирки.
центрифугирование доставленной крови с целью получения:
богатой тромбоцитами плазмы (параметры центрифугирования: число оборотов в минуту = 1000 об/мин (около 150—200g), время центрифугирования 5—7 минут.
Для выбора оптимальных условий центрифугирования ориентируются на центробежную силу (g). Можно воспользоваться формулой:
g = 1,118 х 0,00001r х n2,
где г — радиус центрифуги — расстояние в сантиметрах между осью ротора и центром пробирки в гнезде центрифуги; п — число оборотов в минуту.
бедной тромбоцитами плазмы (параметры центрифугирования: число оборотов в минуту = ~2500—3000 об/мин (около 1500—2000g), время центрифугирования 10—20 минут. Для полного удаления тромбоцитов проводится повторное центрифугирование, параметры центрифугирования остаются прежними.
3. После центрифугирования проверяет плазму на цвет и прозрачность: гемолизированный образец, иктерическая или липемическая (хилезная) плазма исследованию не подлежат.
После центрифугирования отбирает супернатант.
Желательно исследовать показатели гемостаза в течение 2 часов после взятия крови, но допускается исследование коагулологических показателей в течение 4 часов, если плазма была отделена от осадка эритроцитов и лейкоцитов.
При необходимости длительного хранения «свежие» пробы (не позже 2 часов после забора крови) бестромбоцитной плазмы можно однократно заморозить и хранить до 2 недель при температуре —20°С или до 6 месяцев при температуре —70°С. Размораживать плазму надо быстро в теплой воде (+36°С), тщательно перемешать и немедленно исследовать. После замораживания возможно изменение АЧТВ.
Методика приготовления микропрепаратов для гематологических исследований, методы фиксации и окраски.
Методика приготовления мазков крови для гематологических исследований.
Подготовка и обработка стекол. Новые чистые стекла могут использоваться после обезжиривания в смеси Никифорова (равные части 96% этилового спирта и эфира). Использованные стекла замачиваются в течение суток в теплом мыльном растворе или растворе стирального порошка (1 столовая ложка порошка на 5 л воды). Через сутки раствор сливают, стекла промывают проточной водой. Затем их снова заливают теплым мыльным раствором или раствором стирального порошка и доводят до кипения, кипятят в этом же растворе 5—10 мин (не более, во избежание помутнения стекол). После охлаждения раствора его снова сливают, прополаскивают стекла проточной водой и каждое стекло промывают щеткой под проточной водой. Обработанные таким образом стекла раскладывают на чистой простыне для высыхания. Чистые стекла для обезжиривания помещают в смесь Никифорова или 96% этиловый спирт на 60 мин, затем вытирают насухо и хранят в чистой посуде с широким горлом. Чистые стекла рекомендуется брать либо пинцетом, либо руками за боковые края.
Приготовление мазков. На сухое подготовленное предметное стекло ближе к короткой стороне наносят стеклянной палочкой (или непосредственно из места укола пальца) небольшую каплю крови. Оставляют стекло в горизонтальном положении и размазывают кровь по стеклу с помощью сухого чистого шлифованного стекла, держа его под углом 45°. Коротким ребром, подождав, пока вся кровь не расплывется по нему, быстро проводят по предметному стеклу. Сильно нажимать на предметное стекло не следует, так как это может привести к повреждению форменных элементов крови. Мазки высушивают на воздухе и маркируют (лучше простым карандашом). Высохший мазок должен быть равномерно тонким, желтоватого цвета, достаточной величины, располагаться на расстоянии 1,0—1,5 см от краев стекла, занимать почти всю длину стекла и заканчиваться «метелочкой». Толстые (густо-розового цвета) мазки использовать не следует, так как в них морфология клеток трудноразличима.
Стандартные качественные мазки получаются при использовании автоматических устройств, предназначенных для приготовления мазков и выпускаемых различными фирмами.
Фиксация и окраска мазков крови. Перед окраской мазки крови обычно фиксируют 5–10 мин в метиловом спирте для предотвращения гемолиза, который может произойти при контакте с водой в процессе окрашивания водорастворимой краской или при последующем контакте с водой. Методики фиксации описаны ниже вместе с методиками окраски. Для окраски по Райту и Лейшману фиксация не требуется, так как эти краски содержат метиловый спирт.
Сухие мазки могут храниться в течение 2 дней в сухом теплом месте, в жаркой влажной атмосфере без фиксации они хранятся значительно меньше.
Клетки крови содержат базофильные и ацидофильные структуры, различающиеся по реакции (pH). Ядра являются базофильными и окрашиваются в голубой цвет. Высоко базофильные (кислые) гранулы базофила также синие. Гемоглобин (будучи основным) окрашивается ацидофильно, т. е. в красный цвет. Окраска с помощью комбинации кислых и основных красителей называется окраской по Романовскому и имеет различные модификации (Паппенгейма, Райта, Нохта, Лейшмана, Гимзы, Джейнера и др.). В качестве основного красителя, как правило, используется метиленовый синий, но также применяется и толуидиновый синий. В качестве кислого красителя используются эозин, азур I и азур II.
Критерии хорошей окраски: розовый цвет эритроцитов, фиолетовое окрашивание зернистости нейтрофилов на розовом фоне, нежная азурофильная зернистость моноцитов.
Для разведения краски лучше всего использовать нейтральную свежую дистиллированную воду. Несвежая дистиллированная вода становится кислой из-за захвата углекислого газа из атмосферы. Если дистиллированная вода имеет щелочную реакцию, эритроциты окрашиваются в грязный голубовато-зеленый цвет; та часть лейкоцитов, которая должна окрашиваться голубым цветом, приобретает фиолетовый оттенок, гранулы эозинофилов становятся голубоватыми и зеленоватыми вместо розовых, а гранулы нейтрофилов перекрашиваются. При кислой воде эритроциты окрашиваются в ярко-оранжевый цвет, а ядра лейкоцитов очень бледные. Идеальной является дистиллированная вода с pH 7,0, для сохранения которой применяется ее забуферивание. Можно использовать готовые к употреблению буферные таблетки, растворяемые в дистиллированной воде.
Для окраски мазков костного мозга идеальной является краска с pH 7,4–7,5.
В качестве унифицированных приняты методики окраски по Нохту и Паппенгейму.
Реактивы для фиксации: 1) метиловый спирт или 2) раствор эозин-метиленового синего по Маю-Грюнвальду.
Реактивы для окраски мазков по Нохту: 1) основной раствор азура И: 1 г краски растворяют в 1 л дистиллированной воды, оставляют в посуде из темного стекла на 12—14 дней при комнатной температуре, после чего используют; 2) основной раствор эозина калия: 1 г краски растворяют в 1 л дистиллированной воды, оставляют в посуде из темного стекла на 12—14 дней при комнатной температуре, после чего используют; 3) фосфатный буфер (смесь Вейзе), pH 7,4—7,5: смешивают 0,49 г дигидрофосфата калия (KH2PO4) и 0,909 г гидрофосфата натрия (Na2HPO4) и растворяют в 1 л дистиллированной воды; 4) рабочий раствор азур-эозина: перед употреблением смешивают 25 мл основного раствора азура II, 20 мл основного раствора эозина калия и 55 мл буферного раствора (пропорции красителей могут варьировать, их устанавливают опытным путем при приготовлении свежих партий основных растворов).
Реактивы для окраски мазков по Паппенгейму: 1) раствор эозин-метиленового синего по Маю-Грюнвальду. При отсутствии готового раствора красителя его готовят растворением 1 г сухой краски в 1 л метилового спирта; 2) рабочий раствор азур-эозина по Нохту.
Фиксация мазков. Фиксирующий раствор наливают в кювету либо в широкогорлую посуду с притертой пробкой. Мазки помещают в контейнер, который погружают в кювету или кладут по одному в посуду на 5–10 мин. Контейнер со стеклами вынимают из фиксирующего раствора (или вынимают пинцетом стекла и устанавливают их в штативе) и оставляют на воздухе до полного высыхания.
Окраска по Нохту. Высохшие фиксированные мазки, не вынимая из контейнера, помещают в кювету с рабочим раствором краски на строго определенное время (20–45 мин), которое подбирают опытным путем для каждой партии краски. При отсутствии кюветы с контейнером стекла помещают горизонтально на параллельно положенные две стеклянные палочки («рельсы») мазком кверху и наливают на них по 3–4 мл рабочего раствора краски. Вынимают контейнер со стеклами из кюветы с красителем и помещают в кювету с водопроводной водой (при отсутствии контейнеров краску со стекол смывают водой, не снимая их со стеклянных палочек). Мазки высушивают на воздухе.
Окраска по Паппенгейму. Сухие нефиксированные мазки крови помещают в контейнер и опускают в кювету с раствором Мая—Грюнвальда на 3-5 мин (или на нефиксированный мазок наливают пипеткой 3—4 мл красителя). Контейнер с мазками ополаскивают в кювете с дистиллированной водой, а затем помещают в кювету с азур-эозиновой краской по Нохту на 8–15 мин. На стекла, помещенные на «рельсы», не сливая краситель, добавляют на 1 мин дистиллированную воду, а затем на 8–15 мин наливают на мазок краску, затем краску смывают водой. Мазки высушивают на воздухе.
Окраска по Романовскому—Гимзе. Производится так же, как по Нохту. В качестве красителя используют готовый раствор Романовского—Гимзы, который перед употреблением разводят из расчета 1 капля краски на 1 мл дистиллированной воды. Время окраски устанавливают опытным путем для каждой партии красителя (25–40 мин).
Окраска по Райту. Реактивы. 0,2 г краски Райта (сухой порошок, BDH/E. Merck) растворяют в 100 мл метилового спирта и дают постоять несколько дней. Если эритроциты окрашиваются недостаточно четко, готовят 0,25% или 0,3% раствор.
Ход окраски. На мазок наносят несколько (примерно 8) капель краски, выдерживают 2–3 мин (следят, чтобы краска не высохла), затем наливают на мазок равное количество забуференной воды. Если краска созрела, на поверхности разведенной краски появится пена или пленка с металлическим блеском. Разведенную краску оставляют на мазке на 2—3 мин, а затем смывают буферным раствором или водой. Нельзя допускать, чтобы краска осаждалась на поверхности мазка. Если это произошло, мазок заливают неразведенной краской на 15–20 с и затем еще раз буферным раствором или водой.
Приготовление фосфатного буфера.
Раствор А (0,2 М КН2PO4): 27,2 г соли растворить в 1 л дистиллированной воды.
Раствор Б (0,2 М Na2HPO4): 35,6 г Na2HPO4 × 2Н20 растворить в 1 л дистиллированной воды.
Для получения 100 мл буферного раствора с нужным pH следует слить растворы А и Б в количествах, указанных в таблице. Величину pH проверяют с помощью рН-метра.
Приготовление фосфатного буферного раствора
|
Раствор, мл |
Величина pH | ||||||
|
6,0 |
6,5 |
7,0 |
7,2 |
7,4 |
7,6 |
8,0 | |
|
А |
87,9 |
68,7 |
48,8 |
27,4 |
18,2 |
11,5 |
3,1 |
|
Б |
12,1 |
31,3 |
51,2 |
72,6 |
81,8 |
88,5 |
96,9 |
Окраска по Лейшману. Реактивы. 0,15 г сухой краски Лейшмана растворяют в 133 мл абсолютного метилового спирта. Краска должна полностью раствориться, желательно предварительно кристаллы краски растереть в ступке. Хранят краску в бутыли со стеклянной пробкой, не фильтруют.
Ход окраски. Осуществляют подобно окраске по Райту, но с двойным разведением буферного раствора. Несколько капель краски (около 8) наливают на мазок, выдерживают 2 мин. Добавляют двойное количество буферного раствора (16 капель), размешивают покачиванием и оставляют на 7–10 мин. Краску смывают дистиллированной водой за 2–3 секунды. При более длительном смывании окраска ухудшается. Мазки высушивают в штативе на воздухе.
Приготовление толстой капли крови. Три капли крови, нанесенные на предметное стекло на некотором расстоянии друг от друга, расширяют углом чистого предметного стекла до размера в диаметре примерно 1 см, маркируют карандашом, затем подсушивают на воздухе в течение 1–2 ч.
Окраска толстой капли крови. Толстые капли крови не фиксируют. Предметные стекла с хорошо просушенными толстыми каплями располагают на «рельсах» на некотором расстоянии друг от друга и на 8–10 мин наливают на них рабочий раствор азур-эозина по Нохту. Происходит «выщелачивание» эритроцитов. Затем краску сливают и на препараты наливают новую порцию рабочего раствора азур-эозина по Нохту на 30–35 мин. После этого предметные стекла осторожно ополаскивают дистиллированной водой и высушивают.
Автоматическая окраска мазков
Поскольку одной из наиболее востребованных функций в гематологической лаборатории являются приготовление и окраска мазков крови, естественны попытки их автоматизации.
Первая автоматическая система подготовки мазков была разработана компанией Sysmex (Япония) еще в 1990 г., и в настоящее время по всему миру установлено более 1600 систем. Огромный опыт, накопленный за этот период, был использован при разработке системы нового поколения — полностью автоматизированной станции подготовки и окраски мазков SP-1000i производительностью до 120 мазков в час. В SP-1000i реализуется высокая степень стандартизации и качества приготовления мазков благодаря использованию интеллектуального клинового метода, который дает возможность пользователю в зависимости от гематокрита исследуемой пробы регулировать объем наносимого образца крови, величину угла размазывающего лезвия, скорость нанесения и время ожидания, используя при этом от 8 до 16 различных уровней регулирования. Забор крови может осуществляться вручную или автоматически из открытых или закрытых пробирок. Автоматизированная станция подготовки и окраски мазков SP-1000i компании Sysmex (Япония)
В системе используется до семи гибко настраиваемых протоколов окраски, которые позволяют стандартизировать качество окраски мазков и удовлетворить самые высокие требования. Могут быть использованы следующие протоколы двойной и одиночной окраски: по Май-Грюнвальду—Гимзе, по Романовскому и по Романовскому—Гимзе. Мазки крови окрашиваются в выделенной кассетной системе, которая содержит только один слайд на кассету. При таком способе гарантируется хорошая взаимосвязь мазка крови с окрашивающими реагентами и при этом не происходит испарения метанола из реагента в воздух. Для гарантии хорошей фиксации крови перед окраской в процесс окраски интегрирован отдельный шаг по предварительной фиксации метанола.
Благодаря гибкости протокола окраски можно использовать специальный протокол для окраски костного мозга.
Методика приготовления мазков костного мозга для гематологических исследований.
Исследование костного мозга - миелограмма Первым вопросом, на который должно ответить исследование костного мозга является количественный аспект клеток. Хорошо известно, что в отношении периферической крови можно определить ряд цифровых значений количества и процента разных видов клеток, поскольку они находятся в свободном состоянии и относительно однородно распространены во взвеси сосудистой крови. Совершенно иное можно сказать о костном мозге: состав кроветворной ткани весьма разнородный и распределение костномозговых клеток неодинаково. Так, прямое счисление миелокариоцитов в камере колеблется в очень широких пределах, как при нормальном состоянии, так и в рамках той же болезни. Выявленные нами значения у лиц в норме колебались от 27 000 до 112 000 ядерных элементов на мм3 (Урся). Литературные данные колеблятся в еще более широких пределах, их лимиты составляют 12 000 и 300 000 на мм3 (Cartwright, Page). После центрифугирования в трубке гематокрита обнаруживаются следующие 4 слоя: 1) верхний жирный желтый слой; 2) плазма; 3) серо-белесый слой, образованный из ядерных клеток; 4) красный слой, составленный из эритроцитов. Измерение серо-белесового слоя из ядерных клеток (миелокрит) представляет ограниченное значение или даже вводит в заблуждение, поскольку выявленные значения у лиц в норме также дают значительные колебания. К тому же ядерные клетки обнаруживаются не только в этом слое, но также в жировом и эритроцитном слоях. Но из серобелесового слоя можно приготовить мазки костномозгового концентрата после устранения надосадочной плазмы. Они доказали свою пользу в процессе диагностирования в тех случаях, когда прямые мазки бедны клетками. Учитывая, что счисление в камере миелокариоцитов и определение миелокрита дают лишь приблизительные результаты с ограниченным воспроизведением, эти методы количественного определения не удовлетворительны. Извлекаемый при отсасывающей пункции материал составляет образец костного мозга, смешанного с кровью в различной пропорции. Степень разбавления костного мозга кровью зависит от ряда факторов. Мечение 32Р доказало, что разбавление отсасываемого костного мозга кровью колеблется от 40% до 100%. Впрочем следует отметить, что исследование костного мозга в целях постановки диагноза основывается, в первую очередь, на качественное исследование клеточного содержимого, а лишь второстепенно на количественные значения этого содержимого. Вот почему количественные методы определения костномозговых клеток состоят из полуколичеставенной оценки клеточного состава костного мозга, по сравнению с нормальными пробами, на: а) мазках с размозженными комочками; б) гистологических срезах. Исследование мазка проводится, в основном, сухим объективом, на нескольких мазках, при этом намечаются следующие цели: а) полуколичественная оценка костномозговой клеточной массы; б) определение наличия и плотности мегакариоцитов; в) выявление гигантских клеток или гнезд ненормальных клеток; г) отождествление наиболее подходящих участков для проведения исследования путем погружения. На мазках, полученных путем размозжения частиц костного мозга различаются следующие три концентрические зоны: а) центральная; б) внешняя; в) промежуточная. Центральную зону образуют жировые вакуоли, клетки стромы, гранулоциты и многочисленные разрушенные клетки. Внешняя зона содержит большое количество крови, которая разжижает костномозговые клетки. Подобно тонким мазкам она способствует лишь исследованию морфологических подробностей миелоидных клеток и эритроцитов. В промежуточной зоне находится наиболее плотная клеточная масса, что допускает оптимальное исследование, которое может выяснить все намечаемые вопросы. Здесь костномозговые клетки хорошо сохранены и расположены островками или гнездами, именно так, как наблюдается в костном мозге. Сохраняя костномозговую топографию получаемые результаты исследования этой зоны однороднее и соответствуют фактическому состоянию костного мозга, что подтверждается сопоставлением с его гистологическими изображениями. Полуколичественное определение клеточной плотности выражается в виде: а) нормального, б) богатого или в) скудного по сравнению с нормой костного мозга. Выявление нормальной или обильной клеточной массы представляет ценный результат, в то время как скудный костный мозг следует рассматривать с предосторожностью. Чтобы доказать наличие фактической гипоплазии следует рассмотреть несколько пластинок, сделать пункцию в нескольких костных территориях и/или биопсию костей. Наиболее точные сведения о костномозговой клеточной массе получаются исследованием гистологических срезов. У взрослого человека в норме отношение пространства, занимаемого жиром и активной клеточной паренхимой составляет 1 : 1 или 2:1. Некоторыми авторами костный мозг рассматривается гипоклеточным когда кроветворные клетки занимают менее четверти костномозговых комочков. Качественное исследование костного мозга существенно для постановки диагноза. Оно проводится, с помощью погружения, как на тонких мазках, так и, в частности, на мазках с размозженными комочками из промежуточной зоны. Рекомендуется отбор наилучших правильно растянутых и окрашенных мазков с четко выделяющимися и морфологически хорошо законсервированными клетками. Это исследование намечает: а) выявление различных видов миелоидных клеток; б) определение степени созревания каждого клеточного ряда; в) уточнение отношения между гранулоцитами и эритробластами(Г/Э);: г) отождествление клеток на фазе митоза; д) описание встречающихся атипических клеток. После исследования нескольких мазков составляется либо подробная описательная «миелограмма» (содержащая сделанные, после расшифровки мазков, заключения), либо миелограмма в процентном отношении, установленная по не менее 300—500 элементам. Существуют два способа составления процентной миелограммы: 1) отнесение остальных клеточных рядов к 100 гранулоцитам; 2) процентное отображение каждого вида клеток из всего количества костномозговых клеток. Со статистической точки зрения последний способ представляется более правильным и видимо отражает реальную картину клеточного состава костного мозга. Установленные отдельными авторами формулы значительно разнятся, поскольку трудно определить реальныесредние величины в столь разнородном ткани, как костный мозг. В таблице приведены, по Wintrobe, результаты исследованияотобранных костномозговых проб от 12 лиц в норме. Нормальная миелограмма
Показатели миелограммы Среднее значение (%) Пределы колебаний (%)
Ретикулярные клетки 0,9 0,1-1,6 Недифференцированные бласты 0,6 0,1-1,1 Миелобласты 1,0 0,2-1,7
Промиелоциты 2,5 1,0-4,1
Миелоциты нейтрофильные 9,6 7,0-12,2 Метамиелоцитынейтрофильные 11,5 8,0-15,0 Палочкоядерные нейтрофилы 18,2 12,8-23,7 Сегментоядерные нейтрофилы 18,6 13,1-24,1 Всего клеток нейтрофильного ряда 60,8 52,7-68,9 Миелоциты эозинофильные 0,1 0,0-0,2 Метамиелоциты эозинофильные 0,2 0,1-0,4 Эозинофилы 2,8 0,4-5,2
Всего клеток эозинофилъного ряда 3,2 0,5-5,8 Миелоциты базофильные 0,1 0-0,3
Базофилы 0,1 0-0,3
Всего клеток базофильного ряда 0,2 0-0,5 Лимфобласты 0,1 0-0,2
Пролимфоциты 0,1 0-0,2
Лимфоциты 8,8 4,3-13,3
Всего клеток лимфоидного ряда 9,0 4,3-13,7 Монобласты 0,1 0-0,2
Моноциты 1,9 0,7-3,1
Плазмобласты 0,1 0-0,2
Проплазмоциты 0,1 0,1-0,2
Плазматические клетки 0,9 0,1-1,8
Эритробласты 0,6 0,2-1,1
Нормобласты базофильные 3,6 1,4-5,8 Нормобласты полихроматофильные 12,9 8,9-16,9 Нормобласты оксифильные 3,2 0,8-5,6
Всего клеток эритроидного ряда 20,5 14,5-26,5 Мегакариоциты 0,4 0,2-0,6
По нашим исследованиям на здоровых людях результаты следующие:
ряд гранулоцитов 56—70%,
эритробластический ряд 23—30%, лимфоплазмоцитный ряд 5—10%, моноцитомакрофаговый ряд 1—2% и мегакариоцитный ряд 0,1—0,8% (Урся). Изменение пропорции нормальных миелоидных рядов или их замена аномальными клетками нередко подсказывает вид болезни. Ретикулярные клетки появляются реже и притом в небольшом количестве. Совершенно случайно на мазках (или на отпечатках костного мозга) попадаются остеобласты и/или остеокласты, которые не следует принимать за неопластические клетки. Их наличие чаще отмечается у детей, реже у взрослых при первичном миелофиброзе или вторично, после карциноматозного метастаза, при острой лейкемии, остеопорозе и пр. Отношение Г/Э получается делением гранулоцитов на число эритробластов. У взрослого в норме это отношение составляет в среднем 3/1 или 4/1, при этом пределы оцениваются в 2/1 (когда включены лишь незрелые гранулоциты) и 5/1 (когда касается всех гранулоцитов — зрелых и незрелых). Отношение Г/Э колеблется с возрастом: при рождении невелик (1,8/1), в 2-недельном возрасте повышается до 11/1, затем постепенно понижается, а у годовалых детей достигает значений взрослого человека. Отношение Г/Э нормальное в случаях глобальной костномозговой гипо- или гиперплазии, равно как и при пролиферации отдельных клеток, не входящих в расчет этого отношения, например при плазмоцитоме. При лейкемиях, лейкомеподобных реакциях и эритробластопениях отношение высокое, в то время как при анемиях с эритробластической гиперплазией оно низкое или обратное (мегалобластическая, гемолитическая анемии). До выдачи данных миелограммы, полученных после исследования мазков, необходимо уточнить: а) место пункции; б) плотность кости; в) условия, в которых протекало отсасывание; г) макроскопический аспект отобранного материала. Исследование костного мозга комплексный процесс, основывающийся на интеграцию многочисленных и разнообразных данных. Его результат должен отражать выводы общего характера, основывающиеся больше на умозаключение, чем на механическую регистрацию отдельных цифр, которые, к тому же, колеблятся. Заключение любой миелограммы должно уточнить либо диагноз, либо указания для дополнительных исследований, вытекающих из исследования костного мозга. При заболеваниях крови отсасывающая пункция способствует уточнению диагноза с помощью мазков и срезов с комочками в 80% случаях. В остальных случаях показана костная биопсия и гистологическое исследование костного мозга. Биоптический отбор и гистологическое исследование представляются необходимыми при: а) первичном или вторичном миелофиброзе; б) костномозговой аплазии или гипоплазии; в) заболеваниях, протекающих с поражениями грануломатозного типа (напр., болезнь Годжкина, саркоидоз, туберкулез и пр.); г) карциноматозном метастазе; д) во всех случаях, когда отобранный с помощью пункции материал оказывается неудовлетворительным или аспект костного мозга не убедительный. После биоптического отбора пробы приготовляются отиски для проведения цитологического исследования, поскольку гистологические срезы предоставляют мало сведений о структурных подробностях кроветворных клеток, находящихся в скученном, не рассеянном и неэталированном виде. К тому же закрепление вызывает ретракцию клеток и гистологическая окраска менее селективна, чем цитологическая. Вот почему полное исследование костного мозга предполагает, как цитологическое — на мазках или оттисках, так и гистологическое — на срезах исследования. Необходимо помнить, что цитологические и гистологические методы исследования костного мозга не исключаются а, наоборот, взаимодополняются: биопсия — количественный и архитектурный метод, в то время как миелограмма — качественный и цитологический.
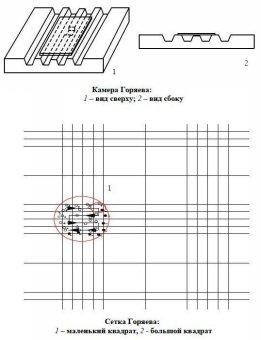
Методика подсчета форменных элементов крови в камере Горяева.
|
Камера Горяева — приспособление, предназначенное для подсчета количества клеток в заданном объёме жидкости. Обычно ее используют для определения числа форменных элементов в образце крови. Камеры состоят из толстого предметного стекла с нанесенными на них поперечными прорезями, образующими три поперечно расположенные плоские площадки. Средняя площадка продольной прорезью разделена на две, каждая из которых имеет выгравированную на ней сетку. По обе стороны средней площадки в камере Горяева расположены две других на 0,1 мм (в камере Фукс-Розенталя на 0,2 мм) выше средней. Плоскости этих площадок служат для притирания покровного стекла до появления так называемых Ньютоновских колец. После притирания покровного стекла создается камера, закрытая с двух боковых сторон, а с двух других остаются щели (капиллярные пространства), через которые и заполняют камеру. Принцип сеток один и тот же. Они разделены на то или иное число квадратов, различным образом сгруппированных. Постоянной величиной во всех сетках является так называемый «малый квадрат», сторона которого равна 1/20 мм, следовательно, его площадь равна 1/400 мм2.
При помощи камеры Горяева возможно также определить увеличение микроскопа. Внешне представляет собой прозрачный параллелепипед (предметное стекло), с бороздами и нанесённой микроскопической сеткой. Размеры малых делений клетки сетки составляют 0,05 мм, а больших — 0,2 мм. При этом сетка нанесена на площадку (участок стекла), расположенный на 0,1 мм ниже, чем две соседние площадки. Эти площадки служат для притирания покровного стекла. В результате объем жидкости над квадратом, образованным большими делениями сетки Горяева, составляет 0,004 микролитра. Подсчитав количество клеток над большим квадратом можно подсчитать плотность данного типа клеток в суспензии по формуле: Количество клеток/мл = количество клеток над большим квадратом * 2,5•10^5 Используя камеру Горяева как своеобразный эталон можно определить увеличение микроскопа по формуле: Kg=(m2-m1)/(a*N)
где kG — это увеличение микроскопа; m1 — положение левой границы клетки камеры Горяева; m2 — положение правой границы клетки или группы клеток; N — количество клеток между измеряемыми границами; a — размер клетки камеры Горяева (равен 0,05 мм). Камера Горяева также используется для подсчёта количества клеток в культуре.[1] Формула для подсчета кровяных телец в камере Горяева - x = (а · 400 · в) / б , где x — искомое количество форменных элементов в 1 мм3; а — сумма форменных элементов, сосчитанных в определенном объеме камеры; б — количество сосчитанных малых квадратов; в — разведение крови. |
|
|
|
Метод подсчета ооцист в камере Горяева.
Этим методом обычно пользуются при экспериментальном заражении животных точно установленным количеством ооцист (животному вводится соответствующее количество миллилитров взвеси). 1 мл взвеси, содержащей ооцисты, помещают в камеру Горяева. Поскольку объем камеры Горяева составляет 0,9 м3, количество подсчитанных ооцист умножается на 1111. Полученное число адекватно количеству ооцист в 1 см 3 раствора. Для более точного определения расчеты следует проводить не менее трех раз, а затем вывести среднюю арифметическую величину. Нужное для заражения количество ооцист отмеряют с помощью градуированной пипетки. Для более равномерного распределения ооцист в инкубационной среде содержимое пробирки необходимо неоднократно встряхнуть. |
|
Подсчет эритроцитов в камере Горяева Принцип. Точное количество крови равномерно смешивают в определенном количестве жидкости и помещают в камеру с известным объемом в котором взвесь крови распределяется одним слоем. Дно камеры разграфлено, благодаря чему возможен точный подсчет эритроцитов.
Реактивы: 0,9%-ный раствор натрия хлорида.
Специальное оборудование: микроскоп, камера Горяева, пробирки лабораторные или капилляр от гемометра Сали.
Ход определения. В сухую чистую пробирку вносят 8 мл 0,9%-ного раствора натрия хлорида и капиллярной пипеткой 0, 02 мл крови. Предварительно кончик пипетки вытирают, кровь выдувают на дно пробирки, а пипетку тщательно промывают верхним слоем жидкости. Содержимое пробирки хорошо перемешивают. Получают разведение крови 1 : 400, т. е. кровь разбавляют в 400 раз. При сгущении крови ее целесообразно разбавить в 500, 600, 700, 800 раз.
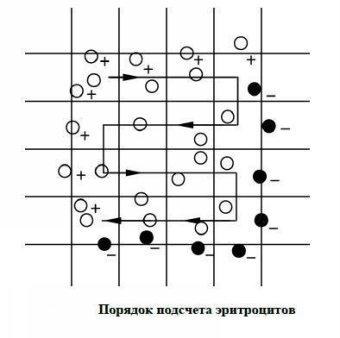
Камера и покровное стекло должно быть вымыты и насухо вытерты. Покровное стекло притирают к камере так, чтобы появились радужные кольца. Берут каплю разведенной крови из пробирки и заполняют ею камеру, нанося к краю покровного стекла Эритроциты подсчитывают через 1 мин после заполнения камеры под малым увеличением микроскопа (объектив х8, окуляр х10 или х 15) с прикрытой диафрагмой или опущенным конденсатором (в затемненном поле зрения).
Эритроциты подсчитывают в пяти больших (или 80 малых) квадратах, расположенных по диагонали. Учитывают эритроциты, лежащие внутри малого квадрата, а также на левой и верхней его стенках. Клетки, находящиеся на правой и нижней линиях квадрата, не считают.
Расчет: Подсчитанное число клеток в 80 малых квадратах умножают на 20 000 при разведении крови 1 : 400, на 25 000 при разведении 1 : 500 или на 30 000 при разведении 1 : 600 и получают окончательный результат в миллионах в 1 мкл. При этом исходят из того, что объем одного малого квадрата равен 1/4000 мкл. Для подсчета клеток в 1 л количество эритроцитов в 1 мкл еще умножают на 1 000 000.
Примечание. Не допускается исследование крови со сгустками; подсчет клеток тотчас после заполнения камеры (не выжидая 1 мин); использование плохо вымытых и просушенных пипеток и пробирок, недоброкачественных реактивов, вызывающих гемолиз. При соблюдении всех правил подсчета ошибка составит в среднем ±2,5 %. |
|
Правила дезинфекции После использования камеру Горяева необходимо продезинфицировать 3% раствором перекиси водорода, промыть дистиллированной водой и вытереть мягкой салфеткой. Хранить камеру следует в сухом месте. |
Методика работы на гематологических анализаторах.
Анализа́торгематологи́ческий — прибор (комплекс оборудования), предназначенный для проведения количественных исследований клеток крови в клинико-диагностических лабораториях. Может быть автоматическим или полуавтоматическим. Полуавтоматический гематологический анализатор от автоматического отличается тем, что процесс разведения пробы крови осуществляется отдельным прибором - дилютером. После приготовления разведения цельной крови оператор должен перенести разведенную пробу в модуль измерения. В настоящее время полуавтоматические анализаторы практически не выпускаются.
Автоматический гематологический анализатор представляет собой полностью автоматизированный прибор, в котором весь аналитический процесс выполняется автоматически.
Современные автоматические анализаторы способны обрабатывать десятки образцов (от 60 до 120) в час, с соответствующей спецификации точностью и воспроизводимостью, а также хранить результаты тестов во встроенной памяти и, при необходимости, распечатывать их на встроенном термопринтере или внешнем принтере.
Современные гематологические анализаторы классифицируются по номенклатуре определяемых показателей клеток крови.
Восьми-параметровые гематологические анализаторы определяют следующие параметры: концентрации эритроцитов (RBC), лейкоцитов (WBC), тромбоцитов(Plt), гемоглобина (Hb), а также следующие параметры эритроцитов: средний объем эритроцитов (MCV), среднее содержание гемоглобина в эритроцитах (MCH), среднюю концентрацию гемоглобина в эритроцитах (MCHC), гематокрит (Hct).
Восьми параметровые гематологические анализаторы в настоящее время практически не производятся.
Гематологические анализаторы класса 3-диф. Гематологические анализаторы класса 3-диф, в зависимости от выпускаемой модели, позволяют определять от 16 до 22 показателей клеток крови. Анализаторы этого класса, помимо тех параметров, которые определяют восьми-параметровые анализаторы определяют три субпопуляции лейкоцитов: концентрации лимфоцитов (Lm), гранулоцитов (Gr) и, так называемых средних лейкоцитов (Mid), а также их процентное содержание Lm%, Gr% и Mid%. Отсюда и название класса 3-диф. Кроме этого гематологические анализаторы этого класса определяют коэффициент вариации объема эритроцитов (RDW) и ряд показателей, характеризующих тромбоциты: средний объем тромбоцитов (MPV), долю объема тромбоцитов(Tct) (аналог гематокрита), коэффициент вариации объема тромбоцитов (PDW).
Важной диагностической информацией, которую позволяет получить гематологические анализаторы этого класса, являются функции распределения по объему эритроцитов, лейкоцитов и тромбоцитов - гистограммы.
Гематологические анализаторы класса 5-диф. Основным отличаем гематологических анализаторов 5-диф от анализаторов 3-диф является их способность определять все 5 субпопуляций лейкоцитов: лимфоциты (Lym), моноциты (Mon), нейтрофилы (Neu), базофилы (Bas) и эозинофилы (Eos), а также их процентное содержание Lym%, Mon%, Neu%, Bas% и Eos%. Импедансный метод подсчета, известный также как счетчик Коултера, применяемый в анализаторах 3-диф, не в состоянии различить нейтрофилы, базофилы и эозинофилы, по этому в анализаторах 5-диф применяется иной метод дифференцировки клеток. Он основан на принципе дифракции лазерного излучения на клетках лейкоцитов и дальнейшем анализе рассеянного излучения. "Средние" лейкоциты не отличаются по размеру настолько что бы различать их импедансным методом, но имеют различную внутреннюю структуру и по разному взаимодействуют с красителями. А метод детектирования дифракционной картины оказывается чувствительным ко внутренней структуре клеток. Таким образом эритроциты и тромбоциты подсчитываются счетчиком Коултера, а лейкоциты отдельным лазерным блоком.