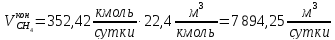- •Российский химико-технологический университет им. Д.И.Менделеева Кафедра общей химической технологии
- •Материальные и тепловые расчеты процесса 2-х ступенчатой конверсии метана в производстве аммиака
- •Задание на курсовую работу
- •Расчетная часть
- •1. Расчет исходных потоков всех компонентов системы.
- •2. Расчет теплового баланса и степени превращения после реактора №1.
- •3. Покомпонентный материальный баланс системы.
- •Описательная часть
- •1) Показать схематично последовательность стадий (привести функциональную схему) производства аммиака из природного газа методом паровоздушной конверсии и дать краткое описание каждой стадии.
- •2)Изобразить схематично все типы химических реакторов, которые используются на различных стадиях производства аммиака с обоснованием их использования.
- •3)Составить структурную схему производства аммиака с указанием основных аппаратов.
- •4) Привести технологическую схему отдельной стадии процесса (по указанию преподавателя). Синтез аммиака3
- •Библиографический список
Российский химико-технологический университет им. Д.И.Менделеева Кафедра общей химической технологии
Курсовая расчетная работа по теме
Материальные и тепловые расчеты процесса 2-х ступенчатой конверсии метана в производстве аммиака
Выполнил: студент группы
Проверил: преподаватель кафедры ОХТ
Дата сдачи:
Москва 2016
Задание на курсовую работу
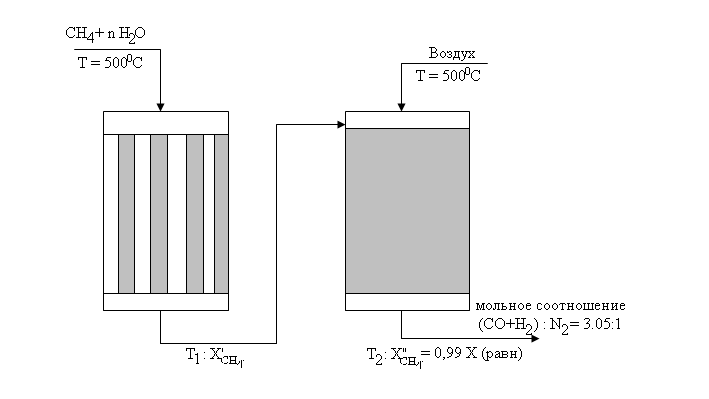
Схема процесса
Исходные данные
Вариант №28 (333555);
Температура (Т1) – 820°С;
Температура (Т2) – 1020°С;
Производительность аммиака – 1200 т/сутки;
Концентрация азота в природном газе – 5,5% об;
Потери АВС (N2+H2) с продувочным газом –9% об.;
Коэффициент избытка водяного пара (n) – 4,0;
Давление на стадии конверсии метана – 1 ат;
Индивидуальное задание по п. 4 описательной части: стадия синтеза аммиака.
Химическая схема:
1-ый реактор:
СH4 + H2O = 3Н2 + СО – 206,4 кДж/моль (1)
2-ой реактор:
СH4 + H2O = 3Н2 + СО – 206,4 кДж/моль (2)
H2 + ½ O2 = H2O + 242,0 кДж/моль (3)
Задание:
а) расчетная часть:
1) Рассчитать исходные потоки всех компонентов системы;
2) Составить тепловой баланс 2-ого реактора и рассчитать степень превращения метана после первого реактора;
3) Составить материальный баланс процесса покомпонентно, результаты расчетов представить в виде таблицы.
б) описательная часть:
1) Показать схематично последовательность стадий (привести функциональную схему) производства аммиака из природного газа методом паровоздушной конверсии и дать краткое описание каждой стадии.
2) Изобразить схематично все типы химических реакторов, которые используются на различных стадиях производства аммиака с обоснованием их использования.
3) Составить структурную схему производства аммиака с указанием основных аппаратов.
4) Привести технологическую схему отдельной стадии процесса (по указанию преподавателя). Обосновать выбор технологического режима и типа реактора для реализации химического процесса.
Расчетная часть
1. Расчет исходных потоков всех компонентов системы.
По условию задания производительность установки по аммиаку– 1200 т/сутки. Тогда производительность в кг/сутки и кмоль/сутки составит:


Известно, что аммиак получается в результате реакции:
N2 + 3 H2 = 2 NH3
На образование одного объема аммиака расходуется два объема азотно-водородной смеси (далее – АВС) согласно уравнению реакции:
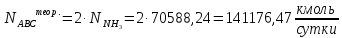
При продувке часть АВС теряется (потери составляют по условию задания 9% об.), тогда начальное количество АВС составляет:

Рассчитаем количество азота и водорода, необходимое для получения заданного количества АВС. Теоретически на образование 2 кмоль аммиака расходуется 3 кмоль водорода, который образуется в результате реакции:
СО + H2O = Н2 + СО2
Но данная реакция является обратимой, поэтому не идет до полного израсходования монооксида углерода. Тогда коэффициент, учитывающий неполное превращения СО в водород будет равен:
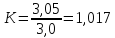
Для водорода:

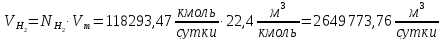
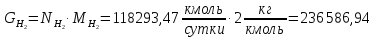
Для азота:
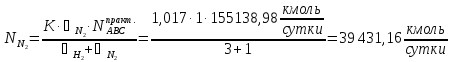
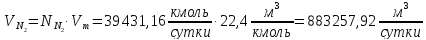
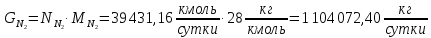
Для монооксида углерода:

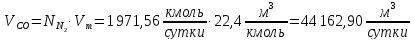

Далее рассчитаем количество исходного природного газа, воздуха и воды.
Водород и АВС образуется при конверсии природного газа (точнее, метана) согласно следующим уравнениям реакции:
СH4 + H2O =3H2 + CO
СО + H2O = Н2 + СО2
Суммарно получаем:
СH4 + H2O + СО + H2O = 3H2 + CO + Н2 + СО2
СH4 + 2H2O = 4H2 + СО2
Также необходимо учесть, что подаваемый в составе воздуха кислород расходуется полностью на сгорание образованного водорода по реакции:
O2 + 2H2 = 2H2O
Степень превращения исходного природного газа на выходе из всей системы составит 0,99·Хp, где Хp – равновесная степень превращения. Равновесная степень превращения для Т2 = 1020 + 273 = 1 293 К, давлении 1 ат (~ 0,1 МПа) и соотношении пар:газ = 4:11:

Тогда степень превращения метана после двух ступеней конверсии будет равна:
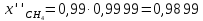
Составим систему уравнений для нахождения неизвестных величин. Азот не вступает в реакции, приходит из воздуха и природного газа.
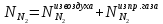
Водород образуется при газификации метана, а также расходуется на реакцию сгорания:

Приведём систему
уравнений к системе с двумя неизвестными
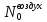 и
и
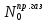 – исходные количества воздуха и
природного газа, соответственно:
– исходные количества воздуха и
природного газа, соответственно:

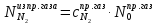
Из брутто-уравнения следует, что из одного моля CH4 образуется 4 моля H2, c учётом степени превращения:
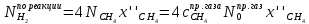
На сгорание 1 моля кислорода расходуется два моля водорода:

Получаем систему уравнений:
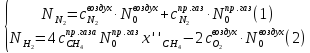
Для расчёта примем, что воздух сухой, состоит только из кислорода и азота, в соотношении 0,21:0,79 об.доли, соответственно.
Выразим
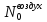 из уранения (1), подставим в (2):
из уранения (1), подставим в (2):

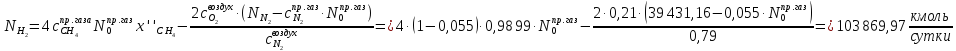

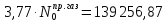
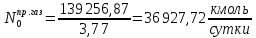
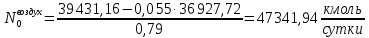
Найдём количество метана и азота в природном газе:
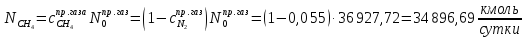
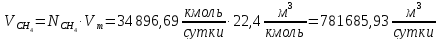
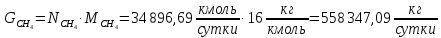
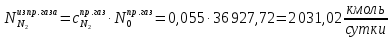

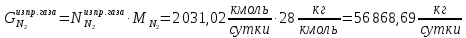
Рассчитаем количество исходное количество воды:
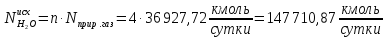
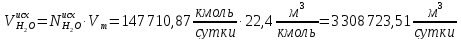
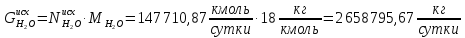
Найдём количество кислорода и азота в воздухе:
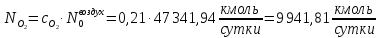
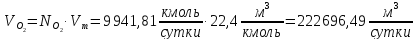

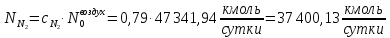
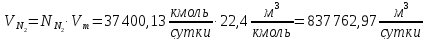
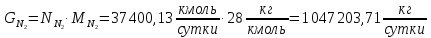
Вода в процессе расходуется по 1 реакции и образуется по 2 реакции:
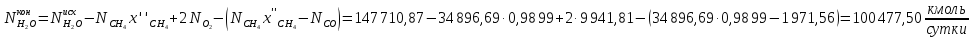
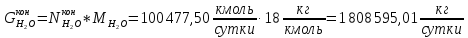
Образовавшийся диоксид углерода:
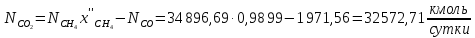
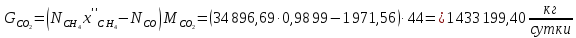
Количество метана, оставшегося после реакции: