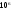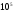KR_fizkhim_abramovsky
.docx|
МИНИСТЕРСТВО ОБРАЗОВАНИЯ И НАУКИ РОССИЙСКОЙ ФЕДЕРАЦИИ |
||||||||||||||||||||||||||
|
Федеральное государственное автономное образовательное учреждение высшего профессионального образования |
||||||||||||||||||||||||||
|
«Северный (Арктический) федеральный университет им. М.В.Ломоносова» |
||||||||||||||||||||||||||
|
|
Кафедра теоретической и прикладной химии |
|
||||||||||||||||||||||||
|
|
(наименование кафедры) |
|
||||||||||||||||||||||||
|
|
|
|
||||||||||||||||||||||||
|
|
Хорошев Олег Юрьевич |
|
||||||||||||||||||||||||
|
|
(фамилия, имя, отчество студента) |
|
||||||||||||||||||||||||
|
|
|
|
||||||||||||||||||||||||
|
|
Институт |
ТиПХ |
курс |
2 |
группа |
504 |
|
|
||||||||||||||||||
|
|
|
|
||||||||||||||||||||||||
|
|
|
|
||||||||||||||||||||||||
|
|
|
|
||||||||||||||||||||||||
|
|
КУРСОВАЯ РАБОТА |
|
||||||||||||||||||||||||
|
|
Физическая химия |
|
||||||||||||||||||||||||
|
|
По дисциплине |
|
|
|
|
|
|
|
||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||
|
|
На тему |
|
|
|
|
|
|
|
||||||||||||||||||
|
|
|
(наименование темы) |
|
|||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||
|
|
Работа допущена к защите |
|
|
|
|
|||||||||||||||||||||
|
|
|
|
(подпись руководителя) |
|
(дата) |
|
||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||
|
|
Признать, что работа |
|
|
|
||||||||||||||||||||||
|
|
выполнена и защищена с оценкой |
|
|
|
||||||||||||||||||||||
|
|
|
|
|
|
||||||||||||||||||||||
|
|
|
|
|
|
||||||||||||||||||||||
|
|
Руководитель |
|
|
|
|
|
|
|||||||||||||||||||
|
|
|
|
(должность) |
|
(подпись) |
|
(и.,о., фамилия) |
|
||||||||||||||||||
|
|
|
|
|
|
|
|
|
|||||||||||||||||||
|
|
|
|
(дата) |
|
|
|
|
|
||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||
|
|
Архангельск |
|
||||||||||||||||||||||||
|
|
2015 |
|
||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||
ЛИСТ ЗАМЕЧАНИЙ
____________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
Оглавление
ЗАДАНИЕ НА КУРСОВУЮ РАБОТ
КУРСОВАЯ РАБОТА 1
1 ПЕРВЫЙ ЗАКОН ТЕРМОДИНАМИКИ (ЗАКОН КИРХГОФА)
Вариант №2
Вывести аналитическую зависимость теплового эффекта (Дж/кмоль) реакции от температуры, если известен тепловой эффект этой реакции при 298 К. Вычислить тепловой эффект реакции при температуре Т0.
С2H6=C2H4+H2
|
|
|
A |
b·10-³ |
c· |
c´· |
|
С2H6 |
-84.67 |
5.75 |
175.11 |
-37.9 |
- |
|
C2H4 |
52.30 |
11.32 |
122.01 |
-57.85 |
- |
|
H2 |
0 |
27.28 |
3.86 |
- |
0.502 |
Уравнение зависимости Ср=f(T) имеет вид:
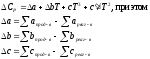

Находим тепловой эффект реакции.
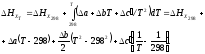
где тепловой эффект этой реакции при температуре 298 К равен:
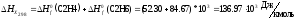
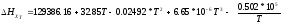
Находим тепловой эффект при 400 К.
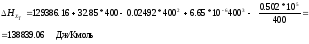
2 ВТОРОЙ ЗАКОН ТЕРМОДИНАМИКИ
Вариант №21
Рассчитать изменение энтропии при нагревании /охлаждении/ при постоянном давлении в интервале температур от Ti до Т2 g кг. вещества А, если известны его температура плавления и кипения, теплоемкость в твердом, жидком и газообразном состоянии, теплоты плавления и испарения. Средние теплоемкости веществ во всех агрегатных состояниях, теплоты плавления и испарения найти по справочнику химика.
|
Вещество А |
g, кг |
Т1, К |
Т2, К |
Ср г, калл/г*гр |
Срж,калл/г*гр |
Ср тв, калл/г*гр |
|
С8H10, о-ксилол |
60 |
423 |
223 |
0,36 |
0,425 |
0,33 |
Охлаждение:
Газообразное
Тпл
Т2
Твердое
Т1
Ткип
Tпл= 247,8 К; Ткип= 417,4 К;
ΔHпл = 3,25 калл/моль; ΔНисп.= 8,8 калл/моль;
Т1= 423 К; Т2= 223 К.
Переведем теплоты плавления и испарения в единицы измерения Дж/моль:
ΔНпл= 3,25*103*4,1868 = 13607,1 Дж/моль;
ΔНисп= 8,8*103*4,1868 = 36849,8 Дж/моль;
Переведем теплоемкость в твердом, жидком и газообразном состоянии в единицы измерения Дж/К:
Ср г= М*0,36*4,187= 106*0,36*4,187 = 159,8 Дж/(моль*К)
Ср ж= М*0,425*4,187= 106*0,425*4,187 = 188,6 Дж/(моль*К)
Ср тв= М*0,33*4,187= 106*0,33*4,187 = 146,5 Дж/(моль*К)
Рассчитаем изменение энтропии при охлаждении:
ΔS/ = Cp г*ln(Tкип / Т1) – ΔНисп / Ткип + Cp ж*ln(Tпл / Ткип) – ΔНпл / Тпл + Cp тв*ln(T2 / Тпл) = 159,8*ln(417,4 / 423) – 36843,8 / 417,4 + 188,6* ln(247,8 / 417,4) – 13607,1 / 247,8 + 146,5*ln(223 / 247,8) = -272,42 Дж/моль*К
Вычислим количество вещества А ( С10Н8О, α-нафтол):
n = m / M = 60000 / 106 = 566,04 моль
Окончательно получаем:
ΔS = ΔS/*n = -272,42*566,04 = -154,2 кДж/К
Ответ: ΔS=-154,2кДж/К
3 ФАЗОВЫЕ РАВНОВЕСИЯ: ЖИДКИЕ СИСТЕМЫ
Вариант №10
Дана зависимость составов жидкой (X) и газообразной (Y) фаз от температуры (Т) для бинарной жидкой системы А – В при постоянном давлении P. Составы X и Y выражены в молярных процентах вещества A.
1. Построить график зависимости состава пара (Y) от состава жидкой фазы (X) при постоянном давлении.
2. Построить график зависимости “состав – температура кипения”.
3. Определить температуру кипения системы, содержащей а молярных процентов компонента A; каков состав первого пузырька пара, при какой температуре исчезнет последняя капля жидкости и каков ее состав.
4. Определить состав пара, находящегося в равновесии с жидкой бинарной системой при температуре Т1.
5. При помощи какого эксперимента можно установить состав жидкой бинарной системы, если она начинает кипеть при температуре Т1 (при наличии диаграммы “состав – температура кипения”)?
6. Какой компонент и в каком количестве может быть выделен из системы, состоящей из б кг вещества A и в кг вещества B?
7. Какого компонента и какое количество надо добавить к указанной в пункте 6 смеси, чтобы получилась азеотропная смесь?
8. Какое количество вещества A (кг) будет в парах и жидкой фазе, если 2 кг смеси, содержащей a % вещества A, нагреть до температуры T1?
9. Определить вариантность системы в азеотропной точке.
|
Система |
Состав A, мол% |
T, К |
P·10-4, Н/м2 |
||||||||||
|
X |
Y |
||||||||||||
|
A – CH3OH B – C6H6
|
0 |
0 |
347,1 |
9,140 |
|||||||||
|
0,5 |
0,8 |
347,0 |
|||||||||||
|
7,3 |
10,0 |
346,3 |
|||||||||||
|
15,9 |
20,2 |
345,8 |
|||||||||||
|
28,0 |
32,4 |
345,2 |
|||||||||||
|
35,2 |
38,9 |
344,9 |
|||||||||||
|
42,9 |
45,9 |
344,7 |
|||||||||||
|
51,3 |
52,8 |
344,6 |
|||||||||||
|
57,2 |
57,7 |
344,6 |
|||||||||||
|
58,8 |
58,7 |
344,6 |
|||||||||||
|
61,3 |
61,0 |
344,6 |
|||||||||||
|
69,3 |
67,5 |
344,8 |
|||||||||||
|
79,2 |
76,5 |
345,1 |
|||||||||||
|
89,4 |
87,1 |
345,6 |
|||||||||||
|
100,0 |
100,0 |
346,4 |
|||||||||||
|
T1 |
а |
Б |
в |
|
|
|
|
||||||
|
345.4 |
25 |
52.7 |
47.3 |
||||||||||
1. На основании табличных данных состава жидкой (X) и газообразной (Y) фаз строим диаграмму состава пара от состава жидкой фазы. В одинаковом масштабе на оси ординат откладываем состав паровой фазы, а на оси абсцисс – состав жидкой фазы в молярных долях, %. Равновесные точки соединяем интерполяционной кривой 1. Затем проводим прямую 2, которая соответствует одинаковому составу летучей смеси и равновесного с ней пара. Пересечение кривой состав пара – состав жидкой фазы с этой прямой характеризует состав азеотропы. В ПРИЛОЖЕНИИ 1
2. По данным температур кипения и составам жидкой и паровой фаз строим диаграмму состав – температура кипения. На оси ординат откладываем температуры кипения, на оси абсцисс – состав. Каждой температуре кипения растворов отвечают две точки, определяющие составы жидкости и равновесного с ней пара. Соответствующие точки соединяем кривыми. Кривая 1 соответствует составу кипящей жидкости, кривая 2 – составу равновесного с ней пара при заданной температуре. В ПРИЛОЖЕНИИ 2
3. Система, содержащая 80 % CH3OH, начнет кипеть при T1=330,0 К. Состав первого пузырька пара – 66 % CH3OH и 34 % C6H6. Последняя капля жидкости исчезнет при T2=331,8 К и ее состав будет 8 % C6H6 и 92 % CH3OH.
4. Состав пара, находящегося в равновесии с жидкой бинарной системой, кипящей при T1=331 К, равен 75 % CH3OH и 25 % C6H6.
5. Дистилляция – процесс разделения жидкой смеси на фракции путем частичного испарения с последующей конденсацией пара. Если при перегонке из системы выделится CH3OH и азеотропная смесь, то состав системы определяется точкой K; если C6H6 и азеотроп, то точкой – D.
6. Чтобы определить, какой компонент может быть выделен из системы, следует установить исходный состав смеси в молярных долях %, по уравнению:
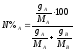 ,
,
где N%A – молярная доля компонента A в смеси: %;
gA – масса вещества A, кг;
M – молекулярная масса.
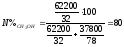 %
%
Тогда
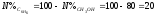 %
%
Из системы может быть выделен CH3OH, а C6H6 полностью перейдет в азеотроп.
Состав азеотропной смеси: 64 % CH3OH и 36 % C6H6.
Перевод молярного состава в весовой:

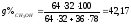 %
%
Тогда
 %
%
Определяем массу CH3OH в азеотропе:
42,17 % – х кг
57,83 % – 37,8 кг
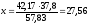 кг
кг
Тогда из системы выделится CH3OH:
62,20 – 27,56 = 34,64 кг
7. Чтобы получить азеотропную смесь, нужно добавить к системе C6H6.
Определим массу C6H6, находящейся в азеотропной смеси:
57,83 % – x кг
42,17 % – 62,2 кг
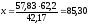 кг
кг
Следовательно, чтобы получить азеотропную смесь, нужно добавить массу C6H6:
85,30 – 37,80 = 47,50 кг.
8. При T=331 К система, состоящая из 80 % CH3OH, разделяется на 2 фазы: паровую состава K – 88% CH3OH и жидкую состава C – 75% C6H6.
Правило рычага Алексеева:
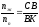
Переведем составы, отвечающие точкам B, K, C в весовые проценты по формуле:
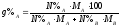
Состав
в точке K:
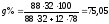 %
%
Состав
в точке B:
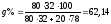 %
%
Состав
в точке C:
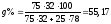 %
%
Если за х обозначить массу паровой фазы, то (2 – х) – масса жидкой фазы. Тогда:
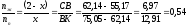
x = 1,30 кг (паровой фазы)
Масса жидкой фазы: 2 – 1,30 = 0,7 кг.
9. Вариантность системы в азеотропной точке равна:
С = К – Ф + 1 = 1 – 2 + 1 = 0
5 ЭЛЕКТРОХИМИЯ
Вариант №16
Для окислительно-восстановительного элемента типа: (+) Pt | A,B || C,D| Pt (-)
по
стандартным электродным потенциалам
полуэлементов (Краткий справочник
физико-химических величин. Под редакцией
К.П.Мищенко, А.А.Равделя. 1974) написать
уравнение и вычислить константу
равновесия реакции окисления-восстановления.
Вычислить э.д.с. элемента (T
= 298К). Указать, можно ли практически
изменить направление реакции за счет
изменения концентрации компонентов.
Принять
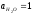 ,
,
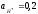
|
A |
B |
C |
D |
aA |
aB |
aC |
aD |
|
Сo3+ |
Co2+ |
Cr3+ |
Cr+2 |
0,012 |
0,01 |
0,005 |
0,06 |
Значения стандартных электродных потенциалов полуэлементов:
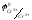 (Pt)
=-0.41
В
(Pt)
=-0.41
В
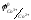 (Pt)
=1.82В
(Pt)
=1.82В
Таким образом, имеем электрохимический элемент, составленный из двух разных окислительно-восстановительных электродов:

 кДж/моль
кДж/моль