Otvety_na_ekzamen_po_Fiziologii
.doc|
№ 1 Структура и функции биологических мембран. Ионные каналы мембран и их особенности. Мембранно-ионные механизмы происхождения потенциала покоя. Электрогенез процесса возбуждения.
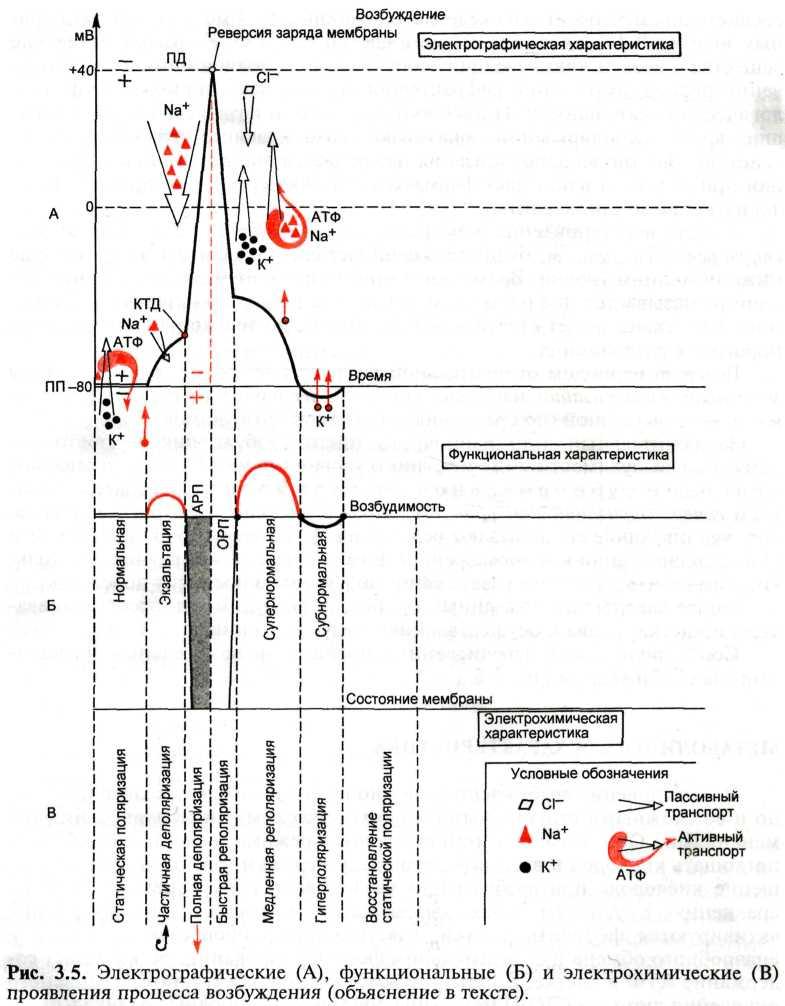
Структура биологических мембран. Фосфолипиды образуют двойной прерывистый слой. В этот слой включены белки, полярные группы которых сохраняют контакт с водной фазой. Некоторые белки пронизывают мембрану насквозь, другие погружены в липидный бислой наполовину. Часть белков связана друг с другом; другие в большей или меньшей степени окружены липидами. Одни из них являются ионными каналами, другие содержат боковые цепи гликозаминогликанов. Гликокаликс. Поверхность мембраны покрыта гликокаликсом — трехмерной сетью нитей гликозаминогликанов, соединенных между собой при помощи кальциевых мостиков. Гликокаликс обеспечивает механическую прочность мембраны, участвует в межклеточных взаимодействиях, рецепции, иммунологическом дифференцировании, разделяет молекулы веществ, контактирующих с клеткой, по величине и заряду. Липиды. Молекулы липидов, образующих бислой, амфотерны. Своими гидрофильными головками они обращены в сторону водных фаз (межклеточная жидкость и цитоплазма) и формируют внешнюю и внутреннюю поверхности мембраны. Важнейшей особенностью мембранных липидов является способность к перекисному окислению (ПОЛ) с образованием свободных радикалов. Белки. Функциональное отличие мембраны одной клетки от мембраны другой определяется наличием в ней специфических мембранных белков. Белки, погруженные в фосфолипидный слой и пронизывающие его насквозь, называются внутренними мембранными белками, или белковыми каналами. Другие белки — периферические — прикреплены к поверхности клетки. С учетом выполняемых функций мембранные белки всех клеток делят на 5 классов: белки-насосы, белки-каналы, белки-рецепторы, ферменты и структурные белки. Функции мембран. Важнейшими функциями клеточных мембран являются барьерная, биотрансформирующая, транспортная, рецепторная, генерация электрических потенциалов и образование межклеточных контактов. Белки-каналы представляют собой пути избирательного переноса ионов и заряженных молекул. Механизм переноса связан с конформацией белка-канала, в результате которой он открывается или закрывается. Взаимодействие рецептора с соответствующим ему лигандом инициирует закрытие или открытие связанного с рецептором канала. Ионоселективные каналы делят на химические и электрозависимые. В первом случае раздражителем является вещество (медиатор, гормон, метаболит, лекарственное средство), во втором — возникающее в непосредственной близости от электрозависимого канала возбуждение, т.е. потенциал действия. Ионоселективные каналы в зависимости от скорости их активации и переноса ионов делят на быстрые (например, натриевые) и медленные (например, калиевые, кальциевые). Для каждого из переносимых через мембрану вида ионов существуют самостоятельные транспортные системы — ионные каналы (натриевые, калиевые, кальциевые, каналы для хлора), основные свойства и механизмы действия которых сходны. Ионный канал состоит из поры, воротного механизма, сенсора (индикатора), напряжения ионов в самой мембране и селективного фильтра. Мембранно-ионные механизмы происхождения потенциала покоя. Статическая поляризация характеризуется наличием постоянной разности потенциалов между наружной и внутренней поверхностями клеточной мембраны и цитоплазмой, равной —60—90 мВ и называемой мембранным потенциалом (МП), или потенциалом покоя. Мембранный потенциал легко обнаружить в следующем простом опыте. Когда кончик микроэлектрода находится в межклеточной жидкости, между ним и индифферентным электродом (находится там же) разность потенциалов равна нулю. Это связано с тем, что межклеточная жидкость вследствие равновесия в ней суммы анионов и катионов электронейтральна. В момент, когда кончик микроэлектрода преодолевает клеточную мембрану и погружается в цитоплазму, луч на экране осциллографа быстро отклоняется вниз от нулевой отметки потенциала. Это свидетельствует о том, что между цитоплазмой и межклеточной жидкостью даже в состоянии покоя существует некая разность потенциалов. Электрогенез процесса возбуждения. Одиночный цикл возбуждения характеризуется множеством признаков, из которых наиболее значимыми являются электрографические, электрохимические и функциональные. Электрографические признаки. На экране осциллографа на большой развертке биоток имеет вид многокомпонентного графика, в котором выделяют: изоэлектрическую линию (изолиния); предспайк; спайк (восходящая и нисходящая части, или передний и задний фронты); отрицательный и положительный следовые потенциалы. Кроме того, на графике отмечают критическую точку деполяризации (КТД), так называемый овершут (линия нулевого потенциала), точку инверсии заряда и ряд других компонентов. При регистрации физиологических процессов на графической записи всегда должны присутствовать отметка раздражения, вызвавшего возбуждение, и отметка времени. Электрохимические признаки. На протяжении одиночного цикла возбуждения мембрана последовательно меняет свое электрохимическое состояние. Длительность его колеблется в различных клетках от 1—2 до нескольких десятков мс. Выделяют: а) статическую поляризацию – предшествующее собственно возбуждению состояния покоя; б) деполяризацию; в) реполяризацию; г) гипероляризацию.
График смотрите в вопросе № 2. |
№ 2 Электрофизиология процесса возбуждения. Потенциал действия и его фазы. Ионные механизмы возбуждения. Степени возбудимости в разные фазы потенциала действия.
Электрофизиология процесса возбуждения. Одиночный цикл возбуждения характеризуется множеством признаков, из которых наиболее значимыми являются электрографические, электрохимические и функциональные. Электрографические признаки. На экране осциллографа на большой развертке биоток имеет вид многокомпонентного графика, в котором выделяют: изоэлектрическую линию (изолиния); предспайк; спайк (восходящая и нисходящая части, или передний и задний фронты); отрицательный и положительный следовые потенциалы. Кроме того, на графике отмечают критическую точку деполяризации (КТД), так называемый овершут (линия нулевого потенциала), точку инверсии заряда и ряд других компонентов. При регистрации физиологических процессов на графической записи всегда должны присутствовать отметка раздражения, вызвавшего возбуждение, и отметка времени. Электрохимические признаки. На протяжении одиночного цикла возбуждения мембрана последовательно меняет свое электрохимическое состояние. Длительность его колеблется в различных клетках от 1—2 до нескольких десятков мс. Выделяют: а) статическую поляризацию – предшествующее собственно возбуждению состояния покоя; б) деполяризацию; в) реполяризацию; г) гипероляризацию. Степени возбудимости в разные фазы потенциала действия. Если принять уровень возбудимости в условиях физиологического покоя за норму, то в ходе развития одиночного цикла возбуждения можно наблюдать ее циклические колебания. Периоду статической поляризации соответствует исходная, фоновая возбудимость. В период развития начальной деполяризации на очень короткое время возбудимость незначительно повышается по сравнению с исходной (фаза экзальтации). Во время развития полной деполяризации и инверсии заряда возбудимость падает до нуля. Время, в течение которого отсутствует возбудимость, называется периодом абсолютной рефрактерности: ни один, даже очень сильный раздражитель не может дополнительно вызвать возбуждение ткани. В фазе восстановления мембранного потенциала, т.е. с началом быстрой реполяризации, возбудимость начинает восстанавливаться, но она еще ниже исходного уровня. Время восстановления ее от нуля до исходной величины называется периодом относительной рефрактерности: ткань может ответить возбуждением, но только на сильные, надпороговые раздражения. Вслед за периодом относительной рефрактерности, т.е. с началом фазы медленной реполяризации, наступает короткий период супернормальной— повышенной (по сравнению с исходной) возбудимости. Заключительный этап одиночного цикла возбуждения — повторное снижение возбудимости ниже исходного уровня (но не до нуля), называемое периодом субнормальной возбудимости, совпадает с развитием гиперполяризации мембраны. После завершения указанных процессов возбудимость восстанавливается, и клетка готова к осуществлению следующего цикла.
|
№ 3 Физиологические свойства скелетных мышц. Одиночное мышечное сокращение и его фазы Механизм мышечного сокращения. Виды сокращения мышц. Тетанус, виды тетануса. Теории, объясняющие механизм титанического сокращения (Г. Гельмгольц, Г. Н. Введенский).
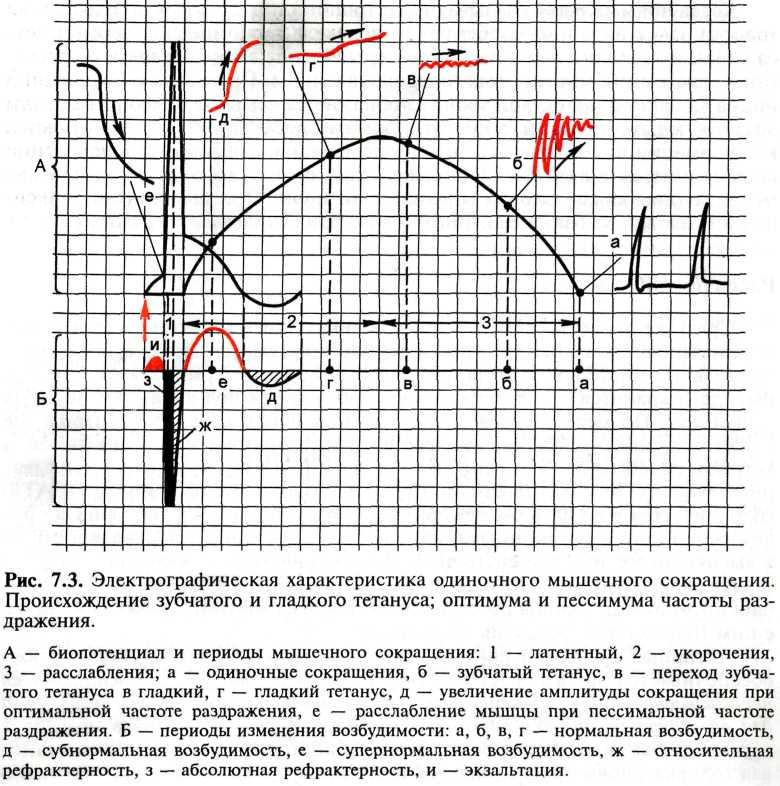
Свойства. 1) Входят в состав опорно-двигательного аппарата. 2) Имеют быструю крастковременную деполяризацию и короткий период абсолютной рефрактерности. 3) Не обладают способностью к дифференцировке и делению. 4) Иннервируются соматической нервной системой. 5) Сокращаются под влиянием импульсов, передаваемых по двигательным нервам от мотонейронов спинного мозга (отсутствие автоматизма). 6) Способны к быстрым фазическим сокращениям. 7) Не имеют пластического тонуса. 8) Осуществляют произвольные мышечные движения, сопровождаемые значительными энергетическими затратами. 9) Обладают слабо выраженной чувствительностью к химическим веществам. 10) В незначительной степени управляемы лекарственными средствами. Одиночное сокращение. Изменение длины саркомера обусловлено взаимным перекрыванием актиновых и миозиновых филаментов. Это наблюдение легло в основу теории скольжения нитей. Согласно этой теории, ключевым моментом в развитии мышечного сокращения является последовательное связывание нескольких центров миозиновой головки поперечного мостика с определенными участками на актиновых филаментах. Скользящее движение миозиновых и актиновых филаментов друг относительно друга обеспечивается силами, возникающими вследствие их взаимодействия, когда актиновые филаменты глубоко втягиваются по направлению к центру А-диска. При расслаблении или растяжении саркомера область взаимного перекрывания тонких и толстых нитей сужается. Механизм мышечного сокращения и фазы. При раздражении изолированной скелетной мышцы (икроножная мышца лягушки) одиночным импульсом тока пороговой или надпороговой силы возникает одиночное мышечное сокращение длительностью 0,11 с, в котором различают: латентный (скрытый) период сокращения (10 мс), фазу укорочения (50 мс) и фазу расслабления (50 мс). Мышечному сокращению предшествует процесс возбуждения, электрографическим проявлением которого является биопотенциал. По времени своего развития биопотенциал совпадает с латентным периодом мышечного сокращения. Возбудимость мышцы во время одиночного сокращения изменяется в соответствии с фазами потенциала действия.
Тетанус и его виды. Теории, объясняющие механизм титанического сокращения. В естественных условиях в организме одиночное мышечное сокращение не наблюдается, так как по двигательным нервам, иннервирующим мышцу, идет частотная импульсация, вызывающая суммацию одиночных сокращений. Слитные (тетанические) сокращения легко проследить в простом опыте на нервно-мышечном препарате лягушки. Если интервал между следующими друг за другом раздражениями превышает длительность одиночного сокращения (более 0,11 с), мышца успевает полностью расслабиться. Однако если увеличивать частоту раздражения, то каждый последующий импульс тока может совпасть с фазой расслабления мышцы в предыдущем цикле. Амплитуды сокращений будут суммироваться, и возникнет зубчатый тетанус. При дальнейшем увеличении частоты раздражения каждый последующий импульс тока действует на мышцу в тот период, когда она находится в состоянии укорочения. Возникает гладкий тетанус — длительное укорочение, не прерываемое расслаблением. Суммарная амплитуда тетанического сокращения зависит от частоты раздражения. Частота, при которой каждый последующий импульс тока совпадает с фазой повышенной возбудимости мышцы, вызывает самую высокую амплитуду тетануса (оптимум частоты). Более высокая частота раздражения, при которой каждый последующий импульс тока совпадает с периодом абсолютной рефрактерности предыдущего цикла возбуждения, лежит за пределами функциональной лабильности ткани и приводит к резкому снижению амплитуды сокращения (пессимум частоты). |
||||||||||||||||||||||||||||
|
|
|
|||||||||||||||||||||||||||||
|
№ 4 Классификация нервных волокон по скорости проведения возбуждения (опыт Гасссра-Эрлангера). Законы проведения возбуждения по нервным стволам. Проведение возбуждения по нервным волокнам.
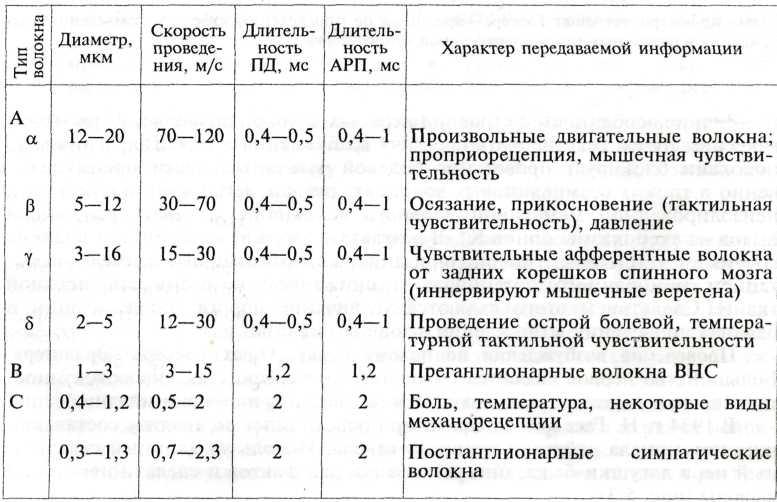
Проведение возбуждения по целому нерву. Опыт Гассера—Эрлангера. Большинство нервов являются смешанными, т.е. представлены совокупностью нервных волокон, различающихся по диаметру и степени миелинизации. В 1934 г. Н. Гассер и Р. Эрлангер провели опыт по анализу составляющих потенциала действия нервного ствола. Используя длинный седалищный нерв лягушки-быка, они установили ряд фактов и сделали некоторые выводы.
Зная расстояние между раздражающими нерв и отводящими (регистрирующими) электродами, а также время от момента нанесения стимула до начала проявления очередной волны (максимума) на графике сложного потенциала, Гассер и Эрлангер сделали вывод, что смешанный нерв состоит из трех типов волокон, каждый из которых обладает собственным порогом и скоростью проведения, и вычислили ее для каждого из них. Наиболее быстро проводящие толстые миелиновые волокна отнесены к группе А. Меньшая скорость проведения у более тонких миелиновых волокон группы В. И, наконец, минимальна скорость проведения у тонких безмиелиновых волокон группы С.
Законы проведения возбуждения по нервным стволам.
Нерв имеет самую высокую функциональную лабильность, самый короткий период абсолютной рефрактерности и практически неутомляем. Проведение возбуждения по нервным волокнам. Согласно «кабельной» теории, предложенной в 1950 г. А. Германном и затем экспериментально подтвержденной А. Ходжкиным, возбуждение проводится непрерывно по безмиелиновым и прерывисто (сальтаторно, скачкообразно) по миелиновым волокнам. В 1952 г. Д. Лилли нанизал на железную проволоку стеклянные бусы (эквивалент миелина), оставив между ними промежутки. Сравнивая время прохождения тока по оголенному проводнику и по унизанному бусами, он установил, что в последнем случае скорость проведения намного выше, чем в первом. Безмиелиновые волокна на всем протяжении имеют одинаковую электропроводность и сопротивление. Вследствие деполяризации участка мембраны возникающий в нем локальный (местный) ток распространяется только на рядом расположенный невозбужденный. Волна деполяризации идет последовательно, не имея возможности миновать ни один из невозбужденных участков волокна. Миелиновые волокна имеют изолирующий слой, резко уменьшающий емкость мембраны нервного волокна и практически полностью предотвращающий утечку тока из него. Перехваты узла лишенные миелина, в отличие от миелиновых участков, имеют очень низкое сопротивление и поэтому являются центрами электрической активности. Практически все натриевые каналы сосредоточены в области перехватов — до нескольких тысяч на 1 мкм2, тогда как в миелиновых участках их вообще нет. Невозбужденный участок волокна в области перехвата электроположителен по отношению к аксоплазме, а возбужденный — электроотрицателен. Вследствие этого на поверхности волокна возникает продольная разность потенциалов. Так как волокно находится в токопроводящей среде, генерируемый в одном перехвате потенциал действия путем пассивного проведения «перескакивает» через миелинизированный участок к соседнему невозбужденному перехвату. В результате этого в нем появляется регенераторный потенциал действия, т.е. процесс деполяризации быстро распространяется. Согласно определению Н. Бернштейна, «деполяризация — это пробоина в мембране, которая передвигается». Так происходит до тех пор, пока импульс не дойдет до конца аксона. Вместе с тем следует учитывать, что определения «высокая» и «низкая» скорость проведения имеют относительный характер и используются только в сравнительном плане. На самом деле даже в тонких безмиелиновых волокнах скорость проведения очень высока — от 2 до 15 м/с. Итак, миелиновые волокна имеют очевидные преимущества:
В процессе эволюции высших организмов скачок в развитии нервной системы был, по-видимому, связан с началом миелинизации нервных волокон. В онтогенезе, особенно у человека, отмечена корреляция между ми-елинизацией некоторых проводящих путей и усложнением рефлекторного и целостного приспособительного поведения. |
№ 5 Проведение возбуждения между клетками возбудимых тканей. Синапсы: строение, классификация и механизм проведения возбуждения в них. Функциональные свойства синапсов. Понятие о нейромедиаторах и нейромодуляторах.
Синапс — специализированный контакт между нервными клетками или нервными клетками и другими возбудимыми образованиями, обеспечивающий передачу возбуждения с сохранением его информационной значимости. С помощью синапсов осуществляется взаимодействие разнородных по функциям тканей организма, например нервной и мышечной, нервной и секреторной. Структура синапса. Пресинаптическое окончание аксона нейрона при подходе к иннервируемой клетке теряет миелиновую оболочку, что несколько снижает скорость распространения волны возбуждения. Небольшое утолщение на конце волокна, называемое синоптической бляшкой, содержит синаптические пузырьки размером 20—60 нм с медиатором — веществом, способствующим передаче возбуждения в синапсе. Синаптическая щель — пространство между пресинаптическим окончанием и участком мембраны эффекторной клетки является непосредственным продолжением межклеточного пространства. Постсинаптическая мембрана — участок эффекторной клетки, контактирующий с пресинаптической мембраной через синаптическую щель. Классификация синапсов. В соответствии с морфологическим принципом синапсы подразделяют на: • аксо-аксональные (между двумя аксонами); • аксодендритические (между аксоном одного нейрона и дендритом другого); • аксосоматические (между аксоном одного нейрона и телом другого); • дендродендритические (между дендритами двух или нескольких нейронов); • нервно-мышечные (между аксоном мотонейрона и исчерченным мышечным волокном); • аксоэпителиальные (между секреторным нервным волокном и грану-лоцитом); • межнейронные (общее название синапсов между какими-либо элементами двух нейронов). Все синапсы делят на центральные (в головном и спинном мозге) и периферические (нервно-мышечные, аксоэпителиальные и синапсы вегетативных ганглиев). В соответствии с нейрохимическим принципом синапсы классифицируют по виду химического вещества — медиатора, с помощью которого происходит возбуждение и торможение эффекторной клетки. По способу передачи возбуждения синапсы подразделяют на три группы. Первую составляют синапсы с химической природой передачи посредством медиаторов (например, нервно-мышечные); вторую — синапсы с передачей электрического сигнала непосредственно с пре- на постсинаптическую мембрану. Третья группа представлена «смешанными» синапсами, сочетающими элементы как химической, так и электрической передачи. По конечному физиологическому эффекту, а также по изменению потенциала постсинаптической мембраны, различают возбуждающие и тормозные синапсы. Механизм проведения возбуждения в синапсах. Передача возбуждения в химическом синапсе — сложный физиологический процесс, протекающий в несколько стадий. Он включает синтез и секрецию медиатора; взаимодействие медиатора с рецепторами постсинаптической мембраны; инактивирование медиатора. В целом синапс осуществляет последовательную трансформацию электрического сигнала, поступающего по нервному волокну, в энергию химических превращений на уровне синаптической щели и постсинаптической мембраны, которая затем снова трансформируется в энергию распространяющегося возбуждения в эффекторной клетке. Свойства синапсов.
Нейромедиаторы - физиологически активные вещества, вырабатываемые нервными клетками. С помощью нейромедиаторов нервные импульсы передаются от одного нервного волокна другому волокну или другим клеткам через синаптическую щель. Нейромодуляторы - химические вещества, которые действуют как нейромедиаторы, но не ограничиваются синаптической щелью, а рассредотачиваются повсюду, модулируя действие многих нейронов в определенной области. |
№ 6 Общие представления о функциональных системах организма. Виды и основные свойства функциональных систем. Системообразующий фактор.
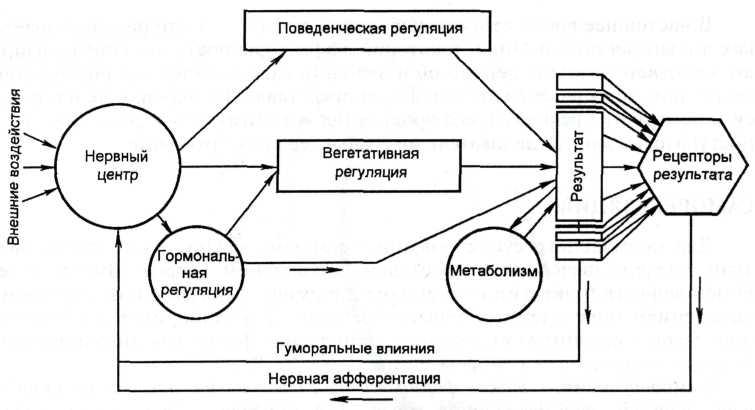
Морфофункциональными единицами саморегуляции в организме являются функциональные системы. Теория функциональных систем, сформулированная П.К. Анохиным в 1935 г., является приоритетной в области физиологической кибернетики. Под функциональными системами понимают такие самоорганизующиеся и саморегулирующиеся динамические организации, деятельность всех составных компонентов которых взаимосодействует достижению полезных для организма в целом приспособительных результатов. Такими результатами прежде всего являются различные показатели метаболизма и внутренней среды организма. Более высокий уровень составляют результаты поведенческой деятельности отдельных индивидов и популяций, и, наконец, результаты социальной деятельности человека и его психической деятельности. Функциональные системы формируются как на генетической, врожденной, основе, так и в процессе индивидуальной жизни животных и человека. Структура функциональных систем. Функциональная система любого уровня организации имеет принципиально однотипную структуру и включает следующие общие, универсальные для разных систем, периферические и центральные узловые механизмы:
Многообразие функциональных систем. Многообразие полезных для организма приспособительных результатов указывает на то, что число функциональных систем, организующих различные стороны жизнедеятельности целого организма, чрезвычайно велико. Одни из них определяют различные показатели внутренней среды, другие обусловливают поведение живых существ, их взаимодействие с окружающей средой и себе подобными. Одни функциональные системы, особенно метаболического и гомеостатического уровня, генетически детерминированы; другие складываются по мере формирования и удовлетворения метаболических и в первую очередь поведенческих потребностей организма. Кибернетические свойства. Кибернетические свойства функциональных систем. В функциональных системах проявляются общекибернетические свойства, в том числе регулирование по конечному эффекту и обмен информацией. Регулирование по конечному эффекту в кибернетике, как известно, называется обратной связью. Обратные связи открыты Н. Винером в технических устройствах, а П.К. Анохин обнаружил их в живых организмах в виде «обратной афферентации», что составило признанный приоритет отечественной науки в области физиологической кибернетики. Системобразующий фактор - это то, что контролируется. Например, рН, глюкоза, осмотическое давление и др. |
||||||||||||||||||||||||||||
|
|
||||||||||||||||||||||||||||||
|
|
||||||||||||||||||||||||||||||
|
№ 7 Кровь как внутренняя среда организма: состав крови и количество крови в организме и ее функции. Основные гомеостатические показатели крови и их характеристика.
Кровь — важнейшая внутренняя жидкая среда организма, относительное постоянство состава которой обеспечивает оптимальные условия протекания клеточного метаболизма. Вследствие наличия гистогематических барьеров истинной средой, взаимодействующей с клетками, является межклеточная жидкость. Вместе с другими жидкими средами организма она участвует в непрерывном обмене продуктов клеточного метаболизма, поступающих в кровь и лимфу, с извлекаемыми из крови веществами, необходимыми для энергетического и пластического обмена. В конечном счете состав всех жидких сред организма определяется состоянием системы крови. Система крови — совокупность образований, участвующих в поддержании гомеостаза тканей и органов: • собственно кровь как жидкая разновидность соединительной ткани; • органы кроветворения и кроворазрушения: костный мозг, вилочко-вая железа, лимфатические узлы, селезенка, печень; • нейрогуморальный аппарат регуляции. Функции крови. Кроветворение происходит непрерывно в красном костном мозге. В среднем у человека в течение жизни образуется около 450 кг эритроцитов, 5400 кг гранулоцитов, 275 кг лимфоцитов и 40 кг тромбоцитов. Кроворазрушение также протекает непрерывно в самом сосудистом русле, в селезенке и печени в количествах, эквивалентных вновь образующимся форменным элементам. Синтез белков плазмы происходит непрерывно в печени. Дыхательная функция крови заключается в транспорте газов — кислорода от легких к тканям в составе артериальной крови и двуокиси углерода в обратном направлении в составе венозной крови. Основные «участники» этих процессов — сложный хромопротеид эритроцитов — гемоглобин и «летучая» угольная кислота плазмы, образующаяся в процессе метаболизма практически во всех тканях при гидратации СО2 и также легко отдающая его в лёгких. Трофическая функция крови по отношению к клеткам заключается в переносе к ним от кишечника питательных веществ — аминокислот, липидов, моно- и дисахаридов, витаминов, микроэлементов и др. Экскреторная функция крови способствует выведению через почки, легкие, потовые железы и пищеварительный тракт токсичных продуктов метаболизма (мочевина, аммиак, билирубин, уробилин, двуокись углерода и др.), а также избытка воды и солей. Защитная функция — одна из важнейших функций крови — реализуется в двух формах — иммунных реакциях (гуморальный и клеточный иммунитет) и свертывании (тромбоцитарный и коагуляционный гемостаз). Частным случаем защитной функции являются противосвертывающие механизмы системы крови. Терморегуляторная функция способствует поддержанию температуры тела, особенно в условиях повышенной или пониженной температуры окружающей среды. Вследствие большой теплоемкости кровь переносит тепло от более нагретых к менее нагретым участкам тела и органам, регулируя таким образом физическую теплоотдачу. Основные гомеостатические показатели крови. Не вполне справедливо называемые ранее «константами», эти показатели условно делят на пластичные и жесткие. Пластичные показатели могут варьировать в достаточно широких пределах, определяемых как диапазон нормы, без существенных нарушений физиологических функций. К ним относятся объем циркулирующей крови, ее клеточный состав, вязкость, количество гемоглобина и др. Жесткие показатели характеризуются высокой стабильностью; диапазон их колебаний чрезвычайно мал, а значительные отклонения ведут к тяжелым нарушениям жизнедеятельности и даже смерти. Наиболее ярким примером являются такие показатели, как рН, парциальное давление кислорода и двуокиси углерода, количество глюкозы, коллоидно-осмотическое давление плазмы. Общее количество крови у взрослого человека 4—6 л, что составляет 6— 8 % массы тела (у мужчин в среднем около 5,4 л, у женщин — 4,5 л). Около 84 % крови находится в сосудах большого круга кровообращения, 9 % — малого и 7 % — в сердце. Примерно 64 % общего количества крови находится в венах, 6 % — в капиллярных и 18 % — в артериях. Состав крови.
|
№ 8 Плазма крови и её химический состав. Белки плазмы крови, их количество и функции. Роль белков плазмы крови и механизме обмена жидкости между кровью и тканями.
Плазма крови - жидкая часть крови. В плазме крови находятся её форменные элементы (эритроциты, лейкоциты, тромбоциты). Представляет собой коллоидный раствор белков и др. органических и неорганических соединений, содержит более 20 витаминов и 20 микроэлементов (железо, фосфор, кальций, цинк, кобальт и др.). Состав плазмы и интерстициальной жидкости существенно различается лишь по концентрации белков, так как их крупные молекулы не могут свободно проходить через стенки капилляров. Белки плазмы. Общие свойства. Высокая относительная вязкость плазмы (1,9-2,8 при относительной вязкости воды, равной 1) почти целиком обусловлена белками, содержание которых составляет 65-80 г/л. В связи с высокой молекулярной массой белков их моляльная концентрация весьма невелика-всего лишь около 1 ммоль/кг (см. табл. 18.1). Белковая фракция плазмы представляет собой смесь многих белков. Молекулярные массы белков плазмы варьируют от 44 000 до 1300 000. Частицы таких размеров относятся к коллоидам. Функции белков. Белки плазмы крови выполняют ряд функций. 1. Питание. 2. Транспорт. Белки плазмы участвуют также в поддержании постоянного осмотического давления, так как способны связывать большое количество циркулирующих в крови низкомолекулярных соединений. 3. Белки плазмы как неспецифические переносчики. Все белки плазмы связывают катионы крови, переводя их в недиффундирующую форму. 4. Роль белков в создании коллоидно-осмотического давления. Вследствие низкой молекулярной концентрации белков вклад их в общее осмотическое давление плазмы крови весьма невелик, но тем не менее создаваемое ими коллоидно-осмотическое (онкотическое) давление играет важную роль в регуляции распределения воды между плазмой и межклеточной жидкостью. 5. Буферная функция. Поскольку белки-это амфотерные вещества (т. е. способные связывать в зависимости от рН среды и Н+, и ОН"), белки плазмы играют роль буферов, поддерживающих постоянство рН крови. 6. Предупреждение кровопотери. Свертывание крови, препятствующее кровотечению, частично обусловлено наличием в плазме фибриногена. |
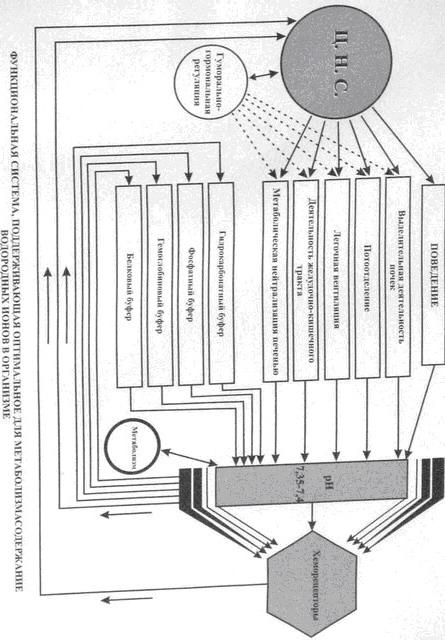
№ 9 Функциональная система, поддерживающая кислотно-основное (рН) состояние крови на оптимальном для метаболизма уровне. Понятие об ацидозе и алкалозе. Буферные системы крови, их характеристики и принцип действия.
Ацидоз — одна из форм нарушений кислотно-щелочного равновесия организма; характеризуется абсолютным или относительным избытком кислот, т.е. веществ, отдающих ионы водорода (протоны), по отношению к основаниям, присоединяющим их. Алкалоз - Патологическое состояние, характеризующееся потерей кислот и избыточным накоплением щелочных соединений, в результате нарушения дыхания или нарушения метаболизма. Буферные системы крови, их характеристики и принцип действия. Общее понятие о буферных системах. Прежде всего необходимо вспомнить, что реакции диссоциации слабой кислоты НА на ионы водорода Н+ и сопряженное основание А- подчиняются закону действующих масс. Кинетику
таких
реакций описывает уравнение Подобное уравнение для буферных систем, выведенное из закона действующих масс, называется уравнением Гендерсона- Гассельбальха. Величина рK', так же как и К', -константа, характеризующая свойства системы (рК'= -lgK'). Уравнение можно представить в следующем виде:
Показателем способности системы, состоящей из слабой кислоты и сопряженного основания, создавать буферный эффект служит буферная емкость - величина, равная соотношению между количеством ионов Н+ или ОН+, добавленных в раствор, и изменением рН. Таким образом, буферная емкость раствора зависит от его концентрации и от разницы между рН и рК' этого раствора. Бикарбонатный буфер. Из имеющихся в крови буферных систем рассмотрим прежде всего бикарбонатную систему. Она включает относительно слабую угольную кислоту, образующуюся при гидратации СО2, и бикарбонат в качестве сопряженного основания. Регулируя напряжение СО2 в крови, дыхательная система обеспечивает высокое содержание компонентов буферной системы. Кроме того, органы дыхания вместе с бикар-бонатным буфером образуют «открытую систему», в которой напряжение СО2 (а следовательно, и рН крови) может регулироваться путем изменения вентиляции легких. Фосфатный буфер. В фосфатной буферной системе, образованной неорганическими фосфатами крови, роль кислоты играет одноосновный фосфат H2PO4, а роль сопряженного основания-двухосновный фосфат НРО. Величина рК' фосфатного буфера (6,8) сравнительно близка к рН крови, однако емкость данного буфера невелика по причине низкого содержания фосфата в крови. Белковый буфер. Буферные свойства белков крови обусловлены способностью аминокислот ионизироваться. Концевые карбокси- и аминогруппы белковых цепей играют в этом отношении незначительную роль, так как таких групп мало и их рК' существенно отличаются от рН крови. Значительно больший вклад в создание буферной емкости белковой системы вносят боковые группы, способные ионизироваться, и особенно имидазольнов кольцо гистидина. К буферным белкам относятся как белки плазмы (в частности, альбумин), так и содержащийся в эритроцитах гемоглобин. На долю последнего приходится большая часть буферной емкости белковой системы, что связано как со значительной концентрацией гемоглобина, так и с относительно высоким содержанием в нем гистидина. |
||||||||||||||||||||||||||||
|
№ 10 Форменные элементы крови. Эритроциты: количество, физиологическая роль. Гемолиз эритроцитов, виды гемолиза. Скорость оседания эритроцитов (СОЭ), ее клиническое значение, факторы, влияющие на СОЭ.
Форменные элементы крови. Кровь является циркулирующей по кровеносным сосудам жидкой тканью, состоящей из двух основных компонентов, — плазмы и взвешенных в ней форменных элементов — эритроцитов, лейкоцитов и кровяных пластинок (тромбоцитов). В среднем в теле человека с массой тела 70 кг содержится около 5—5,5 л крови. Эритроциты, или красные кровяные тельца, человека и млекопитающих представляют собой безъядерные клетки, утратившие в процессе фило- и онтогенеза ядро и большинство органелл. Эритроциты неспособны к делению. Функции эритроцитов. Основная функция эритроцитов — дыхательная — транспортировка кислорода и углекислоты. Эта функция обеспечивается дыхательным пигментом — гемоглобином . Кроме того, эритроциты участвуют в транспорте аминокислот, антител, токсинов и ряда лекарственных веществ, адсорбируя их на поверхности плазмолеммы. Количество эритроцитов у взрослого мужчины составляет 3,9-5,5 • 1012л, а у женщин — 3,7-4,9 • 1012л крови. Популяция эритроцитов неоднородна по форме и размерам. В нормальной крови человека основную массу составляют эритроциты двояковогнутой формы — дискоциты. Кроме того, имеются планоциты (с плоской поверхностью) и стареющие формы эритроцитов — шиловидные эритроциты, или эхиноциты, куполообразные, или стоматоциты, и шаровидные, или сфероциты. Процесс старения эритроцитов идет двумя путями — кренированием (образование зубцов на плазмолемме) или путем инвагинации участков плазмолеммы. Продолжительность жизни. Средняя продолжительность жизни эритроцитов составляет около 120 дней. Разрушение эритроцитов (гемолиз) может произойти под влиянием различных случайных факторов, связанных с их движением (механический гемолиз) и изменением физико-химических свойств плазмы (физический гемолиз, химический гемолиз, осмотический гемолиз), а также в результате естественного старения. Различают несколько видов гемолиза. Они связаны с изменением резистентности эритроцитов — их способности противостоять разрушительным воздействиям. Осмотический гемолиз возникает в гипотоническом растворе, осмо-ляльность которого меньше, чем самого эритроцита. В этом случае по законам осмоса растворитель (вода) движется через хорошо проницаемую для нее мембрану эритроцитов в цитоплазму. Эритроциты набухают, а при значительном набухании разрушаются; кровь становится прозрачной («лаковая» кровь). Мерой осмотической резистентности считают концентрацию раствора хлорида натрия, при которой начинается гемолиз. Механический гемолиз возникает при интенсивных физических воздействиях на кровь. Механический гемолиз консервированной крови может произойти при неправильной ее транспортировке — грубом встряхивании и др. У здорового человека незначительный механический гемолиз наблюдается при длительном беге по твердому покрытию (асфальт, бетон); при работах, связанных с продолжительным сильным сотрясением тела у шахтеров при бурении породы и др. Биологический гемолиз связан с попаданием в кровь веществ, образующихся в других живых организмах животного и растительного происхождения: при повторном переливании несовместимой по резус-фактору крови, при укусе змей, ядовитых насекомых, при отравлении грибами. Во всех случаях, как правило, эти реакции имеют иммунный характер. Химический гемолиз происходит под воздействием жирорастворимых веществ, нарушающих фосфолипидную часть мембраны эритроцитов,— наркотических анестетиков (эфир, хлороформ), нитритов, бензола, нитроглицерина, соединений анилина, сапонинов. Термический гемолиз возникает при неправильном хранении крови — ее замораживании и последующем быстром размораживании. Внутриклеточная кристаллизация биологической воды приводит к разрушению оболочки эритроцитов. Внутриклеточный гемолиз. Стареющие эритроциты удаляются из циркулирующей крови и разрушаются в селезенке, печени и незначительно — в костном мозге клетками системы фагоцитирующих мононуклеотидов. Фракции IgG сыворотки содержат аутоантитела против старых эритроцитов, прикрепление которых к эритроцитам приводит к их фагоцитозу. Внутрисосудистый гемолиз. В норме часть эритроцитов разрушается в сосудистом русле. Гемоглобин соединяется с а-гликопротеином плазмы (гаптоглобин) в необратимый комплекс, который из-за большой молекулярной массы не проходит через почечный фильтр, а подвергается быстрому ферментативному расщеплению, в основном в печени. Скорость оседания эритроцитов (СОЭ). Оседание эритроцитов — их свойство осаждаться на дне сосуда (капилляр), при сохранении крови в несвертывающемся состоянии в виде так называемых монетных столбиков, над которыми образуется слой прозрачной жидкости — плазмы. Эритроциты оседают потому, что их относительная плотность больше, чем относительная плотность плазмы. Факторы, влияющие на СОЭ. СОЭ зависит от белкового состава плазмы, главным образом от соотношения глобулинов и альбуминов (в норме АГ-коэффициент равен 1,5—2,3). Клиническое значение. Сдвиг коэффициента за счет увеличения количества глобулинов ускоряет СОЭ, что имеет место при многих патологических (воспаление, туберкулез) и некоторых физиологических (беременность) процессах. Все белковые молекулы (фибриноген, а(-глобулин, аг-глобу-лин, (3-глобулин) в разной степени снижают дзета-потенциал эритроцитов — отрицательный заряд мембран, способствующий взаимному отталкиванию эритроцитов и поддержанию их во взвешенном состоянии. Наибольшее влияние оказывают фибриноген, иммуноглобулины, гаптоглобин. Изменения СОЭ имеют большое диагностическое и прогностическое значение. |
||||||||||||||||||||||||||||||
|
|
||||||||||||||||||||||||||||||
|
|
||||||||||||||||||||||||||||||