
- •ОГЛАВЛЕНИЕ
- •Введение
- •Используемые единицы измерений и основные константы
- •1.1. Предпосылки возникновения волновой механики
- •1.1.2. Теория строения атома Бора
- •1.1.3. Корпускулярно-волновой дуализм свойств материи
- •1.1.4. Принцип неопределенности
- •1.2. Волновая (квантовая) механика
- •1.3. Квантово-механическая модель атома
- •1.3.1. Основное состояние атома водорода
- •1.3.2. Радиальное распределение электронной плотности. Электронная орбиталь
- •1.3.4. Многоэлектронные атомы
- •1.3.5. Электронные конфигурации многоэлектронных атомов
- •1.3.6.Связь периодического закона со строением атома
- •1.3.7.Физико-химические характеристики атома
- •2.1. Основные характеристики химической связи. Классификация моделей описания химической связи
- •2.2. Ковалентная химическая связь
- •2.2.1. Метод валентных связей (ВС)
- •2.2.3. Геометрия простейших молекул. Гибридизация АО
- •2.2.4. Донорно-акцепторный механизм образования ковалентной связи
- •2.3. Полярность связи. Дипольный момент молекулы
- •3.1. Агрегатные состояния
- •3.3.1.Основные понятия о строении кристаллов
- •Библиографический список
2.3. Полярность связи. Дипольный момент молекулы
При образовании ковалентной химической связи между разными атомами (гетероядерные молекулы) электронная плотность распределяется не симметрично относительно ядер. В молекуле она сдвинута в сторону ато-
ма, имеющего большее значение электро- |
Атом А |
Атом В |
|||
отрицательности. Вследствие |
этого в |
||||
χА<χВ |
|||||
двухатомной молекуле |
центры |
тяжести |
|||
δ+ |
δ− |
||||
положительных зарядов |
ядер и |
отрица- |
|||
тельных зарядов электронов не совпадают. Возникает система разных по знаку, но одинаковых по величине электриче-
ских зарядов (δ+ и δ−) – электрический диполь (рис. 2.23).
Мерой полярности связи (характеристикой диполя) является диполь-
ный момент µ – произведение величины заряда δ на расстояние между центрами тяжести положительных и отрицательных зарядов (длина диполя l).
Единицей измерения дипольного момента в системе СИ [Кл м] чаще
используется внесистемная единица Дебай (D): 1 D = 3,33 10-30 Кл м.
В гетероядерных молекулах связь всегда полярна, но если число атомов в молекуле три и более, то возникающая при этом система распределения зарядов может привести к тому, что молекула в целом не будет являться диполем – центры тяжести положительных и отрицательных зарядов совпадают. Как правило, это связано с симметричным строением молекулы.
Если молекулу, даже если она не является диполем, поместить в электрическое поле напряженностью Е, происходит разделение центров тяжести зарядов в результате смещения электронов относительно ядер, и смещения атомов относительно друг друга в молекуле. При этом молекула приобретает наведенный (индуцированный) дипольный момент. Способность молекул приобретать в электрическом поле дипольный момент на-
зывается поляризуемостью.
Дипольный момент наведенного диполя пропорционален напряженности электрического поля: µи = α ε0 E , где α – коэффициент поляризуе-
мости (поляризуемость) атома или молекулы, ε0 – электрическая постоянная.
73
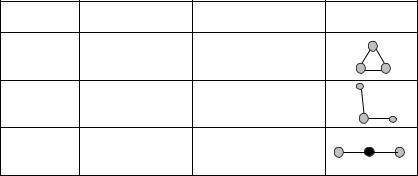
Пример.
Молекула |
Дипольный мо- |
Дипольный момент |
Строение |
||
|
мент связи, D |
молекулы, D |
молекулы |
||
O3 |
0 |
0 |
О |
|
|
О |
О |
||||
|
|
|
|||
H2O |
1,5 |
1,84 |
Н |
|
|
О |
Н |
||||
|
|
|
|||
CO2 |
2,7 |
0 |
С |
O |
|
|
|
О |
|||
3 . ХИМИЧЕСКАЯ СВЯЗЬ В ТВЕРДЫХ ВЕЩЕСТВАХ
ИЖИДКОСТЯХ
3.1.Агрегатные состояния
Вещества в зависимости от внешних условий (температура и давление) и их химического состава могут существовать в трех основных агрегатных состояниях: газообразном, жидком и твердом. При достаточно низких температурах вещества находятся в твердом состоянии, а при относительно высоких – в жидком и газообразном.
При нагревании происходит, как правило, последовательный переход веществ из твердого в жидкое и газообразное состояние (плавление и испарение), а при охлаждении протекают обратные процессы (конденсация и кристаллизация). Эти переходы осуществляются при определенной температуре (температуре фазового перехода), при этом скачкообразно изменяется молярный объем вещества и энтропия (энергетическая характеристика степени разупорядоченности системы), поглощается или выделяется тепловая энергия (энтальпия фазового перехода). Температура перехода из одного состояния в другое зависит от химической природы вещества и давления. Конкретные значения температур фазовых переходов для различных веществ лежат в широких пределах (табл. 3.1). Необходимо отметить, что при определенных условиях возможен фазовый переход твердое состояние – газ (сублимация-кристаллизация).
74
|
|
|
|
|
|
|
|
|
Таблица 3 . 1 |
||
Температуры (°С), энтальпия (∆Н0, кДж/моль) и энтропии (∆S0, Дж/моль К) фазо- |
|||||||||||
|
вых переходов некоторых веществ при атмосферном давлении |
|
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
Ве- |
Тип кристалла |
|
|
|
|
Фазовый переход |
|
|
|
|
|
щест- |
|
|
Плавление - |
|
|
|
Кипение – |
|
|||
во |
|
кристаллизация |
|
конденсация |
|
||||||
|
|
tпл, °С |
|
∆Н0пл, |
|
∆S0 пл, |
tкип, °С |
|
∆Н0исп, |
|
∆ S0исп, |
N2 |
Молекулярный |
-210 |
|
0,721 |
|
11,4 |
-195,8 |
|
5,59 |
|
72,4 |
CH4 |
-//- |
-182,5 |
|
0,938 |
|
10,4 |
-164 |
|
8,18 |
|
75,0 |
H2O |
-//- |
0 |
|
6,013 |
|
22,0 |
100 |
|
40,683 |
|
109,07 |
C6Н6 |
-//- |
5,5 |
|
9,837 |
|
35,3 |
80,1 |
|
30,76 |
|
87,1 |
S(β) |
-//- |
119,3 |
|
1,72 |
|
4,4 |
445 |
|
9,2 |
|
12,8 |
Si |
Ковалентный |
1415 |
|
49,8 |
|
29,5 |
3300 |
|
356 |
|
99,6 |
AgCl |
Ионный |
455 |
|
13,2 |
|
18,1 |
1557 |
|
184 |
|
100,5 |
NaCl |
-//- |
801 |
|
28,2 |
|
26,3 |
1490 |
|
138 |
|
78,3 |
MgF2 |
-//- |
1263 |
|
58 |
|
37,8 |
2270 |
|
274 |
|
107,7 |
Na |
Металлический |
97,9 |
|
2,60 |
|
7,01 |
886 |
|
90.1 |
|
77,7 |
Ag |
-//- |
960,5 |
|
11,3 |
|
9,2 |
2167 |
|
251 |
|
102,9 |
W |
-//- |
3420 |
|
35,1 |
|
9,5 |
5680 |
|
770 |
|
129,3 |
Жидкое и твердое агрегатные состояния относят к конденсированному состоянию вещества. Оно отличается от газообразного тем, что энергия взаимодействия между частицами, образующими вещество, сравнима по величине или превышает энергию их теплового движения. Это приводит к тому, что среднее расстояние между частицами (между центрами частиц) в газе при нормальных условиях составляет величину ~ 10 их диаметров, тогда как в конденсированном состоянии оно сравнимо с их диаметром. Молярный объем любого газа при нормальных условиях равен 22,4 л/моль, тогда как молярные объемы твердых веществ и жидкостей примерно в 103 раз меньше (0,01–0,05 л/моль).
Пример. Расчет средних размеров пространства, занимаемого одной частицей при атмосферном давлении.
Газ Жидкость, кристалл
|
d |
d |
|
|
|
a |
|
a |
V = a3 – объем пространства a – ребро куба
d – средний диаметр частицы
75
Газ. |
1 |
моль |
газа при нормальных |
условиях |
занимает |
объем |
|||||
Vν = 22,4 л/моль и содержит 6,02 1023 молекул (число Авогадро). |
|
||||||||||
Средний размер пространства, занимаемого одной частицей: |
|
||||||||||
V = |
22,4 10 |
-3 |
|
|
|
|
|
0 |
|||
|
= 3,7 10-26 м3 , a = 3 V = 3 3,7 10−26 = 3,3 10-9 м = 33А. |
||||||||||
|
|
6,02 1023 |
|
|
|
|
|
|
|||
Размер молекулы азота (две длины связи) d N2 3 Ǻ. |
|
|
|||||||||
Жидкость. |
|
1 |
моль |
жидкого брома |
(Br2) |
занимает |
объем |
||||
V = |
M |
= |
160 |
= 51,2 cм3 . |
М=160 г/моль |
– |
молярная масса |
брома, |
|||
ν |
ρ |
|
3,12 |
|
|
|
|
|
|
|
|
ρ=3,12 г/см3 – плотность жидкого брома, Vν – молярный объем жидкого брома.
Средний размер пространства, занимаемого одной частицей:
V = |
51,2 |
10 |
-6 |
= 8,5 10-29 м3 |
, a = 3 V = 3 |
8,5 10−29 = 4,4 10-10 |
0 |
|||
|
м = 4,4 А . |
|||||||||
|
1023 |
|||||||||
6,02 |
|
|
|
|
|
|
|
|||
Размер молекулы брома (две длины связи) d Br2 4,56 Ǻ. |
|
|||||||||
Кристалл. 1 |
моль металлического серебра занимает объем |
|
||||||||
|
|
|
|
V = |
M = |
|
108 |
= |
10,3 cм3. |
|
|
|
|
|
10,50 |
|
|||||
|
|
|
|
ν |
ρ |
|
|
|
||
М=108 г/моль – молярная масса серебра, ρ=10,50 г/см3 – плотность серебра, Vν – молярный объем серебра.
Средний размер пространства, занимаемого одной частицей:
V = |
10,3 |
10 |
-6 |
=1,7 10-29 м3 , a = 3 V = 3 1,7 10−29 |
= 2,6 10-10 |
0 |
|
м = 2,6 А. |
|||||
|
6,02 |
1023 |
|
|
|
|
Размер атома серебра (два металлических радиуса) d Ag 2,68 Ǻ.
В газах частицы находятся в броуновском движении, при этом отсутствуют ближний и дальний порядок в положении частиц. Газ не имеет собственного объема и, соответственно, формы. В жидкостях броуновское движение осложнено наличием более или менее устойчивого ближнего порядка в положении частиц относительно друг друга за счет возникновения химических связей между отдельными частицами. Жидкость имеет собственный объем, но из-за слабого межмолекулярного взаимодействия под действием силы тяжести принимает форму сосуда, в котором она находится. В твердом состоянии вещества энергия взаимодействия между частицами намного превышает энергию теплового движения, что приводит к фиксированию положений частиц в пространстве, вокруг которых они совершают колебательные и вращательные движения. Это определяет наличие у твердых тел собственной формы и объема и большое сопротивление сдвигу.
76
Сравнение энергетических характеристик фазовых переходов свидетельствует о существенно меньшей перестройке вещества при плавлении, чем при испарении. Как видно из табл. 3.1, для всех кристаллов с различным типом химической связи теплота (энтальпия) плавления много меньше теплоты испарения. Энтропия фазового перехода, характеризующая изменение степени упорядоченности системы, также для плавления много меньше, чем для испарения.
В газообразном состоянии, где присутствуют слабо или совсем не взаимодействующие между собой молекулы вещества, химическая связь внутри них рассматривается с использованием моделей «классической» ковалентной связи.
При рассмотрении конденсированного состояния вещества химическая связь описывается с использованием моделей ковалентной, ионной и металлической связи. При этом необходимо принимать во внимание близкое расположение частиц, образующих систему. Это обстоятельство в ряде случаев (жидкости, молекулярные кристаллы) обусловливает необходимость учитывать существенный вклад межмолекулярного взаимодействия в энергию химических связей.
Необходимо отметить, что целый ряд веществ может не иметь одного из агрегатных состояний. Чаще всего это относится к жидкому и газообразному состояниям. Данное обстоятельство связано с соотношением между энергией, необходимой для перевода вещества из одного агрегатного состояния в другое, и энергией, достаточной для разрыва внутримолекулярных химических связей. Например, во многих нерастворимых в воде гидроксидах металлов при нагревании раньше протекает реакция дегидратации (Cu(OH)2→ CuO + H2O), а затем происходит плавление вещества.
3.2.Межмолекулярное взаимодействие
Как было отмечено выше, в конденсированном состоянии вещества на величину энергии химической связи существенно влияют межмолекулярные взаимодействия. Они связаны с электростатическим взаимодействием зарядов, возникающих в результате нарушения симметрии распределения электронной плотности в молекулах.
3.2.1.Межмолекулярные взаимодействия (силы Ван-дер-Ваальса)
В конденсированных фазах (жидкость, твердое тело) расстояние между молекулами соизмеримо с размерами самих молекул. На таких малых расстояниях проявляют себя силы электростатического взаимодействия диполей, как постоянных, так и наведенных. При этом энергия системы понижается.
77
Межмолекулярные взаимодействия характеризуются отсутствием обмена электронами между частицами, отсутствием специфичности и насыщаемости. Энергия межмолекулярного взаимодействия сравнительно невелика, однако она вносит существенный вклад в энергетическое состояние системы, определяя в значительной степени физические и химические свойства вещества.
На сравнительно больших расстояниях r между молекулами, когда электронные оболочки не перекрываются, действуют только силы притяжения. При этом возможны три механизма возникновения сил притяжения.
1. Ориентационный эффект (диполь – дипольное взаимодействие). Если молекулы полярны, то проявляется электростатическое взаимодействие двух постоянных диполей. Полярные молекулы ориентируются относительно друг друга противоположно заряженными частями, энергия притяжения прямо пропорциональна дипольным моментам (µi2) и обратно пропорциональна расстоянию между ними (r6). Повышение температуры ослабляет это взаимодействие, так как тепловое взаимодействие стремится
нарушить взаимную ориентацию молекул.
2. Индукционный эффект (взаимодействие диполь – наведенный диполь).
Неполярные молекулы под действием поля полярной молекулы поляризуются, возникает индуцированный диполь. Индуцированный дипольный момент прямо пропорционален поляризуемости молекул (µи α µд). Энергия притяжения таких молекул прямо пропорциональна дипольным моментам (α µд2) и обратно пропорциональна расстоянию между ними (r6). Так как наведение диполей происходит при любом пространственном расположении молекул, индукционный эффект от температуры не зависит.
3. Дисперсионный эффект (взаимодействие мгновенных диполей).
В отличие от ориентационного и индукционного взаимодействия дисперсионный эффект имеет объяснение только в рамках квантовой механики. Его возникновение можно представить следующим образом: в процессе движения электронов распределение зарядов внутри атомов может стать несимметричным, что приводит к образованию «мгновенных диполей», которые притягиваются друг к другу. Более того, при сближении молекул движение электронов перестает быть независимым и возникает «самосогласованная» система взаимодействующих мгновенных диполей. Энергия притяжения прямо пропорциональна поляризуемостям молекул (αi) и обратно пропорциональна расстоянию между ними (r6).
Дисперсионный эффект, как наиболее универсальный, проявляется при взаимодействии как полярных, так и неполярных молекул. Причем для неполярных молекул и молекул с небольшим дипольным моментом он является основным.
78
Индукционный и ориентационный эффекты играют существенную роль при взаимодействии полярных молекул. Для молекул с большим значением дипольного момента основным является ориентационный эффект. Индукционный эффект обычно невелик и становится значительным лишь тогда, когда полярные молекулы сосуществуют с сильно поляризующимися молекулами (табл. 3.2).
На малых расстояниях между молекулами, когда их электронные оболочки сильно перекрываются, электростатическое отталкивание ядер и электронов становится больше их взаимного притяжения. Энергия отталкивания гораздо сильнее зависит от расстояния (r12), чем энергия притяжения. На больших расстояниях межмолекулярное взаимодействие определяется силами притяжения, а на малых силами отталкивания.
Таблица 3 . 2
Относительный вклад каждой составляющей в энергию межмолекулярного взаимодействия для различных молекул
|
Ориентацион- |
Индукционное |
Дисперсион- |
µ, Кл м |
|
α, м3 |
Молекула |
ное |
|
ное |
Диполь- |
|
Поляри- |
|
|
|
|
|||
|
% |
|
ный |
|
зуемость |
|
|
|
|
момент |
|
|
|
|
|
|
|
|
×1030 |
|
CO |
< 0,01 |
0,1 |
99,9 |
0,33 |
|
1,926 |
HCl |
14,4 |
4,2 |
81,4 |
3,47 |
|
2,561 |
NH3 |
44,9 |
5,3 |
49,7 |
4,94 |
|
2,145 |
H2O |
76,9 |
4,0 |
19,0 |
6,10 |
|
1,444 |
3.2.2.Водородная связь
Особым типом межмолекулярного взаимодействия является водородная связь. Она возникает между молекулами, которые содержат в своей структуре атом водорода и малый по размерам атом элемента с большим значением электроотрицательности (кислород, фтор, азот и др.). Поскольку разница в электроотрицательностях водорода и этих элементов велика, то связь сильно поляризована, на атомах возникают сравнительно большие отрицательные и положительные заряды. В то же время небольшой размер этих атомов позволяет им близко подходить друг к другу при ди- поль-дипольном взаимодействии. Поэтому энергия ориентационного взаимодействия значительно больше (примерно на порядок), чем в других случаях. Кроме того, энергия связи существенно увеличивается за счет частичного образования ковалентной составляющей связи между взаимодействующими атомами соседних молекул по донорно-акцепторному механизму. 1s-орбиталь водорода частично оголена благодаря сильной поляризации связи (это еще не Н+, но уже и не Н0), а на электроотрицательном атоме имеются неподеленные электронные пары.
79
Оба эти фактора приводят к увеличению энергии связи по сравнению с энергией межмолекулярного взаимодействия. Энергия водородной связи составляет величину порядка 100 кДж/моль, энергия межмолекулярного взаимодействия (силы Ван-дер-Ваальса) – 10-20 кДж/моль.
При конденсации молекул, способных к образованию водородных связей, их взаимное расположение будет определяться как направлением в пространстве атомов водорода внутри молекулы, так и направлением в пространстве электронных орбиталей электроотрицательного атома, связанного с атомом водорода соседней молекулы.
Водородная связь определяет многие физические и химические свойства веществ, в частности увеличивается температура плавления и кипения, изменяется плотность вещества. Особую роль водородная связь играет в биохимии, органические молекулы (в том числе и полимеры), содержащие H-O, H-N связи, образуют большое число водородных связей.
Примеры. Вода H2O.
В конденсированном состоянии каждая молекула воды может иметь четыре водородные связи: две между атомом кислорода (функции донора) и атомами водорода двух соседних молекул воды; еще две – за счет двух атомов водорода (функция акцептора). В кристаллическом состоянии образуется правильная алмазоподобная структура. В узлах располагаются большие атомы кислорода, которые связаны между собою через атом водорода. В жидком состоянии часть водородных связей разорвана (рис.3.1).
Нδ+ |
Нδ+ Длина связи О |
Н |
0,99 Ǻ |
|
Длина связи О |
Н |
1,77 Ǻ |
Оδ− |
Угол связи 104,5о |
|
|
Оδ− |
|
|
|
Нδ+ |
Нδ+ Нδ+ Нδ+ |
|
|
 Оδ−
Оδ−
Рис. 3.1. Схема образования тетраэдрической пространственной структуры воды вкристаллическом и жидком состояниях: - ковалентная связь, - водородная связь
- водородная связь
Фтористый водород HF.
В газообразном состоянии при невысоких температурах, за счет образования водородных связей, образуются ассоциаты (HF)2, (HF)6.. В конденсированном состоянии, в частности в твердом, HF образует зигзагообразные цепи (рис. 3.2).
80
