
Общая химия. Ответы по методичке 287-345
.pdf
1
287)раствор, компоненты раствора
раствор – однородная система переменного состава из двух и более компонентов
раствор – однородная система, в которой любая часть объема р-ра имеет одинаковый хим.состав и физ.свойства раствор – система из минимум двух компонентов - из растворителя и растворенного в-ва если компоненты раствора находятся в разном агрегатном состоянии,
то за растворитель принимают то в-во, которое находится в одном агрегатном состоянии, что и раствор ПР: сахар и вода, растворитель - вода, если компоненты находятся в одном агрегатном состоянии, то за р-тель принимают то в-во, которого больше
ПР: воздух – газовый раствор, в котором растворитель – азот
сравнение растворов и смесей
растворы и смеси имеют переменный состав, растворы и смеси разделяются физическими способами(перегонкой, выпариванием или перекристаллизацией..)
сравнение растворов и хим.соединений
растворы и хим.соединения однородны во всем объеме, образование растворов и хим.соединений сопровождается тепловыми эффектами,
в растворах образуются соединения из молекул растворителя и растворенного в-ва
растворимость веществ, коэффициент растворимости
растворимость - способность в-в растворяться-переходить в раствор показателем растворимости является коэффициент растворимости
коэффициент растворимости – max масса в-ва, которая может раствориться в 100 г растворителя! по коэффициенту растворимости различают в-ва:
- растворимые |
>1,0 г в-ва |
в |
100,0 |
мл растворителя |
ПР: KNO3 Na2SO4 |
- малорастворимые 0,1-1,0 г в-ва в 100,0 мл растворителя |
ПР: MgSO4 PbCl2 |
||||
- нерастворимые |
<0,1 г в-ва |
в |
100,0 |
мл растворителя |
ПР: CaCO3 BaSO4 |
состав растворов: доли и концентрации растворенного вещества
содержание в-ва в растворе характеризуется его долей в растворе и концентрацией раствора:
массовая доля |
(%) есть массовая доля в-ва в 100 г! раствора |
|||||||||||||||
|
|
mв ва 100% |
|
mв ва 100% |
|
|
|
|||||||||
|
|
mр ра |
Vр ра р ра |
|
|
|
||||||||||
мольная доля |
N есть количество в-ва(моли) в общем количестве молей в-в раствора |
|||||||||||||||
N |
|
|
νв ва |
|
|
|
|
|
|
|
|
|
||||
νв-ва νр-теля |
|
|
|
|
|
|
||||||||||
молярная концентрация СМ |
(моль/л) есть количество в-ва(моли) в 1000 мл! раствора |
|||||||||||||||
С |
M |
|
|
в ва |
|
|
|
|
mв ва |
|
|
|
|
mв ва 1000 |
|
|
|
|
|
Vр ра |
|
Mв ва Vр ра л |
Mв ва Vр ра мл |
||||||||||
|
|
|
|
|
||||||||||||
моляльная концентрация Сm или моляльность(моль/кг) есть количество в-ва(моли) в 1000 г! растворителя |
||||||||||||||||
С |
m |
|
νв ва |
|
νв ва 1000 |
|
|
|
||||||||
|
|
|
mр-теля кг |
|
|
|
mр-теля г |
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
||||||||
молярная концентрация эквивалента вещества С1/Z или
нормальная концентрация или нормальность(моль/л) есть количество эквивалента в-ва(моли) в 1000 мл! р-ра
С1/ Z |
mв ва |
|
mв ва |
если эквивалент вещества меньше реальной частицы вещества, то С1/Z > СМ |
|
Эв ва Vр ра |
М1/ Z Vр ра |
||||
|
|
|
титр (г/мл)– отношение массы в-ва к объему раствора
Тmв ва Vр-ра
классификация растворов
различают растворы |
по агрегатному состоянию: |
|
- газообразные ПР: |
воздух |
|
- жидкие |
ПР: |
раствор Н2SO4 в воде(в растворе Н2SO4-Н2O-НSO4--SO42--Н+) |
- твердые |
ПР: |
стекло, сплав Au+Ag |
жидкие растворы образуют жидкость+газ, жидкость+жидкость, жидкость+твердое в-во
различают растворы по размерам частиц растворенного вещества:
-истинные, если размер частиц вещества <1 ммк
ПР: ионный раствор NaCl, молекулярный раствор глюкозы
-коллоидные, если размер частиц вещества 1-100 ммк при таком размере частиц есть граница раздела фаз между частицей вещества-фазой и растворителем-средой ПР: раствор белка
если размер частиц вещества >100 ммк, то образуются суспензии и эмульсии
различают растворы ненасыщенные-насыщенные-перенасыщенные различают растворы разбавленные-концентрированные различают растворы электролитов, растворы неэлектролитов
341)насыщенные, ненасыщенные, перенасыщенные растворы.
2
различают растворы ненасыщенные-насыщенные-перенасыщенные и разбавленные-концентрированные:
насыщенный
содержит max массу в-ва, которая может раствориться при данных условиях,
если в-во добавляют в раствор и в-во больше не растворяется, то такой раствор является насыщенным, между в-вом в растворе и в-вом в осадке устанавливается динамическое равновесие,
max масса в-ва(число), которая может раствориться в 100 г растворителя! – коэффициент растворимости ненасыщенный
содержит растворенного в-ва меньше, чем в насыщенном растворе(при данных условиях), если в-во добавляют в ненасыщенный раствор, то в-во растворяется
перенасыщенный
содержит растворенного в-ва больше, чем в насыщенном растворе(при данных условиях), не устойчив, легко образует насыщенный раствор с выпадением избытка растворенного в-ва в осадок
разбавленный
имеет относительно низкую концентрацию
концентрированный
имеет относительно высокую концентрацию
растворение как физико-химический процесс, гидраты и кристаллогидраты
*Д.И.Менделеев растворение – сложный физико-химический процесс:
физический идет диффузия молекул-атомов–ионов растворяемого в-ва между молекулами растворителя
химический
идет разрушение хим.связей растворяемого в-ва и образование соединений из молекул в-ва и растворителя гидраты - соединения ионов-молекул растворяемого в-ва и молекул воды каждый ион или полярная молекула вещества окружается оболочкой из молекул воды гидратная оболочка удерживается электростатическими силами
чем больше заряд и меньше размеры заряженной частицы, тем сильнее гидратация ПР: NaCl + nH2O Na+*zH2O + Cl-*mH2O
некоторые гидраты - прочные соединения, которые можно выделить из раствора в виде кристаллогидратов кристаллогидрат - кристаллическое соединение растворяемого в-ва и молекул воды
ПР: CuSO4*5H2O медный купорос FeSO4*7H2O железный купорос
CaSO4*2H2O гипс
Na2CO3*10H2O кристаллическая сода
294)термодинамика процесса растворения, энтропийный и энтальпийный факторы
в-во самопроизвольно растворяется, если энергия Гиббса системы «растворяемое вещество-раствор» уменьшается
G = (H - T S) < 0,
где H - энтальпийный фактор, T S - энтропийный фактор
растворение продолжается до образования насыщенного раствора, когда G = 0 и H = T S
при растворении твердых в-в
S > 0, T S > 0, Н > 0(эндотермический процесс) или Н < 0(экзотермический процесс)
-энтропия системы увеличивается S > 0, энтропийный фактор увеличивается T S > 0 увеличение энтропии системы - движущая сила растворения твердых в-в
с ростом температуры рост энтропийного фактора усиливается и растворимость твердых в-в увеличивается
-энтальпия системы зависит от соотношения энергии:
энергии, затраченной на разрушение межмолекулярных связей растворителя, энергии, затраченной на разрушение структуры растворяемого в-ва, энергии, выделяющейся при образовании гидратов-сольватов
изменение энтальпии равно сумме изменения энтальпии за счет разрушения структуры растворяемого в-ва и
изменения энтальпии за счет образования гидратов-сольватов..
H =Hкр + Hгидр
энтальпийный фактор определяет тепловой эффект растворения
если Hкр > Hгидр, то |
энтальпия системы уменьшается |
Н < 0 |
– идет экзотермический процесс |
ПР: для KOH Н =-55,65КДж/моль |
|
|
|
если Hкр < Hгидр, то |
энтальпия системы увеличивается Н > 0 |
– идет эндотермический процесс |
|
ПР: |
|
|
|
при растворении жидких |
в-в |
|
|
S > 0, T S > 0, Н < 0(экзотермический процесс) или |
Н > 0(эндотермический процесс) |
||
-энтропия системы увеличивается S > 0, энтропийный фактор увеличивается T S > 0 увеличение энтропии системы - движущая сила растворения жидких в-в
с ростом температуры рост энтропийного фактора усиливается и растворимость жидких в-в увеличивается
-энтальпия системы зависит от соотношения энергии:
энергии, затраченной на разрушение межмолекулярных связей растворителя, энергии, затраченной на разрушение структуры растворяемого в-ва, энергии, выделяющейся при образовании гидратов-сольватов
изменение энтальпии равно сумме изменения энтальпии за счет разрушения структуры растворяемого в-ва и изменения энтальпии за счет образования гидратов-сольватов..
H =Hкр + Hгидр |
|
|
|
энтальпийный фактор определяет тепловой эффект растворения |
|
|
|
жидкости – |
в-ва с молекулярной структурой и низкой энергией на разрушение структуры растворяемого в-ва |
||
как правило, Hкр > Hгидр и энтальпия системы уменьшается |
Н < 0 |
– идет экзотермический процесс |
|
уменьшение |
энтальпии системы - движущая сила растворения жидких |
в-в |
|

3
при растворении газов в жидкостях
S < 0, T S < 0, Н < 0(экзотермический процесс)
- энтропия системы уменьшается S < 0, энтропийный фактор уменьшается T S < 0
с ростом температуры растворимость газов в жидкостях уменьшается
-энтальпия системы зависит от соотношения энергии:
энергии, затраченной на разрушение межмолекулярных связей растворителя, энергии, затраченной на разрушение структуры растворяемого в-ва, энергии, выделяющейся при образовании гидратов-сольватов
изменение энтальпии равно сумме изменения энтальпии за счет разрушения структуры растворяемого в-ва и
изменения энтальпии за счет образования гидратов-сольватов..
H =Hкр + Hгидр
энтальпийный фактор определяет тепловой эффект растворения газы – в-ва с нулевой энергией на разрушение структуры растворяемого в-ва
Hкр = 0 |
H = Hгидр энтальпия |
системы уменьшается Н < 0 – идет |
экзотермический процесс |
||
уменьшение энтальпии |
системы |
- движущая сила растворения газов |
в |
жидкостях |
|
с ростом температуры |
растворимость газов в жидкостях уменьшается |
|
|||
288)свойства воды как растворителя
вода – растворитель, самый распространенный в природе свойства воды как растворителя:
-высокая диэлектрическая проницаемость - вода активно растворяет вещества с полярными молекулами
-образование водородных связей между частицами в-ва и молекулами воды
-низкая вязкость воды
свойства воды как растворителя определяются строением молекул воды |
|
|
|
|
строение молекулы воды |
|
|
|
|
формула молекулы воды H2O |
|
|
|
|
H |
|
|
|
- |
\ |
|
|
|
|
|
О(II)-2 хим.связь одинарная полярная ковалентная, 105 |
|
|
|
/ |
молекула имеет угловую форму |
_ |
|
- |
H |
|
|
+ |
- |
молекула в виде диполя: 2 неподеленные е-пары атома кислорода образуют (-)полюс |
|
+ |
||
|
2 катиона водорода образуют (+)полюс |
|
|
+ |
диполи воды активно растворяют вещества с полярными молекулами: |
|
|
|
|
полярные - молекулы неорганических веществ, имеющие или ионные связи, или полярные ковалентные связи
полярные - молекулы органических веществ, имеющие полярные функциональные группы |
|
|
|
|
|||||||
полярные молекулы имеют свойства диполей |
|
|
|
|
|||||||
электрический диполь - два точечных заряда, одинаковые по величине и противоположные по знаку, |
|
|
|||||||||
|
находящиеся на расстоянии l друг от друга, которое называется плечом диполя |
|
|||||||||
Р = q l - электрический момент диполя |
|
|
|
|
|
|
|||||
различают молекулы с постоянной полярностью – жесткие диполи, и |
|
|
|
|
|||||||
|
молекулы с непостоянной полярностью – индуцированные диполи |
|
|
|
|
||||||
диполи воды вызывают электролитическую диссоциацию растворяемых в-в или распад в-в на ионы: |
|
|
|||||||||
растворяемые в-ва должны иметь ионные или полярные ковалентные связи |
|
|
|
|
|||||||
вокруг частиц растворяемого в-ва диполи воды образуют гидратные оболочки |
|
|
|
|
|||||||
гидратные оболочки тормозят обратное слипание частиц растворяемого в-ва |
|
|
|
|
|||||||
ПР: HCl |
полярная ковалентная связь |
|
|
|
|
|
|
|
|
|
|
в-во находится в растворенном виде, |
|
|
|
|
|
||||||
в электрическом поле диполя H+Сl- диполи Н2О располагаются упорядоченно, |
|
|
|
|
|||||||
взаимодействие диполей Н+Cl- |
и упорядоченно расположенных диполей Н2О поляризует связь Н+-Cl- до ионной |
||||||||||
взаимодействие диполей Н+-Сl- |
и упорядоченно расположенных диполей Н2О ослабляет связи Н+-Cl-, |
||||||||||
образуются ионы Cl-_и Н+ (свободно не существуют) |
|
|
|
|
|||||||
физическая фаза химическая фаза: |
|
|
|
|
|
H |
|||||
|
|
|
|
|
|
||||||
+ |
|
|
- |
|
|
|
|
|
|||
в электрическом поле ионов Н |
|
и Сl |
|
диполи Н2О располагаются упорядоченно |
|
|
|
||||
гидраты ионов Сl- и ионы гидроксония Н3О+ (донорно-акцепторная связь) |
|
O |
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
NaCl |
ионная связь, ионная кристаллическая решётка |
/ |
\ |
|
|
||||||
|
|
|
|
||||||||
в электрическом поле ионов Na+ |
и Сl- |
диполи Н О располагаются упорядоченно, |
Н |
Н |
|
|
|||||
|
|
|
|
|
|
|
2 |
|
|
|
|
взаимодействие ионов Na+ |
и Cl- |
и диполей Н2О ослабляет связи Na+-Cl-, |
|
|
|
|
|||||
образуются ионы Na+ и Cl- |
(одновременно идет растворение и диссоциация) |
|
|
|
|
||||||
физическая фаза химическая фаза: |
|
|
|
|
|
|
|
|
|
||
в электрическом поле ионов Na+ |
и Сl- |
диполи Н2О располагаются упорядоченно |
|
|
|
|
|||||
гидраты ионов Na+ и Сl- |
|
|
|
|
|
|
|
|
|
||
NaОН ионная связь, ионная кристаллическая решётка
вэлектрическом поле ионов Na+ и ОН- диполи Н2О располагаются упорядоченно, взаимодействие ионов Na+ и ОН- и диполей Н2О ослабляет связи Na+-ОН-, образуются ионы Na+ и ОН- (одновременно идет растворение и диссоциация)
физическая фаза химическая фаза:
вэлектрическом поле ионов Na+ и ОН- диполи Н2О располагаются упорядоченногидраты ионов Na+ и гидроксид-ионы ОН-
гидрофильное и гидрофобное взаимодействие веществ с водой
4
вещества по растворимости в воде делятся на гидрофильные и гидрофобные
-гидрофильные хорошо растворяются в воде состоят из ионов и полярных молекул или молекул с полярными функциональными группами
варианты гидрофильного взаимодействия – ионно-дипольное ПР: растворение NaCl диполь-дипольное ПР: растворение HCl
образование водородных связей ПР: растворение С2Н5ОН
-гидрофобные плохо растворяются в воде состоят из неполярных молекул
гидрофобное взаимодействие – «отталкивание» молекул воды от молекулы в-ва
-дифильные, у которых молекулы имеют и гидрофильные, и гидрофобные группы дифильные молекулы при растворении в воде деформируются так,
чтобы контакт с водой гидрофобных групп уменьшился, а контакт с водой гидрофильных групп увеличился ПР: в воде белковые молекулы приобретают форму глобул
внутри глобул гидрофобные группы, снаружи глобул гидрофильные группы
влияние на растворимость природы компонентов, температуры и давления
факторы, влияющие на растворимость в-в:
-природа растворителя
одно в-во в разных растворителях растворяется по-разному
289) природа в-ва.полярные растворители и неполярные растворители.
различают полярные растворители и неполярные растворители
ПР: вода, спирт – полярные растворители у полярных растворителей полярные молекулы
полярные растворители сильно поляризуются и имеют высокую диэлектрическую проницаемость в полярных растворителях хорошо растворяются в-ва ионной структуры с ионными связями и
молекулярной структуры с полярными ковалентными связями
внеполярных растворителях хорошо растворяются в-ва молекулярной структуры с неполярными ковалентными..
-природа в-ва
водном растворителе разные в-ва растворяются по-разному
некоторые в-ва имеют низкую растворимость ПР: твердые в-ва с прочной атомной кристаллической решеткой практически нерастворимы
в-ва с ионной и полярной ковалентной связью хорошо растворяются в полярных растворителях в-ва с неполярной ковалентной связью плохо растворяются в полярных растворителях ПР:
одна из причин высокой растворимости в-в – образование связей между частицами в-ва и растворителя ПР: при растворении спирта в воде образуются водородные связи между молекулами воды и спирта
ПР: при растворении AgCl в водном растворе NH3 образуются комплексы [Ag(NH3)4]+
-температура и давление, присутствие в растворе других в-в..
если растворение – равновесное состояние, то влияние внешних факторов оценивается по принципу Ле-Шателье
внешние факторы – температура, давление, присутствие других в-в..
график зависимости растворимости от температуры – кривая растворимости..
растворимость твердых в-в в жидкостях
факторы, влияющие на растворимость твердых в-в в жидкостях:
-природа растворителя..
-природа твердого в-ва..
-температура и давление если растворение – равновесное состояние, то влияние внешних факторов оценивается по принципу Ле-Шателье
если растворение эндотермический процесс – при нагревании растворимость твердых в-в в жидкостях увеличивается если растворение экзотермический процесс –
при нагревании растворимость твердых в-в в жидкостях уменьшается объем системы при растворении твердых тел в жидкостях не меняется – повышение давления не влияет на растворимость твердых в-в в жидкостях
-присутствие в растворе других в-в..
290)растворимость жидкостей в жидкостях.Критическая температура растворения.
факторы, влияющие на растворимость жидкостей в жидкостях:
-природа растворителя..
-природа жидкости некоторые жидкости имеют неограниченную растворимость ПР: спирт в воде
некоторые жидкости имеют ограниченную растворимость ПР: раствор анилина в гексане двухслойный – верхний насыщенный р-р анилина в гексане,
нижний насыщенный р-р гексана в анилине если при нагревании растворимость увеличивается,
то ограничение растворимости связано с высокой эндотермичностью растворения таких жидкостей при температуре выше критической температуры растворения растворимость становится неограниченной ПР: раствор анилина в гексане если при охлаждении растворимость увеличивается,
то ограничение растворимости связано с высокой экзотермичностью растворения таких жидкостей

5
при температуре ниже критической температуры растворения растворимость становится неограниченной ПР: раствор диэтиламина в воде некоторые жидкости не растворяются в другой жидкости ПР: бензол не растворяется в воде
если в-во растворяется в обеих жидкостях, а жидкости взаимно не растворяются (не смешиваются), то распределение в-ва между двумя несмешивающимися жидкостями рассчитывается по формуле Нернста-Шилова
291)распределение в-ва между двумя несмешивающимися жидкостями.закон Нернста-
Шилова.
*закон Нернста-Шилова для растворов неэлектролитов соотношение концентрации в-ва, растворенного в двух несмешивающихся жидкостях, постоянно при данной температуре
К |
C |
|
|
в жидкости , |
C , где |
С – молярная концентрация в-ва |
|||
|
|
|
С – молярная концентрация в-ва |
в жидкости , |
|
|
|
К – коэффициент распределения, |
|
зависит от природы компонентов, от температуры важно, что если несмешивающиеся жидкости типа «масло-вода», то
чем лучше в-во растворяется в масле и чем больше его коэффициент распределения, тем лучше оно проникает ч/з липидный слой клеточных мембран путем диффузии
распределение в-в между двумя несмешивающимися жидкостями применяется при экстракции в-в
292)экстракция – метод извлечения в-ва из раствора другим растворителем, который не смешивается с р-ром и лучше растворяет извлекаемое в-во
экстракция с помощью делительной воронки для выделения веществ из растворов и эмульсий:
в делительную воронку вливают исходный раствор и несмешивающийся с ним растворитель-экстрагент вещество из исходного раствора переходит в растворитель для ускорения растворения содержимое воронки перемешивают путем встряхивания затем содержимое воронки отстаивают
при отстаивании содержимое воронки разделяется на раствор и несмешивающийся с ним растворитель образуется 2 слоя: нижний более тяжелый и верхний более легкий нижний слой сливают, разделяя раствор и несмешивающийся с ним растворитель-экстрагент
растворитель будет содержать вещество, перешедшее из исходного раствора ПР: иод растворен в воде и его нужно удалить,
добавляют четыреххлористый углерод, который не растворяется в воде, коэффициент распределения иода в системе «четыреххлористый углерод-вода» равен 85, практически, весь иод перейдет в четыреххлористый углерод
- температура и давление если насыщенный р-р – равновесное состояние, то влияние внешних факторов оценивается по принципу Ле-Шателье
если растворение жидкостей в жидкостях экзотермический процесс – при нагревании растворимость жидкостей в жидкостях уменьшается если растворение жидкостей в жидкостях эндотермический процесс – при нагревании растворимость жидкостей в жидкостях увеличивается
есть критическая температура растворения, выше которой ограниченная растворимость становится неограниченной объем системы при растворении жидкостей в жидкостях не меняется – повышение давления не влияет на растворимость жидкостей в жидкостях
- присутствие в растворе других в-в..
296)факторы, влияющие на растворимость газов в жидкостях
факторы, влияющие на растворимость газов в жидкостях:
-природа растворителя..
-природа газа если у газа полярные молекулы, то они лучше растворяются в полярных растворителях
если газы реагируют с растворителем, то их растворимость увеличивается
ПР: NH3 + H2O NH4OH аммиачная вода или нашатырный спирт( =10%)
если молекулы газов в растворе распадаются на ионы, то их растворимость увеличивается ПР: HCl + Н2О соляная кислота( max=38%)
-температура и давление если насыщенный р-р – равновесное состояние, то влияние внешних факторов оценивается по принципу Ле-Шателье
растворение газов в жидкостях экзотермический процесс - при нагревании растворимость газов в жидкостях уменьшается
только растворение инертных газов в некоторых органических растворителях эндотермический процесс объем системы при растворении газов в жидкостях уменьшается –
300)гипербарическая оксигенация
при повышении давления растворимость газов в жидкостях увеличивается
ПР: при недостаточном кровоснабжении(болезни и травмы сосудов), болезни крови.. ткани недополучают O2 развивается гипоксия тканей, которая может закончиться гибелью клеток если больной будет дышать воздухом под высоким давлением,
то растворение кислорода в крови увеличится.., и ткани получат больше кислорода так действует гипербарическая оксигенация, применяемая для лечения гипоксии тканей
6
299)кессонная болезнь
при понижении давления растворимость газов в жидкостях уменьшается ПР: водолазы под водой дышат воздухом под высоким давлением..
при подъеме на поверхность водолазы дышат воздухом под обычным давлением на глубине в крови растворено больше газов, чем на поверхности
при быстром подъеме водолазов на поверхность в крови образуются пузырьки газов, которые не могут оставаться в крови из-за снижения растворимости
газовые пузырьки в крови закупоривают мелкие сосуды(эмболия) и нарушают кровоснабжение тканей так развивается кессонная болезнь
297)закон Генри для малорастворимых газов..
при постоянной температуре растворимость газов в жидкостях пропорциональна давлению газов над раствором
С = k p,
где С – моляльная концентрация газа в жидкости в моль/1000 г растворителя, k - коэффициент или постоянная Генри для газа
равен молям газа, растворяющегося в 1000 г растворителя при р=1 атм зависит от природы газа, природы растворителя, температуры
если газы реагируют с растворителем или газы в растворе распадаются на ионы, то закон Генри не действует ПР:
297)закон Дальтона для смеси газов
при постоянной температуре растворимость газов газовой смеси в жидкостях пропорциональна парциальному давлению газов над раствором парциальное – давление отдельного газа в газовой смеси
общее давление газа p равно сумме парциальных давлений pi всех газов газовой смеси
парциальное давление газа зависит от молярной доли газа в газовой смеси и рассчитывается по формуле pi = p
учитывая, что у газов молярная доля равна объемной доле , парциальное давление рассчитывается по формуле pi = p = р
- электролиты в растворе
298)закон Сеченова.механизм влияния электролитов на растворимость газов.
электролиты в растворе снижают растворимость газов
C = C0 e-Pc,
где С – моляльная концентрация газа, С0 – моляльная концентрация газа в чистом растворителе,
Р – коэффициент или постоянная Сеченова, зависит от природы газа, природы электролита, температуры с – концентрация электролита
механизм влияния электролитов на растворимость газов: ионы электролитов гидратируются молекулами растворителя
при этом число свободных молекул растворителя уменьшается, и растворимость газов уменьшается
301)идеальный раствор
идеальный – раствор, в котором не происходит взаимодействия молекул в-ва и молекул растворителя, при образовании идеального раствора не изменяется объем р-ра, нет тепловых эффектов особенность идеального раствора –
давление насыщенного пара любого компонента раствора пропорционально концентрации компонента в растворе насыщенный – пар, который находится в равновесии с жидкостью в закрытой системе жидкость газ:
сколько пара образуется при испарении жидкости, столько пара конденсируется, превращаясь в жидкость давление насыщенного пара жидкости при данной температуре постоянно для данной жидкости при повышении температуры давление насыщенного пара жидкости увеличивается к свойствам идеального раствора приближен разбавленный р-р неэлектролита
307)коллигативные свойства растворов неэлектролитов308)Насыщенный пар.
коллигативные – «общие» свойства коллигативные - свойства растворов неэлектролитов «общие» для всех растворов
коллигативные свойства не зависят от природы неэлектролита коллигативные - свойства растворов неэлектролитов, если эти растворы рассматривать как идеальные
при этом при вычислении одного коллигативного параметра определяются другие параметры ПР: давление насыщенного пара,
температура кипения и температура замерзания, осмотическое давление
-давление насыщенного пара р-теля над чистым р-телем выше, чем давление насыщенного пара р-теля над р-ром
р0 > р
в-во, занимая часть объема р-ра, снижает концентрацию р-теля р-тель меньшей концентрации создает меньшее давление насыщенного пара р-теля над р-ром
есть разность давления насыщенного пара р-теля над чистым р-телем и давления насыщенного пара р-теля над р-ром
р = р0 – р
314)эбуллиоскопическая и криоскопическая константа309)закон Рауля для идеального

7
раствора разность давления насыщенного пара растворителя пропорциональна мольной доле растворителя в растворе
р = К р-теля, где К – постоянная Рауля,р-теля - мольная или молярная доля растворителя
относительная разность давления насыщенного пара р-теля равна мольной доле растворенного в-ва
р в ва р0
-Ткип чистого растворителя ниже, чем Ткип раствора ПР: Ткип водных растворов выше 100 С кипение – испарение, которое идет и на поверхности, и внутри жидкости
кипение начинается, когда давление насыщенного пара уравнивается с атмосферным давлением температура начала кипения – температура кипения Ткип если испарение при кипении – равновесное состояние системы жидкость газ,
то влияние внешних факторов оценивается по принципу Ле-Шателье: если у раствора снижается давление насыщенного пара,
то р-р придется дополнительно нагреть, чтобы повысить давление пара до восстановления равновесия разность температуры кипения чистого р-теля и р-ра пропорциональна моляльной концентрации раствора
t = Е C для идеального раствора,
где Е – эбулиоскопическая константа,равная разности температуры кипения при единичной концентрации р-ра
эбулиоскопическая константа зависит от удельной теплоты испарения р-теля и рассчитывается по формуле
RT2
Е, где - удельная теплота испарения растворителя в ../г
1000
эбулиометрия – метод определения разности температуры кипения растворов и растворителя по разности температуры кипения раствора и растворителя определяют моляльную концентрацию раствора
- Тзамерз чистого растворителя выше, чем Тзамерз раствора ПР: Тзамерз водных растворов ниже 0 С если плавление – равновесное состояние жидкость твердое тело, то влияние внешних факторов оценивается по принципу Ле-Шателье:
если у раствора концентрация р-теля снижается – значит равновесие жидкость твердое тело смещается, активируется процесс плавления, который останавливается при более низкой температуре температура начала плавления или начала кристаллизации(замерзания) – температура замерзания Тзамерз разность температуры замерзания пропорциональна моляльной концентрации раствора
t = К C для идеального раствора,
где К – криоскопическая константа, равная разности температуры плавления при единичной концентрации р-ра
криоскопическая константа зависит от удельной теплоты плавления р-теля и рассчитывается по формуле
RT2
К1000 l , где l – удельная теплота плавления растворителя в ../г
криометрия – метод определения разности температуры кипения растворов по разности температуры плавления раствора и растворителя определяют моляльную концентрацию раствора
по температурам кипения и замерзания раствора рассчитывают молекулярную массу растворенного вещества
M |
E mв ва |
M |
K mв ва |
|
t m р теля |
t m р теля |
|||
|
|
302)диффузия
диффузия – взаимное проникновение молекул-атомов-ионов одних веществ между молекулами-атомами-ионами других
врезультате теплового(броуновского) движения молекул-атомов-ионов
внаправлении увеличения энтропии системы
диффузия наблюдается у газов-жидкостей-твердых тел в растворах за счет диффузии происходит выравнивание концентрации в-в:
в-во из области высокой концентрации перемещается в область низкой концентрации
концентрационный градиент
при диффузии вещество из области высокой концентрации перемещается в область низкой концентрации разность концентраций С двух точек, отнесенная к расстоянию х между ними, есть концентрационный градиент
С / х = grad С
303)закон Фика
304)коэффициент диффузии для диффузии в растворах, не разделенных мембранами
скорость диффузии пропорциональна концентрационному градиенту и площади, через которую идет диффузия d /dt = - D S grad С,
где D - коэффициент диффузии в м2/сек,
S - площадь, через которую идет диффузия
d /dt – скорость диффузии в количестве молей переносимого в-ва за единицу времени (моль/сек) анализ уравнения:
скорость диффузии тем больше – чем больше коэффициент диффузии-градиент концентрации-площадь мембраны *А.Эйнштейн М.Смолуховский предложили формулу расчета коэффициента диффузии
D |
RT |
|
1 |
|
– универсальная газовая постоянная R = 8,31 Дж/моль К, |
|
|
, где R |
|||
N A |
6 r |
||||
|
|
|
|
Т |
– абсолютная температура в К, |

8
23 -1
NA - постоянная Авогадро NA = 6,02 10 моль ,- вязкость среды
r - радиус частиц в-ва
анализ уравнения:
-чем больше температура, тем больше коэффициент диффузии
-чем меньше вязкость среды, тем больше коэффициент диффузии
-чем меньше радиус частиц в-ва, тем больше коэффициент диффузии
радиус частиц в-ва увеличивается с ростом молярной массы
поэтому чем больше молярная масса в-ва, тем меньше коэффициент диффузии
305)значение диффузии в биологических процессах
значение диффузии в биологических процессах:
-скорость обмена в-в зависит как от скорости реакций обмена в-в, так от скорости движения реагирующих в-в движение реагирующих веществ в клетках и межклеточном в-ве обусловлено диффузией скорость движения реагирующих веществ в клетках и межклеточном в-ве определяется скоростью диффузии
-питательные вещества и продукты обмена в межклеточном в-ве и в клетках перемещаются путем диффузии
-диффузия лежит в основе пассивного транспорта веществ через клеточные мембраны
различают простую диффузию, ограниченную диффузию, облегченную диффузию облегченная диффузия служит для транспорта крупных ионов и молекул или молекул жиронерастворимых в-в для них из-за большого размера транспорт ч/з клеточные поры невозможен путь транспорта – ч/з мембрану белками-переносчиками (транслоказами)
на внешней стороне мембраны вещество и транслоказы образуют комплексное соединение SX комплексное соединение SX жирорастворимо и диффундирует в липидах мембраны
на внутренней стороне мембраны комплексное соединение SX распадается, и в-во попадает внутрь клетки ПР: транспорт углеводов и аминокислот
е - наружная часть клеточной мембраны, i - внутренняя часть клеточной мембраны, |
|
S – углевод, Х – транслоказа |
|
разные углеводы конкурируют за переносчика |
|
ПР: глюкоза имеет большее сродство к переносчику и переносится |
лучше, чем другие углеводы |
разные аминокислоты конкурируют между собой, но не конкурируют |
с углеводами(у них разные переносчики) |
есть вещества-ингибиторы, которые тормозят транспорт углеводов и аминокислот в клетку |
|
ингибиторы образуют соединения с транслоказами, которые в таком виде не участвуют в транспорте веществ |
|
облегченная диффузия углеводов внутрь клетки рассчитывается по |
уравнению Михаэлиса-Ментен |
I g Imax |
[Se ] |
, где |
Ig |
- поток углеводов, |
|
[Se ] |
|||||
|
|
[Se] - концентрация углеводов снаружи клетки, |
|||
|
|
|
|||
|
|
|
- коэффициент доступности внутриклеточной воды, |
||
|
|
|
|
- сродство углевода к переносчику |
|
кроме пассивного транспорта есть активный транспорт веществ через клеточные мембраны
активный транспорт требует энергии АТФ и служит для транспорта веществ против градиента концентраций |
||
+ |
+ |
|
ПР: активный транспорт ионов Nа+ |
и К+ |
|
активный транспорт ионов Nа |
и К происходит путем хим.реакций в клеточной мембране (К-Nа насос) |
|
в клеточной мембране есть белок «С» или «К-Nа-активируемая АТФ-аза», который |
||
на внешней поверхности мембраны связывает ионы К+ внешней среды |
С + К+ С-К+ |
|
переносит их на внутреннюю поверхность мембраны |
|
|
на внутренней поверхности мембраны освобождает К+ |
С-К+ С + К+ |
|
|
подвергается фосфорилированию |
С + АТФ СФ + АДФ |
|
связывает ионы Nа+ внутри клетки СФ + Na+ СФ-Na+ |
|
соединение СФ-Na+ переносит Na+ на внешнюю поверхность мембраны |
|
|
на внешней поверхности мембраны освобождает Na+ |
СФ-Na+ СФ + Na+ |
|
|
подвергается дефосфорилированию |
СФ С + Ф |
|
связывает ионы К+ внешней среды |
С + К+ С-К+.. |
«К-Nа насос» работает как система двух согласованных циклов |
|
|
первый цикл - ионообменный |
|
|
второй цикл - реакции фосфорилирования и дефосфорилирования |
|
|
активный транспорт Nа+ и К+ |
идет против концентрационного градиента |
|
К+ внутри клетки в 40 раз больше, чем снаружи, Na+ вне клетки в 10 раз больше, чем внутри энергия для выполнения этой работы образуется в результате общей реакции АТФ АДФ + Ф
«NaK-насос» обеспечивает одновременный транспорт 3Na+ и 2К+ на каждую молекулу АТФ
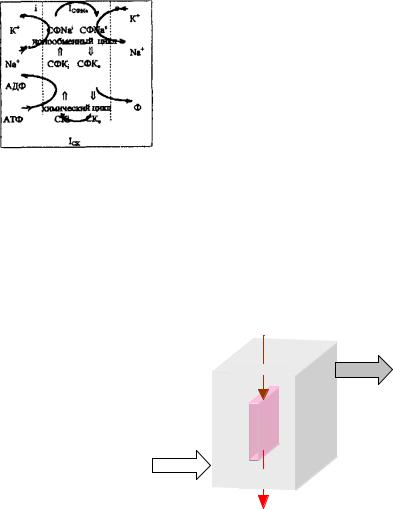
9
i - внутренняя сторона мембраны клетки,
e - наружная сторона мембраны клетки,
+
IСФNa - перенос ионов+Nа от внутренней к наружной стороне мембраны,
IСК - перенос ионов К от наружной к внутренней стороне мембраны
роль диффузии в работе аппарата "искусственная почка"
«искусственная почка» – аппарат очищения крови или аппарат гемодиализа диализ происходит путем диффузии продуктов обмена ч/з полупроницаемую мембрану:
мембрана пропускает низкомолекулярные вещества – мочевину, мочевую кислоту, амины, билирубин.. мембрана не пропускает клетки крови, белки..
артериальная кровь больного поступает в камеры аппарата и, пройдя по камерам, в/венно вливается больному камеры имеют стенки из полупроницаемого материала и омываются раствором-диализатором низкомолекулярные вещества диффундируют по градиенту концентраций из крови ч/з мембрану в р-р-диализатор
315)осмос.
316)полупроницаемые мембраны.
317) осмотическим давлением.
одни полупроницаемые мембраны проницаемы для растворенных в-в, другие - для молекул растворителя если мембрана пропускает только молекулы растворителя, то наблюдается осмос осмос – диффузия молекул растворителя из области низкой концентрации р-ра в область высокой концентрации
в направлении увеличения энтропии системы диффузия р-теля идет в обоих направлениях, но преимущественно в область высокой концентрации р-ра
в результате осмоса объем концентрированного раствора увеличивается и его концентрация снижается происходит выравнивание концентрации р-теля в обоих р-рах происходит выравнивание диффузии р-теля в обоих направлениях - устанавливается равновесие
р-тель, переходящий из области низкой концентрации р-ра в область высокой концентрации, создает давление
такое давление назвали осмотическим давлением
чем больше концентрация р-ра, тем выше осмотическое давление р-ра если к р-ру высокой концентрации приложить внешнее давление, равное осмотическому, то осмос остановится в этом случае внешнее давление – мера осмотического давления
каждый раствор характеризуется осмотическим давлением по отношению к раствору чистого растворителя
317)закон Вант-Гоффа для идеальных растворов - разбавленных р-ров неэлектролитов осмотическое давление пропорционально молярной концентрации р-ра и температуре
= C RT или = / V RT или V = RT уравнение похоже на уравнение Менделеева-Клайперона, где – осмотическое давление,
C - молярная концентрация, R - газовая постоянная,
T - абсолютная температура, V – объем раствора,
- число молей неэлектролита анализ уравнения:
-при равных концентрациях и температуре р-ры разных в-в создают одинаковое осмотическое давление
-для осмотического давления важно число частиц, размеры частиц значения не имеют
318)осмомоляльность. осмомолярность.осмометрия.

10
осмомоляльность – моляльная концентрация всех осмотически активных частиц в растворе в моль/кг осмомолярность – молярная концентрация всех осмотически активных частиц в растворе в моль/л
осмометрия – измерение осмотического давления различают прямой и косвенный методы измерения осмотического давления: прямой метод за счет осмоса в раствор переходит избыток р-теля
избыток растворителя имеет вид столбика жидкости в вертикальной трубке столбик жидкости в вертикальной трубке создает гидростатическое давление
гидростатическое давление избытка р-теля равно осмотическому давлению раствора косвенный метод
если к р-ру высокой концентрации приложить внешнее давление, равное осмотическому, то осмос остановится прекращение осмоса замечают по прекращению изменения объемов растворов в этом случае приложенное внешнее давление равно осмотическому давлению р-ра
319)физиологический раствор,изотонические – растворы с одинаковым осмотическим давлением
осмотическое давление крови человека при 37 С равно 7,7 атм
физиологический раствор – 0,9% раствор NaCl, который изотоничен крови
физраствор применяется как кровезаменитель при кровопотере и как растворитель при введении лекарств
320) гипотонический,гипертонический – раствор, у которого осмотическое давление выше гипертонические растворы применяются для лечения гнойных ран
ток раневой жидкости из раны в повязку очищает рану от гноя.. гипотонический – раствор, у которого осмотическое давление ниже
гипотонические растворы применяются для лечения обезвоживания организма ток воды из крови в клетки и межклеточное вещество восполняет потери воды
321)биологическая роль осмоса.тургор.плазмолиз.лизис.
-осмос определяет высокое содержание воды в внутриклеточном и межклеточном веществе вода же в клетках и межклеточном веществе – необходимое условие нормального обмена веществ
-осмотическое давление внутриклеточных р-ров определяет упругость или тургор клеток и тканей
-биологические жидкости создают осмотическое давление за счет растворенных в них в-в осмотическое давление удерживает р-тель в р-ре и «засасывает» р-тель из менее концентрированного р-ра гидравлическое давление р-ра действует в противоположном направлении осмотическое давление р-ра за счет растворенных белков называется онкотическим давлением
онкотическое давление р-ров, насыщенных белками, соизмеримо с их гидравлическим давлением онкотическое и гидравлическое давление биологических жидкостей в организме сбалансировано при болезнях этот баланс нарушается ПР: если при болезни уменьшается содержание белков в крови,
то вода уходит из крови в межклеточное в-во тканей – ткани отекают, возникают отеки
-клетки в гипертоническом р-ре теряют внутриклеточную воду и сморщиваются - происходит плазмолиз
клеток
-клетки в гипотоническом р-ре набухают до разрыва клеточной оболочки - происходит лизис клеток
-при запорах применяют
322)солевые слабительные
ПР: глауберова соль Na2SO4*10H2O
действие солевых слабительных основано на образовании в просвете кишечника р-ра концентрированных солей, которые сами плохо всасываются, а за счет высокого осмотического давления активно поглощают воду из ..
в итоге, объем каловых масс увеличивается, и активизируется перистальтика кишечника
323)онкотическое давление
осмотическое давление р-ра за счет растворенных белков называется онкотическим давлением онкотическое давление р-ров, насыщенных белками, соизмеримо с их гидравлическим давлением онкотическое и гидравлическое давление биологических жидкостей в организме сбалансировано при болезнях этот баланс нарушается ПР: если при болезни уменьшается содержание белков в крови,
то вода уходит из крови в межклеточное в-во тканей – ткани отекают, возникают отеки
электролиты, неэлектролиты,электролитическая диссоциация
существуют в-ва-электролиты и в-ва-неэлектролиты:
электролиты - в-ва, растворы(расплавы) которых пропускают е-ток ПР: NaCl, NaOH
неэлектролиты – в-ва, растворы(расплавы) которых не пропускают е-ток ПР: метан, сахар, О2
электролитическая диссоциация - распад электролитов на ионы
ПР: NaCl Na+ + Cl- HCl H+ + Cl-
NaOH Na+ + OH-
теория электролитической диссоциации
*1887 Аррениус "теория электролитической диссоциации" *Менделеев, Каблуков ”кристаллогидраты и гидраты” 1) при растворении в воде(расплавлении) молекулы электролитов распадаются на ионы
