
Lekci_6
.pdf
ЛЕКЦИЯ№ 6 Тема: Физико-химия поверхностных явлений в
функционировании живых систем. Адсорбция Цель лекции: познакомить студентов с особым энергетическом
состоянии поверхностного слоя веществ на границах раздела двух фаз; с поверхностным натяжением.
План:
I.Поверхностная энергия Гиббса. Поверхностное натяжение.
II.Самопроизвольные процессы в поверхностном слое
III.Поверхностные свойства растворов
Содержание лекции:
I. Поверхностная энергия Гиббса. Поверхностное натяжение Дисперсные частицы и дисперсионная среда относятся к различным фазам. (Напомним, что фазой называется однородная часть системы, отделѐнная от других частей поверхностью раздела.) Система может существовать из разных фаз только в том случае, если
межмолекулярные взаимодействия в граничных фазах различны.
Для всех коллоидных систем, частицы которых диспергированы в инертной среде и образуют в ней физическую поверхность раздела, процесс диспергирования означает значительное увеличение поверхностной энергии системы. Для увеличения поверхности жидкости нужно преодолеть силу внутреннего давления и совершить определѐнную механическую работу против сил молекулярного сцепления, против внутреннего давления. Очевидно, что чем оно больше, тем больше энергии надо затратить. Эта энергия сосредотачивается в молекулах, находящихся на поверхности, и называется поверхностной энергией. Избыток поверхностной энергии, приходящейся на 1 м2 межфазной поверхности, характеризуется поверхностным натяжением (σ). Бесконечно малое изменение поверхностной энергии Гиббса (dG) с изменением величины площади поверхности при постоянных р и Т равно
dG = σdS,
где dS –бесконечно малое изменение площади поверхности; σ – коэффициент поверхностного натяжения. Из приведѐнного выражения следует (при постоянстве числа молей компонентов n):
1
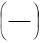
σ = dG
dS T ,p,n
Поверхностное натяжение на границе «жидкость – жидкость» также зависит от природы соприкасающихся фаз: чем больше разность полярностей фаз, тем больше поверхностное натяжение на границе их раздела.
Поверхностное натяжение жидкостей уменьшается с ростом температуры. Это означает, что при критической температуре границы раздела между фазами исчезают и система «газ – жидкость» из гетерогенной превращается в гомогенную. Поэтому величина поверхностного натяжения является мерой гетерогенности системы, причѐм не только «газ – жидкость», но и «жидкость – жидкость».
II.Самопроизвольные процессы в поверхностном слое
К поверхностным явлениям, связанным с уменьшением поверхности, можно отнести:
 стремление капель жидкости или пузырьков газа принять сферическую форму (сферические частицы имеют самую маленькую удельную поверхность);
стремление капель жидкости или пузырьков газа принять сферическую форму (сферические частицы имеют самую маленькую удельную поверхность);
 слипание твѐрдых частиц дисперсной фазы (коагуляция);
слипание твѐрдых частиц дисперсной фазы (коагуляция);
 слипание капель в эмульсиях или пузырьков газа в пенах (коалесценция);
слипание капель в эмульсиях или пузырьков газа в пенах (коалесценция);
 рост кристаллов.
рост кристаллов.
Если площадь межфазной поверхности остаѐтся постоянной, то это возможно за счѐт уменьшения поверхностного натяжения (dσ<0), которое может быть обусловлено процессом адсорбции.
III.Поверхностные свойства растворов
Поверхностные свойства растворов отличаются от поверхностных свойств чистых жидкостей прежде всего тем, что состав поверхностного слоя раствора в той или иной степени отличен от состава внутренних слоѐв раствора.
Растворѐнные вещества в зависимости от природы могут поразному влиять на поверхностное натяжение жидкостей. Способность растворѐнных веществ изменять поверхностное натяжение растворителя называется поверхностной активностью. Все вещества по способности изменять поверхностное натяжение растворителя делятся на три группы.
2

1. Вещества, понижающие поверхностное натяжение, называются
поверхностно-активными вещества (ПАВ). По отношению к водным растворам поверхностно-активными веществами являются спирты, жирные кислоты и их соли (мыла), сложные эфиры, амины, белки и некоторые другие вещества, имеющие дифильное строение. В молекулах таких веществ различают неполярную (гидрофобную) часть
– углеводородный радикал («хвост») и полярную (гидрофильную) часть. Молекулу ПАВ принято изображать следующей схемой:
Прямая линия символизирует неполярную часть - углеводородный радикал («хвост»), а кружок – полярную группу.
Чтобы вещество обладало способностью понижать поверхностное натяжение растворителя, необходимо, чтобы в составе
молекулы имелись полярные группы: -ОН, |
-NH2, -COOH, -SO3 др. |
Поверхностно-активными по отношению к воде являются |
|
вещества менее полярные, чем вода (так, |
дипольный момент воды |
равен 1,84 Д, а у этанола – 1,70 Д). Такие вещества взаимодействуют с водой намного слабее, чем молекулы воды друг с другом. Поэтому, попадая на поверхность, они уменьшают поверхностное натяжение.
Мерой способности растворѐнного вещества к понижению
поверхностного |
натяжения раствора является величина производной |
||
поверхностного |
натяжения по концентрации |
|
, называемая |
|
|||
поверхностной активностью. Единица измерения поверхностной активности названа в честь Дж. Гиббса: 1 гиббс = 10-6 Дж ∙ м / моль.
Поверхностная активность веществ одного и того же гомологического ряда возрастает приблизительно в три раза при увеличении углеводородной цепи на одну метиленовую группу (-СН2-).
ПАВ, как и все вещества в зависимости от способности к электролитической диссоциации, делят на электролиты (ионогенные ПАВ) и неэлектролиты (неионогенные ПАВ). Ионогенные ПАВ подразделяют на катионные, анионные и амфотерные.
2. Вещества, повышающие поверхностное натяжение, называются поверхностно-инактивными (ПИВ). К этим веществам относятся сильные электролиты: соли, кислоты, щѐлочи. Ионы этих веществ, образующиеся в результате электролитической диссоциации, взаимодействуют с молекулами воды сильнее, чем молекулы воды
3
между собой. Поэтому значительная часть ионов увлекается молекулами воды внутрь объѐма раствора. Однако некоторые немногие оставшиеся на поверхности создают вблизи поверхности силовое поле, тем самым повышают поверхностное натяжение.
3. Имеются вещества, которые не меняют поверхностное натяжение растворителя. Эти вещества называют поверхностно-неактивными. Молекулы таких веществ в своѐм составе имеют большое число полярных функциональных групп (например, сахароза).
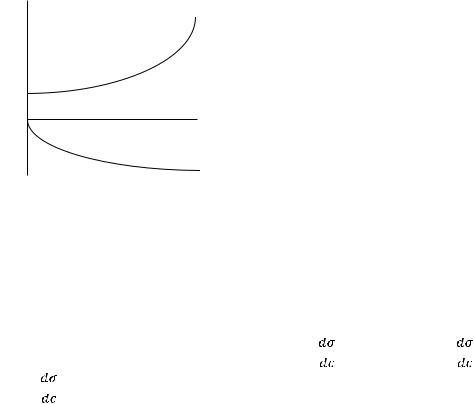
II
σ° |
III |
I
0 |
|
с |
|
Рис. 1. Зависимость поверхностного натяжения водного раствора от концентрации ПАВ (1); ПИВ (2) и не влияющих на величину поверхностного натяжения веществ ПНВ (3).
|
Из графика видно, что для ПАВ |
|
< 0, для |
ПИВ |
|
> 0, а для |
||
|
|
|
||||||
ПНВ |
|
|
= 0. На графике σ0 – поверхностное |
натяжение воды. |
||||
|
|
|||||||
Отметим, что для ПАВ характерно резкое снижение σ даже при малых концентрациях. По мере роста концентрации ПАВ график становится более пологим и, наконец, переходит в горизонтальную прямую, что означает, что поверхностное натяжение достигло своего минимального значения. Увеличение σ под влиянием ПИВ происходит незначительно, что связано с тем, что концентрация ионов в поверхностном слое незначительна и по составу он близок к чистому растворителю.
Отметим, что понятия ПАВ и ПИВ не носят абсолютный характер, они определяются выбранным растворителем, его поверхностным натяжением.
Рекомендуемая литература
Основная:
4
1.Общая химия. Биофизическая химия. Химия биогенных элементов. Учебник для медицинских вузов. (Ю.А. Ершов, В.А. Попков, А.С. Берлянд и др. Ред. Ю.А. Ершов), 8 изд., 560 с. - М.: Высшая шк., 2010 г.
2.Химия. Основы химии живого. Учебник для студентов ВУЗов, обучающихся по естественнонаучным направлениям. В.И. Слесарев. С.-П.: Химиздат.,2001г.
3.Практикум по общей химии. Биофизическая химия. Химия биогенных элементов. Учебное пособие для студентов медицинских вузов (Ред. В.А. Попков). – М.: Высшая школа, 4
изд. 239 с., 2008 г.
4.Сборник задач и упражнений по общей химии. Учебное пособие. (С.А. Пузаков, В.А. Попков, А.А. Филиппова). - М.: Высшая школа, 4 изд. 255 с., 2010.
Дополнительная
1.Общая химия. Учебник для медицинских вузов. (В.А. Попков, С.А. Пузаков), 976 с. - М.: ГЭОТАР Медиа, 2007 г.
2.Методические пособия, рекомендации и т.д., изданные кафедрой:
1. Лекции по общей химии для студентов лечебного и педиатрического факультетов (Ю.А. Алексашин, Ю.В. Куляш, Р. Т. Куцемако), Изд-во СГМУ,186 с., Саратов, 2002.
5
