
- •2) Экстенсивті және интенсивті қасиеттер. Термдік және калориялық қасиеттер.
- •59) 1-Ші текті фазалық ауысымдар. Клапейрон-Клаузиус теңдеуі.
- •10) Идеал газдың қоспасы. Дальтон, Амага заңдары. Қоспаның калориялық қасиеттері.
- •51) Метастабилдік күйлер - өте суытылған бу, өте қыздырылған сұйық, созылған сұйық.
- •18) Термодинамикалық потенциалдар u, h, f, g және олардың іргелі теңдеулері
- •Внутренняя энергия
- •26) Нақты газдың күй теңдеулері.
- •35) Термодинамикалық ұқсастық. Сәйкестік күйлер.
18) Термодинамикалық потенциалдар u, h, f, g және олардың іргелі теңдеулері
Термодинами́ческие потенциа́лы (термодинамические функции) — характеристическая функция в термодинамике, убыль которых в равновесных процессах, протекающих при постоянстве значений соответствующих независимых параметров, равна полезной внешней работе.
Термин был введён Пьером Дюгемом, Гиббс в своих работах использовал термин «фундаментальные функции».
Выделяют следующие термодинамические потенциалы:
внутренняя энергия
энтальпия
свободная энергия Гельмгольца
потенциал Гиббса
большой термодинамический потенциал
Внутренняя энергия
Определяется в соответствии с первым началом термодинамики, как разность между количеством теплоты, сообщенным системе, и работой, совершенной системойнад внешними телами:
![]() .
.
Энтальпия
Определяется следующим образом:
![]() ,
,
где ![]() — давление,
а
— давление,
а ![]() — объём.
— объём.
Поскольку
в изобарном
процессе работа
равна ![]() , приращение энтальпии
в квазистатическом изобарном
процессе равно количеству теплоты,
полученному системой.
, приращение энтальпии
в квазистатическом изобарном
процессе равно количеству теплоты,
полученному системой.
Свободная энергия Гельмгольца
Также часто называемый просто свободной энергией. Определяется следующим образом:
![]() ,
,
где ![]() — температура и
— температура и ![]() — энтропия.
— энтропия.
Поскольку
в изотермическом процессе количество
теплоты, полученное системой, равно ![]() ,
то убыль свободной
энергии в квазистатическом изотермическом
процессе равна работе, совершённой
системой над внешними
телами.
,
то убыль свободной
энергии в квазистатическом изотермическом
процессе равна работе, совершённой
системой над внешними
телами.
Потенциал Гиббса
Также называемый энергией Гиббса, термодинамическим потенциалом, свободной энергией Гиббса и даже просто свободной энергией (что может привести к смешиванию потенциала Гиббса со свободной энергией Гельмгольца):
![]() .
.
43) 1-ші текті фазалық ауысымдар.
Экспериментальные данные при фазовых переходах первого рода :
1)
скачком изменяется удельный объем
 или плотность
или плотность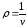 ,
,
2)
скачком изменяется s,
то
есть
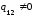 ,
то есть необходима затрата теплоты
фазового перехода,
,
то есть необходима затрата теплоты
фазового перехода,
3) возможны метастабильные состояния.
Примеры: все переходы из одного агрегатного состояния в другое, многие переходы из одних кристаллических модификаций в другие , переход сверхпроводника в несверхпроводящее состояние в магнитном поле и другие.
Так
как
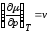 ,
,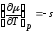 ,
из эксперимента следует, что
,
из эксперимента следует, что
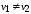 ,
,
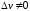 ,
т.е.
,
т.е.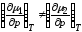 ,
,
 ,
,
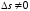 ,
т.е.
,
т.е.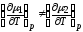 ,
,
в соответствии с классификацией Эренфеста см. рис. 1.
 Рис.
1
Рис.
1
26) Нақты газдың күй теңдеулері.
Менделеев-Клапейрон теңдеуі молекулалары бір-бірімен әсерлеспейтін және нүкте деп қарастырылатын идеал газдардың күйін анықтайды. Нақты газдардың молекуларының өлшемдері болады және олар бір-бірімен өзара әсерлеседі. Нақты газдардың күйін анықтайтын теңдеуді алу үшін голланд ғалымы Ван-дер-Ваальс Менделеев-Клапейрон теңдеуіне молекулаларды өлшемдерін және өзара әсерлесуін ескеретін түзету енгізді. Бұл алынған теңдеу нақты газдардың күй теңдеуі немесе Ван-дер-Ваальс теңдеуі деп аталады. Мөлшері 1 моль нақты газ үшін Ван-дер-Ваальс теңдеуі келесі түрде жазылады:
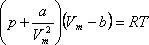 ,
,
мұндағы:![]() -Ван-дер-Ваальс
тұрақтылары, өлшем бірліктері
-Ван-дер-Ваальс
тұрақтылары, өлшем бірліктері![]()
![]() .
Бірінші жақша ішіндегі
.
Бірінші жақша ішіндегі![]() түзетуі
молекулалардың арасындағы тартылыс
күшінің әсерінен пайда болады. Оны кейде
ішкі қысым деп атайды.
түзетуі
молекулалардың арасындағы тартылыс
күшінің әсерінен пайда болады. Оны кейде
ішкі қысым деп атайды.![]() түзетуі
молекулалардың өлшемдерін ескереді.
Кез-келген мөлшердегі нақты газ үшін
Ван-дер-Ваальс теңдеуі
түзетуі
молекулалардың өлшемдерін ескереді.
Кез-келген мөлшердегі нақты газ үшін
Ван-дер-Ваальс теңдеуі![]() екенін
ескере отырып келесі түрде жазылады:
екенін
ескере отырып келесі түрде жазылады:
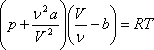 немесе
немесе 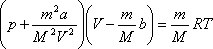 .
.
Нақты
газдардың ішкі энергиясы ![]() өрнегімен
анықталады, мұндағы
өрнегімен
анықталады, мұндағы![]() -
молекулалардың қосынды кинетикалық
энергиясы,
-
молекулалардың қосынды кинетикалық
энергиясы,![]() -молекулалардың
қосынды өзара әсерлесу энергиясы.
-молекулалардың
қосынды өзара әсерлесу энергиясы.![]() энергиясын
анықтайық. Ол үшін молекулалардың
арасындағы тартылу күшінің
жұмысы
энергиясын
анықтайық. Ол үшін молекулалардың
арасындағы тартылу күшінің
жұмысы![]() энергиясының
кемуіне тең екенін ескереміз, яғни
энергиясының
кемуіне тең екенін ескереміз, яғни![]() .
Молекулалардың арасындағы тартылу
күші
.
Молекулалардың арасындағы тартылу
күші![]() ішкі
қысыммен сипатталады. Сондықтан
ішкі
қысыммен сипатталады. Сондықтан![]() және
және![]() .
.
Молекулалардың
қосынды ![]() кинетикалық
энергиясы олардың қозғалысына тәуелді
болады.
кинетикалық
энергиясы олардың қозғалысына тәуелді
болады.
Сондықтан Ван-дер-Ваальс газының 1 молінің ішкі энергиясы
![]() ,
,
мұндағы: ![]() .
.
