
СПКЯ+-+от+пересмотра+представлений+к+новым+терапевтическим+стратегиям
.pdfКомбинированные гормональные контрацептивы
Новые российские клинические рекомендации1 в качестве первого выбора называют именно эти препараты — в режиме монотерапии (КОК, пластырь, влагалищное кольцо) они корригируют нарушения менструального цикла, а так же гирсутизм и акне47. Их действие обусловлено подавлением синтеза ЛГ и овариальных андрогенов. Кроме того, эстрогенный компонент повышает содержание в крови ГСПС, связывающего свободно циркулирующий тестостерон, а антиандрогенный прогестин конкурирует с 5α-редуктазой на уровне рецепторов — всё это понижает биодоступность андрогенов. Затем комбинированные препараты подавляют продукцию АКТГ, снижая выработку андрогенов в надпочечниках50. Продлённые курсы циклической комбинированной гормональной терапии обеспечивают лучшую гормональную супрессию и предотвращают ребаундэффект на уровне яичников, когда на фоне безгормональных промежутков избыточный синтез андрогенов в яичниках скачкообразно восстанавливается51.
Критерии, изложенные в руководстве по приемлемости контрацептивов (уровень доказательности В), могут служить путеводителем для врача, выбирающего препарат для пациентки с СПКЯ52.
Гирсутизм лёгкой или умеренной выраженности можно рассматривать как показание для назначения низкодозированных комбинированных гормональных контрацептивов либо с нейтральным гестагеном, либо с антиандрогенным соединением. При тяжёлой степени гирсутизма или неэффективности монотерапии у женщин с более лёгкими его формами обосновано применение антиандрогенов (уровень доказательности В)53. Оценивать эффективность лечения целесообразно не ранее чем через 6 мес терапии1.
Препараты, содержащие прогестин с остаточной андрогенной активностью, не подходят для пациенток с СПКЯ, поскольку могут усиливать инсулинорезистентность13,54. Данных о долгосрочных эффектах комбинированной гормональной контрацепции у женщин с СПКЯ в отношении углеводного обмена не представлено. С другой стороны, известно, что у здоровых женщин, в том числе у перенёсших гестационный диабет, риск сахарного диабета обоих типов на фоне многолетнего приёма КОК не возрастает. На основании этого Американская диабетическая ассоциация (ADA) совместно с Центрами по контролю и профилактике заболеваний (CDC) делает вывод, что КОК не противопоказаны женщинам с сахарным диабетом, не имеющим сосудистых осложнений55.
Влияние КОК на липидный профиль, по всей видимости, зависит от состава препарата: эстрогеновый компонент повышает содержание в крови ЛПВП и снижает ЛПНП. Тем не менее липиды, вероятно, малочувствительны к остаточным андрогенным свойствам прогестинов. В целом при СПКЯ возможность повысить концентрацию ЛПВП в крови и противодействовать ТГ и ЛПНП — весьма перспективное профилактическое направление13,56–59. На ИМТ приём КОК не влияет60,61.
Один из удачных составов КОК, подходящий для пациенток с СПКЯ, — 30/20 мкг этинилэстрадиола и 3 мг дроспиренона в сочетании с активной формой фолатов (левомефолат кальция)*. Такая комбинация гормонов подавляет
* Препараты «Ярина Плюс» и «Джес Плюс».
19 / StatusPraesens
[ Оптимизация образа жизни корригирует массу тела и улучшает показатели углеводного обмена, однако эффективность диеты и спорта для конкретной пациентки предсказать сложно. ]
активность гонадотропинов за счёт надёжного ингибирования овуляции. Дроспиренон отличается от других прогестинов, используемых в КОК, тем, что структурно и функционально близок спиронолактону*, вследствие чего обладает антиминералокортикоидным действием, что уравновешивает стимуляцию эстрогеном ренин-ангиотензин-альдостероновой системы. Приём такого КОК предотвращает накопление в организме излишков воды. Это предупреждает нагрубание молочных желёз и отёки у пациенток. Андрогенной, эстрогенной, глюкокортикоидной или антиглюкокортикоидной активности у дроспиренона не обнаружено.
Антиандрогенные свойства дроспиренона особенно полезны пациенткам с гиперандрогенией. Установлено, что приём в течение 6–12 циклов препарата с этим компонентом достоверно снижает уровень тестостерона при СПКЯ, увеличивает содержание в крови ГСПС и сокращает клинические проявления гиперандрогении, в том числе тяжесть гирсутизма по шкале Ферримана–Голлвея. Далее, назначение КОК с дроспиреноном женщинам с СПКЯ на 6–12 циклов более выгодно, чем использование препаратов с производными 17α-гидроксипрогестерона — лабораторные и клинические признаки оказались лучше у принимавших дроспиренон62. Изменения липидного профиля также свидетельствовали в пользу дроспиренона по сравнению с хлормадинона ацетатом63.
Интересно, что добавление к КОК с дроспиреноном препарата, содержащего метформин, в течение 6 мес вызывает отрицательную корреляцию между уровнем грелина** (он возрастает) и объёмом абдоминальной жировой ткани (сокращается), что особенно важно у пациенток с ожирением при СПКЯ64. Похожие данные получены в другом исследовании при анализе 6-месячного курса терапии у женщин с СПКЯ этой комбинацией препаратов — снижение массы тела, инсулинорезистентности и улучшение симптоматики эндотелиальной дисфункции (p<0,05)65.
У женщин с СПКЯ, не страдающих ожирением или повышенной массой тела, комбинация КОК с дроспиреноном и метформина тоже показывает успешные результаты: клинические и биохимические признаки гиперандрогении снижаются, липидный профиль демонстрирует тенденции к улучшению. И если монотерапия КОК с дроспиреноном не влияет на чувствительность тканей к инсулину, то сочетание с метформином способно улучшить показатели инсулинорезистентности66.
У женщин с СПКЯ комбинированный гормональный контрацептив с дроспиреноном выравнивает работу гипоталамо-гипофизарно-яичниковой оси: кон-
* Спиронолактон — конкурентный антагонист альдостерона, калийсберегающий диуретик.
** Грелин — пептидный «гормон голода» со свойствами гонадолиберина, его секретируют P/D1-клетки слизистой оболочки желудка. Считается, что он взаимно дополняет «гормон насыщения» лептин, образуемый жировой тканью. Его содержание у пациенток с СПКЯ и ожирением понижено (а лептина — наоборот); снижение массы тела на 7,5% повышает уровень грелина64.
StatusPraesens / 20

центрация тестостерона уменьшается (p<0,01), ДЭАС (p<0,05) и результаты ночного подавляющего теста* с дексаметазоном становятся лучше67.
В России используют либо стандартный режим приёма низкодозированного препарата (с 30 или 20 мкг этинилэстрадиола; 21+7, 24+4), либо непрерывный. По мнению некоторых авторов, терапию СПКЯ оптимально начинать с КОК, содержащих 30–35 мкг этинилэстрадиола68. Тем не менее дозировка 20 мкг этинилэстрадиола в сочетании с 3 мкг дроспиренона доказала свою эффективность при непрерывном режиме использования. Более того, в проспективном исследовании итальянских специалистов с участием 52 женщин с гиперандрогенией (гирсутизм, акне, себорея) были продемонстрированы существенные преимущества непрерывного режима приёма КОК с дроспиреноном: в течение 192 дней удалось сократить число баллов по шкале Ферримана–Голлвея на 78,5% (p<0,001). Проявления акне уменьшились на 58,7%, себореи — на 56% (p<0,001). Концентрация тестостерона и индекс свободных андрогенов снизились, а содержание ГСПС в сыворотке крови, наоборот, возросло (p<0,001)69.
Гибкий пролонгированный режим может оказаться полезным в плане управления прорывными кровотечениями. Так, наблюдение за пациентками при непрерывном приёме КОК с дроспиреноном в течение 3–13 циклов с последующим безгормональным промежутком 4 дня — и с повтором схемы общей продолжительностью до года — показало, что фармакокинетика компонентов и их клиническая эффективность не изменились70.
Метформин
Если назначение комбинированных гормональных контрацептивов невозможно из-за их плохой переносимости или наличия противопоказаний, врачу следует переключить внимание на препарат второй линии. Метформин показан пациенткам с СПКЯ и нерегулярными менструациями13,14, этот представитель группы
* В основе теста лежит подавление секреции АКТГ и, соответственно, снижение продукции кортизола в ответ на приём дексаметазона.
СПКЯ: и тут фолаты
Добавление активного фолата в состав КОК применительно к теме СПКЯ — безусловный плюс, поскольку выявлена достоверная корреляция между этим патологическим состоянием, фолатным дефицитом, гипергомоцистеинемией и частотой полиморфизма генов фолатного цикла37.
Не менее важный практический факт: добавление к метформину в схеме лечения женщин с СПКЯ фолиевой кислоты позволило эффективнее восстанавливать эндотелиальную функцию71. Учитывая более высокую распространённость в когорте женщин с СПКЯ дефектных генов фолатного метаболизма, следует использовать именно активные формы фолатов.
21 / StatusPraesens
бигуанидов* способен повышать чувствительность тканей к инсулину. Он подавляет глюконеогенез в печени, усиливает периферическое действие инсулина в скелетных мышцах и снижает всасывание глюкозы из пищеварительного тракта72.
У женщин с ожирением, страдающих СПКЯ, метформин способен восстанавливать нарушенную продукцию нейропептида Y**, что может нормализовать аппетит73,74. Кроме того, препарат усиливает липолиз, однако эти данные требуют дальнейшего подтверждения75. У некоторых пациенток использование метформина улучшает липидный профиль и подавляет синтез андрогенов текальными клетками — эти аспекты тоже пока недостаточно изучены72,76. Метформин не показан для лечения гирсутизма, акне (уровень доказательности А)13,53 и ожирения (уровень доказательности С). Однако пациенткам с СПКЯ, нарушением толерантности к глюкозе и сахарным диабетом 2-го типа, а также при неэффективности коррекции образа жизни и диеты метформин, напротив, показан (уровень доказательности В).
У пациенток с СПКЯ и бесплодием применение метформина рекомендовано только при нарушениях углеводного обмена или для профилактики синдрома гиперстимуляции яичников.
Антиандрогены
При гирсутизме приём препаратов этой группы обеспечивает хорошие результаты, однако монотерапию используют только при противопоказаниях к применению комбинированных гормональных контрацептивов или при их непереносимости (уровень доказательности А)53. Как правило, за рубежом назначают спиронолактон (150– 200 мг в день), а в России — ципротерона ацетат (10–100 мг в день) в циклическом или непрерывном режиме.
Существует несколько «красных флагов», возбраняющих применение антиандрогенов. Так, назначение этих препаратов требует обеспечения надёжной контрацепции53. Сочетание спиронолактона с комбинированными гормональными контрацептивами повышает содержание триглицеридов в крови72,77. Флутамид вследствие его гепатотоксичности не рекомендован для лечения гирсутизма (уровень доказательности В), как и финастерид, при СПКЯ в России он не зарегистрирован52.
В качестве дополнения к медикаментозной терапии при гирсутизме рекомендуют косметические методы удаления волос, такие как фотоэпиляция (уровень доказательности А)53.
В тяжёлых случаях акне наряду с антиандрогенами и кортикостероидами могут быть назначены системные антибиотики группы тетрациклинов, макролидов и изотретиноин*** (уровень доказательности А)50,78. Важно помнить, что эти назначения должны исходить от дерматолога, и в течение всего курса, а также
*Лекарственные средства с гипогликемическим действием; применяют при сахарном диабете 2-го типа.
**Стимулятор пищевой активности, содержится в секрете поджелудочной железы, гипоталамической и кортикальной областях мозга; его избыточная выработка может служить причиной гипоталамического ожирения.
***Изотретиноин — дерматотропное средство, A-витаминоподобное, противовоспалительное, противоугревое и противосеборейное.
StatusPraesens / 22
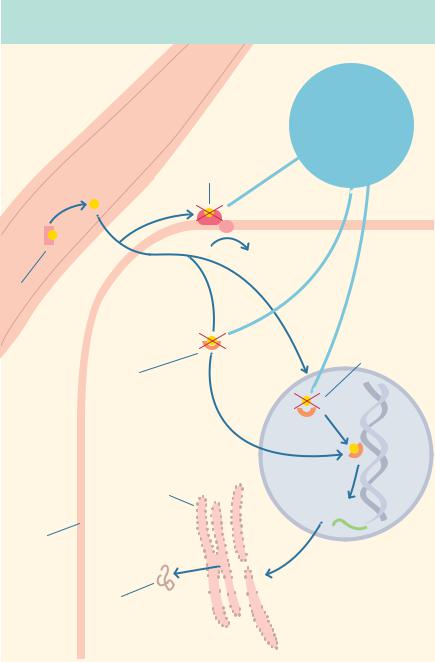
Антиандрогенная терапия: точки приложения – рецепторы
Дроспиренон
Спиронолактон Ципротерона ацетат Хлормадинона ацетат
Стероид Поверхностный Флутамид  рецептор
рецептор
Быстрый ответ
Транспортный
белок
Ядерный
рецептор
Цитоплазматический
рецептор
Эндоплазматический
ретикулум
Транскрипция
Цитоплазматическая
мембрана



 Трансляция Белок
Трансляция Белок 




23 / StatusPraesens
[ Фармакотерапия абсолютно необходима пациенткам с ИМТ более 30 либо 27 кг/м2 при наличии хотя бы одного из следующих осложнений: артериальной гипертензии, дислипидемии, сахарного диабета 2-го типа, облитерирующего атеросклероза. ]
1 мес до и после терапии ретиноидами (изотретиноин) пациентке обязательно назначают надёжную контрацепцию1.
Коррекция метаболических расстройств
Оптимизация образа жизни с включением физических упражнений и диеты79 помогает пациенткам снизить массу тела, снижает риск заболеваний сердца и со судов, а также сахарного диабета 2-го типа. Эти меры показаны пациенткам с СПКЯ, страдающим ожирением или избыточной массой тела. Режимный подход способствует нормализации менструальной функции и улучшает показатели углеводного обмена, однако насколько эффективным он окажется у конкретной пациентки — предсказать сложно13. Также важно понимать, что снижение массы тела за счёт физических нагрузок и диеты не влияет на гирсутизм (уровень доказательности А).
Недавнее руководство Международного эндокринологического общества рекомендует поведенческую и медикаментозную терапию ожирения и избыточного веса в целом для популяции. Фармакотерапия необходима пациентам с ИМТ более 30 или 27 кг/м2 при наличии хотя бы одного из следующих осложнений: артериальной гипертензии, дислипидемии, сахарного диабета 2-го типа, облитерирующего атеросклероза. При ИМТ более 40 кг/м2 или более 35 кг/м2 при наличии осложнений, связанных с ожирением, рекомендуются методы бариатрической хирургии (уровень доказательности С)80. Большинство экспертов не поддерживают рутинную фармакотерапию ожирения и избыточного веса при СПКЯ1,81.
Лечение бесплодия
Ановуляторное бесплодие — частый спутник СПКЯ, поэтому у женщин, заинтересованных в беременности, рекомендуют оценивать менструальную и овуляторную функцию. Исключив другие причины бесплодия в паре (трубно-перитонеальный, мужской факторы и др.), следует обеспечить овуляторность цикла13. Основные принципы лечения бесплодия при СПКЯ описаны в консенсусе, опубликованном группой экспертов в 2008 году82. Один из ключевых его пунктов — лечение ожирения, гиперандрогении, инсулинорезистентности должно предшествовать индукции овуляции. Также предварительно оценивают ИМТ, возраст пациентки и наличие прочих факторов бесплодия. Повышенное содержание свободного тестостерона, высокий ИМТ, аменорея и увеличенный объём яичников — предикторы неудачи. В качестве средства первой линии для индукции овуляции используют кломифена
StatusPraesens / 24

цитрат (уровень доказательности А)1,13,81, возможно использование летрозола (уровень доказательности В)14,83.
При неэффективности кломифена цитрата или невозможности его применения проводят стимуляцию овуляции гонадотропинами или лапароскопическую каутеризацию (уровень доказательности В). При СПКЯ предпочтителен так называемый Step-up-режим назначения препарата ФСГ (постепенное увеличение дозировки гонадотропина от 37,5–50 ME/сут). Если фолликулы не растут, через неделю дозу ФСГ повышают в 1,5 раза, а при адекватном росте — не меняют. Продолжительность использования гонадотропинов не должна превышать шести циклов, при этом необходимо контролировать овариальный ответ81.
Эффективность лапароскопической каутеризации яичников и использования гонадотропинов сопоставимы. С одинаковой результативностью применяют электрокаутеризацию и лазер (уровень доказательности А)1,82. При СПКЯ, чтобы избежать риска преждевременной овариальной недостаточности, не следует выполнять более четырёх пункций яичника. Если через 12 нед после вмешательства овуляции нет (так бывает у половины пациенток), то рекомендован приём кломифена цитрата. После 6 мес его применения возможно назначение гонадотропинов81.
Среди изобилия научных знаний о СПКЯ весьма значителен объём новой информации, имеющей важное прикладное значение, однако по различным причинам программа обследования и лечебные подходы на местах, в реальной клинической практике, зачастую меняются слишком медленно. Доказательные данные свидетельствуют, что СПКЯ далеко не так прост, как могло казаться раньше, — настало время определять клинический фенотип пациенток, интересоваться их метаболическим профилем, учитывать возможность инсулинорезистентности и выраженность висцерального ожирения. Важно не ограничиваться назначением гормональной контрацепции как таковой — нужно учитывать антиандрогенные свойства гестагенов, корригировать метаболические расстройства и микронутриентный статус. Только такой подход обеспечит заботу о здоровье женщины в целом, а не только о полноценности её менструального цикла.
При этом важно, что сейчас в России это будет проходить в полном соответствии с требованиями доказательной медицины, поскольку именно качественные клинические рекомендации1 позволяют суммировать и максимально быстро внедрять в практику все достижения науки, заслуживающие внимания клинициста. 
Литература
1.Синдром поликистозных яичников в репродуктивном возрасте (современные подходы к диагностике и ле чению): Клинические рекомендации (протокол лечения). М.: Минздрав России, 2015. 22 с. — URL: http://www. zdrav.nso.ru/sites/zdrav.nso.ru/wodby_files/files/ document/2015/10/documents/sindrom_polikistoznyh_ yaichnikov_v_reproduktivnom_vozraste.pdf.
2.Livadas S., Diamanti-Kandarakis E. Polycystic ovary syndrome: definitions, phenotypes and diagnostic approach // Front. Horm. Res. 2013. Vol. 40. P. 1–21. [PMID: 24002401.]
3.Joseph S. et al. PCOSKB: A KnowledgeBase on genes, diseases, ontology terms and biochemical pathways associated with PolyCystic Ovary Syndrome // Nucleic. Acids. Res. 2015. Vol. 44 (D1). P. d1032–d1035. [PMID: 26578565.]
4.Joham A.E. et al. Prevalence of infertility and use of fertility treatment in women with polycystic ovary syndrome: data from a large community-based cohort study // J. Womens Health. 2015. Vol. 24. №4. P. 299–307. [PMID: 25654626.]
5.Azziz R. et al. The Androgen Excess and PCOS Society criteria for the polycystic ovary syndrome: the complete task force report // Fertil. Steril. 2009. Vol. 91. №2. P. 456–488. [PMID: 18950759.]
6.Carmina E. et al. Extensive clinical experience: relative prevalence of different androgen excess disorders in 950 women referred because of clinical hyperandrogenism // J. Clin. Endocrinol. Metab. 2006. Vol. 91. №1. P. 2–6. [PMID: 16263820.]
7.Chen X. et al. Prevalence of polycystic ovary syndrome in unselected women from southern China // Eur. J. Obstet. Gynecol. Reprod. Biol. 2008. Vol. 139. №1. P. 59–64. [PMID: 18378061.]
8.Polycystic ovary syndrome. Novel insights into causes and therapy / Ed. by D. Macut. Basel: Karger, 2013.
176р.
9.Leiviskä J. et al. Apolipoprotein A-I and B in laboratory diagnostics of dyslipidemia--what benefits do we gain compared with cholesterol measurements? // Duodecim Lääketieteellinen Aikakauskirja. 2014. Vol. 130. №22–23. P. 2331–2337. [PMID: 25558595.]
10.Ng D.S. Diabetic dyslipidemia: from evolving pathophysiological insight to emerging therapeutic targets // Can. J. Diabetes. 2013. Vol. 37. №5. P. 319–326. [PMID: 24500559.]
11.Samad F., Ruf W. Inflammation, obesity, and thrombosis // Blood. 2013. Vol. 122. №20. P. 3415–3422. [PMID: 24092932; PMCID: PMC3829115.]
12.Pal L. Polycystic ovary syndrome: current and emerging concepts. New York: Springer, 2014. 340 р.
13.GoodmanN.F.,CobinR.H.,FutterweitW.etal.American Association of Clinical Endocrinologists, American College of Endocrinology, and Androgen Excess and PCOS Society Disease State Clinical Review: Guide to the Best Practices in the Evaluation and Treatment of Polycystic Ovary Syndrome. Part 2 // Endocr. Pract. 2015. Vol. 21 (12). P. 1415–1426. [PMID: 26642102.]
14.Picardi A., Lega I., Tarolla E. Suicide risk in skin disorders // Clin. Dermatol. 2013. Vol. 31. №1. P. 47–56. [PMID: 23245973.]
15.Yavari M. et al. A neuropsychiatric complication of oligomenorrhea according to iranian traditional medicine // Iran. J. Reprod. Med. 2014. Vol. 12. №7. P. 453–458. [PMID: 25114666.]
16.Bird S.T. et al. Risk of venous thromboembolism in women with polycystic ovary syndrome: a populationbased matched cohort analysis // CMAJ Can. Med. Assoc. J. J. Assoc. Medicale Can. 2013. Vol. 185. №2. P. E115– E120. [PMID: 23209115.]
17.Dokras A. et al. Increased prevalence of anxiety symptoms in women with polycystic ovary syndrome: systematic review and meta-analysis // Fertil. Steril. 2012. Vol. 97. №1. P. 225–230. P. e2. [PMID: 22127370.]
18.Dokras A. Mood and anxiety disorders in women with PCOS // Steroids. 2012. Vol. 77. №4. P. 338–341. [PMID: 22178257.]
19.Carmina E., Campagna A.M., Fruzzetti F., Lobo R.A. AMH measurement versus ovarian ultrasound in the diagnosis of polycystic ovary syndrome (PCOS) in different phenotypes // Endocr. Pract. Off. J. Am. Coll. Endocrinol. Am. Assoc. Clin. Endocrinol. 2015. [Epub ahead of print.] [PMID: 26523627.]
20.Vink J.M., Sadrzadeh S., Lambalk C.B., Boomsma D.I. Heritability of polycystic ovary syndrome in a Dutch twinfamily study // J. Clin. Endocrinol. Metab. 2006. Vol. 91. №6. P. 2100–2104. [PMID: 16219714.]
21.Jiang B., Kenna H.A., Rasgon N.L. Genetic overlap between polycystic ovary syndrome and bipolar disorder: the endophenotype hypothesis // Med. Hypotheses. 2009. Vol. 73. №6. P. 996–1004. [PMID: 19556071.]
22.Abbott D.H., Nicol L.E., Levine J.E. et al. Nonhuman primate models of polycystic ovary syndrome // Mol. Cell. Endocrinol. 2013. Vol. 373. №1–2. P. 21–28. [PMID: 23370180.]
23.Welt C.K., Carmina E. Clinical review: Lifecycle of polycystic ovary syndrome (PCOS): from in utero to menopause // J. Clin. Endocrinol. Metab. 2013. Vol. 98. №12. P. 4629–4638. [PMID: 24064685.]
24.Duleba A.J., Dokras A. Is PCOS an inflammatory process? // Fertil. Steril. 2012. Vol. 97. №1. P. 7–12. [PMID: 22192135.]
25.Wildman R.P. et al. Body size phenotypes and inflammation in the Women’s Health Initiative Observational Study // Obes. Silver Spring Md. 2011. Vol. 19. №7. P. 1482–1491. [PMID: 21233809.]
26.Mukherjee S., Maitra A. Molecular and genetic factors contributing to insulin resistance in polycystic ovary syndrome // Indian J. Med. Res. 2010. Vol. 131. P. 743–760. [PMID: 20571162.]
27.Barbieri R.L. et al. Insulin stimulates androgen accumulation in incubations of ovarian stroma obtained from women with hyperandrogenism // J. Clin. Endocrinol. Metab. 1986. Vol. 62. №5. P. 904–910. [PMID: 3514651.]
28.Paschou S.A. et al. Birth weight and polycystic ovary syndrome in adult life: is there a causal link? // PloS One. 2015. Vol. 10. №3. P. e0122050. [PMID: 25790331.]
29.Burt Solorzano C.M. et al. Neuroendocrine dysfunction in polycystic ovary syndrome // Steroids. 2012. Vol. 77. №4. P. 332–337. [PMID: 22172593.]
StatusPraesens / 26
30.Pastore L.M. et al. Beta Endorphin Levels in PCOS Women: Relationship With Insulin Secretion // J. Endocrinol. Metab. 2012. Vol. 2 (1). P. 11–20.
31.McCartney C.R. et al. Maturation of luteinizing hormone (gonadotropin-releasing hormone) secretion across puberty: evidence for altered regulation in obese peripubertal girls // J. Clin. Endocrinol. Metab. 2009. Vol. 94. №1. P. 56–66. [PMID: 18957503.]
32.Lawson M.A. et al. Evidence for insulin suppression of baseline luteinizing hormone in women with polycystic ovarian syndrome and normal women // J. Clin. Endocrinol. Metab. 2008. Vol. 93. №6. P. 2089–2096. [PMID: 18334581.]
33.Puri M. et al. MTHFR C677T polymorphism, folate, vitamin B12 and homocysteine in recurrent pregnancy losses: a case control study among North Indian women // J. Perinat. Med. 2013. Vol. 41. №5. P. 549–554. [PMID: 23612630.]
34.Steegers-Theunissen R.P. et al. Hyperhomocysteinemia, pregnancy complications, and the timing of investigation // Obstet. Gynecol. 2004. Vol. 104. №2. P. 336–343. [PMID: 15292008.]
35.Van Mil N.H., Oosterbaan A.M., Steegers-Theunis- sen R.P.M. Teratogenicity and underlying mechanisms of homocysteine in animal models: a review // Reprod. Toxicol. Elmsford N. 2010. Vol. 30. №4. P. 520–531. [PMID: 20656016.]
36.Pandey K. et al. Hyperhomocysteinemia as a Risk Factor for IUGR // J. Obstet. Gynaecol. India. 2012. Vol. 62. №4. P. 406–408. [PMID: 23904699.]
37.Qi Q. et al. Association of methylenetetrahydrofolate reductase gene polymorphisms with polycystic ovary syndrome // Chin. J. Med. Genet. 2015. Vol. 32. №3. P. 400–404. [PMID: 26037361.]
38.Rotterdam ESHRE/ASRM-Sponsored PCOS Consensus Workshop Group. Revised 2003 consensus on diagnostic criteria and long-term health risks related to polycystic ovary syndrome // Fertil. Steril. 2004. Vol. 81. №1. P. 19–25. [PMID: 14711538.]
39.Evidence-based Methodology Workshop on Polycystic Ovary Syndrome December 3–5, 2012 // 2012. Bethesda, Maryland: National Institutes of Health, 2012. 14 p.
40.Yildiz B.O. et al. Visually scoring hirsutism // Hum. Reprod. Update. 2010. Vol. 16. №1. P. 51–64. [PMID: 19567450.]
41.Karrer-Voegeli S. et al. Androgen dependence of hirsutism, acne, and alopecia in women: retrospective analysis of 228 patients investigated for hyperandrogenism // Medicine (Baltimore). 2009. Vol. 88. №1. P. 32–45. [PMID: 19352298.]
42.Legro R.S. et al. Total testosterone assays in women with polycystic ovary syndrome: precision and correlation with hirsutism // J. Clin. Endocrinol. Metab. 2010. Vol. 95. №12. P. 5305–5313. [PMID: 20826578.]
43.González F. et al. Reactive oxygen species-induced oxidative stress in the development of insulin resistance and hyperandrogenism in polycystic ovary syndrome // J. Clin. Endocrinol. Metab. 2006. Vol. 91. №1. P. 336–340. [PMID: 16249279.]
44.Melmed S. et al. Diagnosis and treatment of hyperprolactinemia:anEndocrineSocietyclinicalpracticeguideline//
J. Clin. Endocrinol. Metab. 2011. Vol. 96. №2. P. 273–288. [PMID: 21296991.]
45.Veltman-Verhulst S.M. et al. Fasting glucose measurement as a potential first step screening for glucose metabolism abnormalities in women with anovulatory polycystic ovary syndrome // Hum. Reprod. Oxf. Engl. 2013. Vol. 28. №8. P. 2228–2234. [PMID: 23739218.]
46.Alberti K.G. et al. Harmonizing the metabolic syndrome: a joint interim statement of the International Diabetes Federation Task Force on Epidemiology and Prevention; National Heart, Lung, and Blood Institute; American Heart Association; World Heart Federation; International Atherosclerosis Society; and International Association for the Study of Obesity // Circulation. 2009. Vol. 120. №16. P. 1640–1645. [PMID: 19805654.]
47.GoodmanN.F.,CobinR.H.,FutterweitW.etal.American Association of Clinical Endocrinologists, American College of Endocrinology, and Androgen Excess and PCOS Society Disease State Clinical Review: Guide to the Best Practices in the Evaluation and Treatment of Polycystic Ovary Syndrome. Part 1 // Endocr. Pract. 2015. Vol. 21 (11). P. 1291–300. [PMID: 26509855]
48.Wild R.A. et al. Assessment of cardiovascular risk and prevention of cardiovascular disease in women with the polycystic ovary syndrome: a consensus statement by the Androgen Excess and Polycystic Ovary Syndrome (AE-PCOS) Society // J. Clin. Endocrinol. Metab. 2010. Vol. 95. №5. P. 2038–2049. [PMID: 20375205.]
49.Speiser P.W. et al. Congenital adrenal hyperplasia due to steroid 21-hydroxylase deficiency: an Endocrine Society clinical practice guideline // J. Clin. Endocrinol. Metab. 2010. Vol. 95. №9. P. 4133–4160. [PMID: 20823466.]
50.Fauser B.C.J.M. et al. Consensus on women’s health aspects of polycystic ovary syndrome (PCOS): the Amsterdam ESHRE/ASRM-Sponsored 3rd PCOS Consensus Workshop Group // Fertil. Steril. 2012. Vol. 97. №1. P. 28–38.e25. [PMID: 22153789.]
51.Legro R.S. et al. Effects of continuous versus cyclical oral contraception: a randomized controlled trial // J. Clin. Endocrinol. Metab. 2008. Vol. 93. №2. P. 420–429. [PMID: 18056769.]
52.Altshuler A.L., Gaffield M.E., Kiarie J.N. The WHO’s medical eligibility criteria for contraceptive use: 20 years of global guidance // Curr. Opin. Obstet. Gynecol. 2015. Vol. 27 (6). P. 451–459. [26390246.]
53.Escobar-Morreale H.F. et al. Epidemiology, diagnosis and management of hirsutism: a consensus statement by the Androgen Excess and Polycystic Ovary Syndrome Society // Hum. Reprod. Update. 2012. Vol. 18. №2. P. 146–170. [PMID: 22064667.]
54.Lopez L.M., Grimes D.A., Schulz K.F. Steroidal contraceptives: effect on carbohydrate metabolism in women without diabetes mellitus // Cochrane Database Syst. Rev. 2009. Vol. 4. Art. No. CD006133. [PMID: 19821355.]
55.Centers for Disease Control and Prevention (CDC). U S. Medical Eligibility Criteria for Contraceptive Use, 2010 // MMWR Recomm. Rep. Morb. Mortal. Wkly. Rep. Recomm. Rep. Cent. Dis. Control. 2010. Vol. 59. №RR-4. P. 1–86. [PMID: 20559203.]
56.Cagnacci A. et al. Insulin sensitivity and lipid metabolism with oral contraceptives containing chlormadinone ac-
27 / StatusPraesens
etate or desogestrel: a randomized trial // Contraception. 2009. Vol. 79. №2. P. 111–116. [PMID: 19135567.]
57.Frempong B.A. et al. Effect of low-dose oral contraceptives on metabolic risk factors in African-American women // J. Clin. Endocrinol. Metab. 2008. Vol. 93. №6. P. 2097–2103. [PMID: 18334585.]
58.Winkler U.H., Sudik R. The effects of two monophasic oral contraceptives containing 30 mcg of ethinyl estradiol and either 2 mg of chlormadinone acetate or 0.15 mg of desogestrel on lipid, hormone and metabolic parameters // Contraception. 2009. Vol. 79. №1. P. 15–23. [PMID: 19041436.]
59.Hoeger K. et al. The impact of metformin, oral contraceptives, and lifestyle modification on polycystic ovary syndrome in obese adolescent women in two randomized, placebo-controlled clinical trials // J. Clin. Endocrinol. Metab. 2008. Vol. 93. №11. P. 4299–4306. [PMID: 18728175.]
60.Domecq J.P. et al. Lifestyle Modification Programs in Polycystic Ovary Syndrome: Systematic Review and Me- ta-Analysis // J. Clin. Endocrinol. Metab. 2013. Vol. 98. №12. P. 4655–4663. [PMID: 24092832.]
61.Gallo M.F. et al. Combination contraceptives: effects on weight // Cochrane Database Syst. Rev. 2008. Vol. 4. Art. No. CD003987. [PMID: 18843652.]
62.Mathur R., Levin O., Azziz R. Use of ethinylestradiol/ drospirenone combination in patients with the polycystic ovary syndrome // Ther Clin. Risk Manag. 2008. Vol. 4. №2. P. 487–492. [PMID: 18728832.]
63.Yildizhan R. et al. Comparison of the effects of chlormadinone acetate versus drospirenone containing oral contraceptives on metabolic and hormonal parameters in women with PCOS for a period of two-year follow-up // Gynecol. Endocrinol. Off. J. Int. Soc. Gynecol. Endocrinol. 2015. Vol. 31. №5. P. 396–400. [PMID: 25739031.]
64.Cakiroglu Y., Vural B., Isgoren S. The effects of dr- ospirenone-ethinyl estradiol and drospirenone-ethinyl estradiol + metformin on ovarian ultrasonographic markers, body fat mass index, leptin, and ghrelin // Arch. Gynecol. Obstet. 2013. Vol. 288. №1. P. 213–220. [PMID: 23377194.]
65.Ilie I.R. et al. Ethinylestradiol30μg-drospirenone and metformin: could this combination improve endothelial dysfunction in polycystic ovary syndrome? // BMC Endocr. Disord. 2012. Vol. 12. P. 9. [PMID: 22713099.]
66.Aydin K. et al. Body composition in lean women with polycystic ovary syndrome: effect of ethinyl estradiol and drospirenone combination // Contraception. 2013. Vol. 87. №3. P. 358–362. [PMID: 22898361.]
67.Macut D. et al. The influence of combined oral contraceptives containing drospirenone on hypothalamic- pituitary-adrenocortical axis activity and glucocorticoid receptor expression and function in women with polycystic ovary syndrome // Horm. Athens Greece. 2015. Vol. 14. №1. P. 109–117. [PMID: 25402380.]
68.Hohl A., Ronsoni M.F., Oliveira M. de. Hirsutism: diagnosis and treatment // Arq. Bras. Endocrinol. Metabol. 2014. Vol. 58 (2). P. 97–107. [PMID: 24830586.]
69.Caruso S. et al. Hyperandrogenic women treated with a continuous-regimen oral contraceptive // Eur. J. Obstet. Gynecol. Reprod. Biol. 2013. Vol. 171. №2. P. 307–310. [PMID: 24183349.]
70.Reif S., Snelder N., Blode H. Characterisation of the pharmacokinetics of ethinylestradiol and drospirenone in extended-cycle regimens: population pharmacokinetic
analysis from a randomised Phase III study // J. Fam. Plan. Reprod. Health Care Fac. Fam. Plan. Reprod. Health Care R. Coll. Obstet. Gynaecol. 2013. Vol. 39. №2. P. e1–13. [PMID: 23493606.]
71.Palomba S. et al. Effects of metformin with or without supplementation with folate on homocysteine levels and vascular endothelium of women with polycystic ovary syndrome // Diabetes Care. 2010. Vol. 33. №2. P. 246–251. [PMID: 19933994.]
72.Bargiota A., Diamanti-Kandarakis E. The effects of old, new and emerging medicines on metabolic aberrations in PCOS // Ther. Adv. Endocrinol. Metab. 2012. Vol. 3. №1. P. 27–47. [PMID: 23148192.]
73.Barber T.M. et al. Ghrelin levels are suppressed and show a blunted response to oral glucose in women with polycystic ovary syndrome // Eur. J. Endocrinol. Eur. Fed. Endocr. Soc. 2008. Vol. 158. №4. P. 511–516. [PMID: 18362298.]
74.Romualdi D. et al. Alteration of ghrelin-neuropeptide Y network in obese patients with polycystic ovary syndrome: role of hyperinsulinism // Clin. Endocrinol. (Oxf.). 2008. Vol. 69. №4. P. 562–567. [PMID: 18248643.]
75.Diamanti-Kandarakis E. et al. Metformin: an old medication of new fashion: evolving new molecular mechanisms and clinical implications in polycystic ovary syndrome // Eur. J. Endocrinol. Eur. Fed. Endocr. Soc. 2010. Vol. 162. №2. P. 193–212. [PMID: 19841045.]
76.Brynhildsen J. Combined hormonal contraceptives: prescribing patterns, compliance, and benefits versus risks // Ther. Adv. Drug Saf. 2014. Vol. 5. №5. P. 201–213. [PMID: 25360241.]
77.Karakurt F. et al. Comparison of the clinical efficacy of flutamide and spironolactone plus ethinyloestradiol/ cyproterone acetate in the treatment of hirsutism: a randomised controlled study // Adv. Ther. 2008. Vol. 25. №4. P. 321–328. [PMID: 18389188.]
78.Katsambas A.D., Dessinioti C. Hormonal therapy for acne:whynotasfirstlinetherapy?factsandcontroversies// Clin. Dermatol. 2010. Vol. 28. №1. P. 17–23. [PMID: 20082945.]
79.СПЯ: новый взгляд на проблему. Многообразие симптомов, дифференциальная диагностика и лечение СПЯ: Информационный бюллетень / И.Г. Шестакова, Т.P. Рябинкина; под ред. В.Е. Радзинского. М.: Редакция журнала StatusPraesens, 2015. 24 с.
80.Apovian C.M. et al. Pharmacological management of obesity: an endocrine Society clinical practice guideline // J. Clin. Endocrinol. Metab. 2015. Vol. 100. №2. P. 342–
362.[PMID: 25590212.]
81.Thessaloniki ESHRE/ASRM-Sponsored PCOS Consensus Workshop Group. Consensus on infertility treatment related to polycystic ovary syndrome // Hum. Reprod. Oxf. Engl. 2008. Vol. 23. №3. P. 462–477. [PMID: 18308833.]
82.Farquhar C., Brown J., Marjoribanks J. Laparoscopic drilling by diathermy or laser for ovulation induction in anovulatory polycystic ovary syndrome // Cochrane Database Syst. Rev. 2012. Vol. 6. Art. No. CD001122. [PMID: 22696324.]
83.Effect of Letrozole versus Clomiphene on live birth in women with anovulatory infertility due to polycystic ovary syndrome (PCOS): a randomized double-blind multi-center trial // Fertil. Steril. 2013. Vol. 100. №3. P. S51.
