
BKh_polnye_otvety
.pdf
інших тканинних елементах, зокрема в лімфоїдній системі, лейкоцитах, сполучній тканині, шлунку, кишечнику тощо і мають назву гормоноподібних сполук (гормоноїдів) або тканинних гормонів (гістогормонів). На відміну від «справжніх» гормонів, що характеризуються дистантністю дії, гістогормони можуть справляти свій регульований вплив на чутливі до них клітини-мішені на місці свого утворення (місцева дія).
Загальною рисою у біорегуляторів різного походження є їх інформаційна ф-ція, спрямована на контроль, регуляцію, модуляцію метаболічних і фізіологічних ф-цій чутливих біоструктур. Найбільш вивченими на даний час є такі класи біорегуляторів: гормони («справжні» гормони), нейромедіатори та опіоїдні пептиди, фізіологічно активні ейкозаноїди, гормони та медіатори імунної системи, пептидні фактори росту (цитомедини, інтермедини).
3.Реакція клітин-мішеней на дію гормонів. Мембранні (іонотропні, метаботропні) та цитозольні рецептори.
Реалізація фізіологічного ефекту гормонів та інших біорегуляторів здійснюється в клітинах (тканинах-, органах-)-мішенях.
Мішені (клітина, тканини, органи) або гормонокомпетентні структури – чутливі до гормону біоструктури, які вибірково відповідають на взаємодію з гормоном специфічною фізіологічною та біохімічною реакцією; відповідно до ступеня впливу гормону на їх біологічні властивості, виділяють гормонозалежні та гормоночутливі клітини.
Прикладами гормонозалежних структур є тканини периферійних ендокринних залоз (щитовидної, кори евднирникових залоз) відносно дії тропних гормонів гіпофіза (ТТГ та АКТГ, відповідно) або клітини чоловічої та жіночої статевої сфери стосовно присутності та ефектів відповідних статевих гормонів. Гормоночутливими є клітини органів, що реагують на дію інсуліну, який контролює ві них обмін глюкози, ліпідів та амінокислот (клітини м*язів, жирової тканини, лімфоїдної системи).
Здатність клітин-(тканин-)-мішеней специфічним чином реагувати на певний гормон визначається наявністю рецепторних молекул, що сполучаються з гормоном або хімічно близькими до нього сполуками. З іншого боку, взаємодія з рецептором відбувається за рахунок певного домену молекули гормону – «активного центру», що за молекулярною будовою, конформаціюю є комплементарним відповідному сайту рецептора.
Мембранні рецептори поділяють на 2 класи:
1)рецептори І класу – монотропні рецептори – такі, що в результаті взаємодії з ФАС спричиняють відкриття іонних каналів на плазматичній мембрані і генерують розвиток надзвичайно швидких іонних струмів (Ca2+, Na+, K+, Cl-)/
2)рецептори ІІ класу – метаботропні рецептори – такі, що після взаємодії з ФАС призводять до активації біохімічних ефекторних систем клітини через трансдукуючий G-білок.
Фізіологічними лігандами є гормони та інші біорегулятори білково-пептидної природи та біогенні аміни – похідні амінокислот (адреналін, серотонін).
Цитозольні рецептори всіх класів стероїдних гормонів у присутності стабілізуючого агента являють собою гетероолігомерний білковий комплекс.(холорецептор).
4.Біохімічні системи внутрішньоклітинної передачі гормональних сигналів: G-білки, вторинні посередники (цАМФ,
Са2+/кальмодулін, ІФ3, ДАГ).
Білки-трансдуктори - G-білки – внутрішньомемьранні білки, які сприймають хімічний сигнал від рецептора, модифікованого за рахунок взаємодії з гормоном або медіатором, та спричиняють зміни функціональної активності ефекторних систем клітини. Є кілька типів G-білків: Gs-білки (стимулюючі) – такі, що активують аденілатциклазу – фермент, що утворює головний вторинний посередник – цАМФ.Gi-білки (інгібіруючі) – такі, що інгібірують аденілатцикладу. Gq-білки, такі, що активують фосфоліпазу С – фермент, який спричиняє активацію фосфоінозитидного циклу – ферментної системи, яка призводить до збільшення концентрації Ca2+ в цитозолі за рахунок його вивільнення з внутрішньоклітинних депо.
Взаємодія цАМФ з цАМФ-залежною протеїнкіназою – кіназою А з подільшим фосфорилюванням ключових ферментних та структурних білків є внутрішньоклітинною молекулярною подією, що дозволяє цьому месенджеру виконувати функцію унікального посередника в гормональному контролі клітинних функцій. До гормонів, що використовують цАМФ як вторинний посередник належать: адреналін, вазопресин, кальцитонін, глюкагон тощо. Гормони, що гальмують цАМФ-систему: ангіотензин ІІ, ацетилхолін, дофамін , норадреналін та ін.
Універсальним акцептором хімічного регуляторного сигналу від іонів Са2+ є кальмодулін (КМ) – білок, який може зв*язувати 4 іони кальцію. Специфічне зв*язування Са2+ з молекулою КМ призводить до змін конформації білка, який набуває властивості взаємодіяти з чутливими до КМ білками, в тому числі протеїнкіназами, які регулюють функції багатьох важливих ферментів, збільшуючи їх каталітичну активність.
Продукти реакції, яка каталізується гормоночутливою фосфоліпазою С – ІФ3 та ДАГ, є внутрішньоклітинними месенджерами:
-ІФ3 спричиняє вихід у цитозоль іонів Са2+, депонованих в ендоплазматичному ретикулумі, і збільшення концентрації іона в цитозолі. Вивільнення Са2+ з ендоплазматичного ретикулуму зумовлене відкриттям при дії ІФ3 мембранних каналів для кальцію, що локалізовані в зазначених ультраструктурних утвореннях і є важливим механізмом тонкої фізіологічної регуляції рівня іонізованого цитозольного кальцію.
ДАГ є активатором Са/фосфоліпід залежної протеїнкінази – ферменту, каталітична активність якого проявляється за умов взаємодії з іонами Са2+ та фосфоліпідом фосфатидилсерином.
5.Молекулярно-клітинні механізми дії стероїдних та тиреоїдних гормонів.
Послідовність клітинних та біохімічних реакцій, за рахунок якої стероїдні та тиреоїдині гормони реалізують свої біологічні ефекти має вигляд:
Проникнення гормону всередину клітини сполучення гормону з цитозольним рецептором модифікація (активація) рецептора у складі гормонорецепторного комплексу транс локація модифікованого гормонорецепторного окплексу у ядровзаємодія комплексу зі специфічною ділянкою ДНК хроматину активація специфічних генів транскрипція мРНК синтез ферментних білків, що реалізують біологічні ефекти гормону.
Взаємодія рецепторів стероїдних та тиреоїдних гормонів зі своїми специфічними лігандами зумовлена їх молекулярною будовою, що складається з окремих структурно-функціональних доменів, які відрізняються первинною структурою та конформацією.
Взаємодія білкових рецепторів гормонівактиваторів транскрипції з ДНК відбувається в певних місцях промоторних ділянок геному, що знаходться «зліва» від сайтів ініціації транскрипції і регулюють експресію розташованих на відстані генів.
У взаємодії активованих гормонами стероїдних та тиреоїдних рецепторів зі специфічними ділянками ДНК беруть участь також певні ділянки рецепторних білків, що мають будову цинкових пальців та та глобулярних Zn-вмісних доменів – унікальних просторових утворень, які властиві всім різновидам білків, що виступають як регулятори транскрипції (гормональним рецепторам, білкам – активаторам синтезу металотіонеїну тощо).
1.Гормони гіпоталамуса – ліберини та статини.

Гіпоталамус є зоною головного мозку, яка регулює активність гіпофіза і периферійних ендокринних залоз шляхом продукції в нейросекреторних клітинах специфічних гіпоталамічних, гіпофізотропних гормонів та дії нейротрансмітерів, що контролюють ф-ції підпорядкованих залоз внутрішньої секреції через симпатичну та парасимпатичну нервову систему.
Соматоліберин (соматотропні-рилізинг-гормон, СТГ-РГ) – під впливом СТГ-РГ стимулюється продукція та вивільнення в гіпофізі гормону росту.
Соматостатин (СС; гормон, що інгубує виділення гормону росту) – гормон, під впливом якого гальмується продукція та вивільнення гормону росту; крім гіпоталамуса соматостатин синтезується також в острівцях підшлункової залози та інших клітинних утвореннях шлунково-кишкового тракту, де виконує специфічні фізіологічні ф-ції.
Пролактостатин (пролактин-інгібуючий гормон) – пептид, що гальмує продукцію пролактину та має гонадоліберинову активність. Тироліберин (тиротропін-рилізинг-гормон , ТРГ) – гормон, під впливом якого стимулюється продукція і вивільнення тиреотропного гормону гіпофіза.
Гонадоліберин (гонадотропін-рилізинг-гормон;ГнРГ) – під впливом ГнРГ стимулюється синтез і вивільнення гонадотропних гормонів ФСГ та ЛГ.
Кортиколіберин (кортикотропін-рилізинг-гормон) – гормон, що стимулює вивільнення кортикотропіну.
За хім. природою ліберини та статини є поліпептидами, що декретуються певними нейронами гіпоталамуса, та, надходячи разом із біогенними амінами (дофаміном, серотоніном) та іншими нейромедіаторами через систему портального кровообігу або нейрон альні аксони в аденогіпофіз, регулюють його специфічні гормональні ф-ції.
2.Гормони передньої частки гіпофіза: соматотропін (СТГ), пролактин. патологічні процеси, пов'язані з порушенням
функції цих гормонів.
Передня частка гіпофіза (аденогіпофіз) продукує значну к-сть гормонів, які стимулюють фізіологічні та біохімічні процеси в різних тканинах мішенях, в тому числі активують дії інших ендокринних залоз.
Гормон росту (соматотропні, соматотропний гормон (СТГ) – простий білок, що складається з одного поліпептидного ланцюга і має два внутрішньо молекулярні дисульфідні зв*язки. Гормон синтезуєтьсяя в соматотропних клітинах, що складають приблизно 50% клітин аденогіпофіза.
Патології:
Акромегалія – захворювання, розвиток якого спричиняється збільшеною продукцією гормону росту у дорослих осіб; захворювання характеризується патологічно диспропорційним збільшенням кісток скелета, м*яких тканин, внутрішніх органів.
Гігантизм – прояв надмірної секреції гормону росту в дитячому та підлітковому віці, що призводить до збільшеного росту людини. Карликовість – затримка росту, яка спричиняється гетерогенними факторами, пов*язані як із зменшенням синтезу СТГ, так і з порушеннями реактивності тканин на дію гормон.
Пролактин – простий білок, що складається з одного поліпептидного ланцюга. Гормон продукується в ацидофільних клітинах аденогіпофіза – лактотрофах, кількість і розміри яких збільшуються під час вагітності.
Пухлини, що складаються з пролактин синтезуючих клітин гіпофіза, призводять у жінок до аменореї та галактореї, у чоловіків – до деяких видів безплідності.
Синтез та секреція пролактину гальмуються дофаміном та специфічним інгібуючим нейропептидом гіпоталамуса – пролактостатином, що має також властивості гонадоліберину.
3.Гормони задньої частки гіпофіза. Вазопресин та окситоцин: будова, біологічні функції.
Вазопресин та окситоцин це нейрогіпофізарні гормони, оскільки задня частка гіпофіза є лише місцем їх накопичення, а біосинтез відбувається в супраоптичному та паравентрикулярному ядрах гіпоталамуса. Вазопресин та окситоцин є циклічними пептидами, що склад з 9 амінокислотних залишків (нонапептиди); первинна структура двох гормонів розрізняється лише залишками амінокислот, які містяться в 3 та 8 положеннях.
Вазопресин Біологічні ф-ції вазопресину (антидіуретичного гормону) пов*язані з регуляцією осмолярності та осмотичного тиску рідин організму.
Гормон сприяє підтриманню артеріального тиску за рахунок прямого впливу на судинну стінку, підсилює глікогеноліз у печінці та м*язах. Молекулярні механізми дії вазопресину ґрунтуються на наявності двох типів рецепторів цього активного пептиду:
V1 – рецепторів –локалізовані на мембранах гепатоцитів, гладеньких м*язів судин, тромбоцитів. V2 – рецептори – локалізовані на мембранах епітеліальних клітин трубочок та петель Генле нефронів).
Порушення синтезу, транспортування та вивільнення в гіпоталамусі або зниження чутливості рецепторів нефронів до вазопресину призводять до розвитку важкого захворювання – нецукрового діабету, клінічними проявами якого є виділення значної к-сті сечі з низькою щільністю та постійне відчуття спраги.
Окситоцин Фізіологічна дія окситоцину полягає в активації скорочення м*язів матки (стимуляції пологової діяльності) та скорочення
міоепітеліальних клітин, що оточують альвеоли молочної залози (забезпеченні надходження молока з альвеол у вивідні протоки під час лактації).
4. Інсулін: будова, біосинтез та секреція; вплив на обмін вуглеводів, ліпідів, амінокислот та білків. Рістстимулюючі ефекти інсуліну.
Інсулін – поліпептидний гормон, молекула якого складається з двох ланцюгів – А та В, що мають, відповідно, 21 та 30 амінокислотних залишків. Пептидні ланцюги сполучені між собою дисульфід ними зв*язками, що з*єднають залишок А7 з залишком В7, та залишок А20
із залишком В19.
Інсулін синтезується в рибосомах В-(β-)клітин підшлунковї залози у вигляді препрогормону – білка, який у результаті обмеженого протеолізу послідовно перетворюється в ендоплазматичному ретикулота та апараті Гольджі на про гормон та зрілий інсулін. Молекули інсуліну спаковуються в секреторні гранули, де вони утворюють комплекси з іонами цинку. Секреція інсуліну з клітини відбувається шляхом еміоцитозу, який полягає в міграції гранул до плазматичної мембрани, злитті гранул з мембраною, розчиненні мембрани та «екструзії» - викиду вмісту мембрани в екстра целюлярний простір. Секреція інсуліну є енергозалежним процесом, головним фізіологічним стимулом секреції є збільшення концентрації глюкози в крові понад рівень фізіологічної норми (3,3-5,5 ммоль/л).
Вплив на обім вуглеводів:
1)стимуляцією транспорту глюкози з екстра целюлярного простору через плазматичні мембрани всередину клітин.

2)сприянням утилізації глюкози в м*язах, печінці, жирові тканині тощо шляхами гліколізу, пентозофосфатного шляху та синтезу глікогену Вплив на омін ліпідів:
1)активацією синтезу вищих жирних кислот за рахунок збільшення притоку відповідних субстратів: ацетил-КоА та НАДФН, що утворюються при метаболізмі глюкози 2)активацією синтезу триацилгліцеролів із жирних кислот та гліцерил-3-фосфату, який також постачається у збільшенній кількості при гліколітичному розщепленні глюкози
3)гальмуванням лі полізу в адипоцитах, що зумовлено зменшенням концентрації цАМФ, необхідного для активації ТГ-ліпази та протидією лі політичному впливу катехоламінів та глюкагону.
Вплив на амінокислоти та білки:
1)стимуляцією транспорту нейтральних амінокислот через плазматичні мембрани 2)активацією процесів рибосомальної трансляції, синтезу рРНК та деяких мРНК (у м*язах, печінці, нирках, сполучній тканині).
Інсулін має ріст стимулюючі ефекти, що пов*язані як із стимуляцією надходження в клітини енергетичних та пластичних субстратів для росту (глюкози, амінокислот), так і з безпосереднім активуючим впливом на біосинтез (реплікацію) ДНК, прискоренням переходу клітин у S-фазу. Інсулін здійснює позитивний вплив на проліферацію тваринних клітин у культурі, подібний до дії пептидних факторів росту – фактора росту епідермісу, фактора росту фібробластів, тромбоцитарного фактора росту, біологічні ефекти яких також підсилюються інсуліном.
5. Глюкагон: регуляція обміну вуглеводів та ліпідів.
Глюкагон – одно ланцюговий поліпептид, що складається з 29 амінокислотних залишків. Синтезується у вигляді про гормону (проглюкагону), який перетворюється на молекули зрілого глюкагону.
Біологічні функції глюкагону полягають у регуляції вуглеводного та ліпідного обміну. Основною мішенню гормональної дії глюкагону є гупатоцити печінки.
Вплив на обмін вуглеводів характеризується:
1)стимуляцією глікогенолізу за рахунок активації глікоген-фосфорилази; молекулярний механізм дії гормону полягає в активації мембранної аденілатциклази з подальшим включенням цАМФ-залежного фосфоролітичного каскаду 2)гальмуванням глікогенезу шляхом інгібірування активності глікогенсинтази за рахунок її цАМФ-залежного фосфорилювання
3)стимуляцією синтезу глюкози з амінокислот; активуючи синтез ферменту ФЕП-кінази, глюкагон виступає як найбільш потужний активатор глюконеогенезу в печінці.
Вплив на обмін ліпідів характеризується лі політичною дією глюкагону. За рахунок збільшення концентрації цАМФ в адипоцитах глюкагон активує ТГ-ліпазу жирової тканини, що супроводжується виходом НЕЖК в плазму крові; вільні жирні кислоти виступають як енергетичні субстрати в ході β-окислення та частково перетворюється на кетонові тіла. За умов інсулінової недостатності глюкагонзалежне утворення ацетоацетату робить суттєвий внесок в розвиток кетонемії, що спостерігається при цукровому діабеті.
6.Тиреоїдні гормони: структура, біологічні ефекти Т4 та Т3. Порушення метаболічних процесів при гіпота гіпертиреозі.
Тиреоїдні гормони є істинними гормонами, що синтезуються в спеціалізованих епітеліальних клітинах фолікулів щитовидної залози – тиреоцитах.
Із двох йодованих тиронінів більш активним є Т3, специфічна гормональна активність якого перевищує відповідну активність Т4 у 4-5 разів; у периферійних тканинах більша частина Т4 перетворюється на Т3, і сумарна біологічна дія тиреоїдних гормонів в організмі на 90-95% забезпечується самеТ3.
Біологічні функції тиреоїдних гормонів полягають у контролі процесів енергетичного обміну, біосинтезу білка та морфогенезу. Гіпотиреоз – патологічний стан,я кий розвивається внаслідок дефіциту в організмі вільних Т3 та Т4 або неадекватної рекції тканинмішеней на дію гормонів. Така ситуація може бути спричинена дефектами синтезу тиреоїдних гормонів на різних його стадіях внаслідок:
-порушення акумуляції йодидів залозою (внаслідок йодного дефіциту або неспроможності залози накопичувати мікроелемент) -порушень у ферментних системах, що використовують йодиди для утворення гормонально активних молекул Т3 та Т4 -порушень у рецепторних та трансдукуючих системах, які трансформують гормональний сигнал в специфічні ефекти тиреоїдних гормонів.
Поширеною формою гіпотиреозу є ендемічний зоб.
Гіпертиреоз – патологічний стан, що пов*язаний із надлишковим утворенням залозою тиреоїдних гормонів. Різні за механізмами походження клінічні форми гіпертиреозу (базедова хвороба, хвороба Грейвса тощо) супроводжуються тиреотоксикозом, характерними проявами якого є збільшення основного обміну (поглинання організмом кисню в стані спокою), підвищена збудливість нервової системи, психічна дратівливість, тахікардія, схуднення хворих внаслідок переважання катаболічних процесів.
7.Катехоламіни (адреналін, норадреналін, дофамін): будова, біосинтез, фізіологічні ефекти, біохімічні механізми дії.
Катехоламіни адреналін та норадреналін синтезуються в хром афінних клітинах мозкового шару наднирникових залоз, гангліях симпатичної нервової системи та адренергічних структурах центральної нервової системи.
Адреналін Ефекти адреналіну пов*язані з його взаємодією з різними класами адренорецепторів (α,β), що локалізовані як в центральній нервовій
системі , так і в численних ефекторних системах організму.
Фізіологічні проями дії адреналіну характеризуються тонізуючим впливом на міокард (збільшення сили та частоти серцевих скорочень), загальне судинне русло (гіпертензивна дія), гладенькі м*язи судин різних внутрішніх органів, зокрема шлунковокишкового тракту, нирок, бронхів, матки тощо Біохімічні ефекти адреналіну проявляються, в основному, в катаболічній дії гормону на вуглеводний та ліпідний обмін,
опосередкований мембранними рецепторами, сполученими з аденілатциклазними ферментними каскадами.
Вплив адреналіну на обмін ліпідів проявляється активацією глікогенфосфорилази, тобто глікогенолітичною дією, що призводить до активації глікогенолізу в м*язах і забезпеченні енергією м*язового скорочення.
Вплив адреналіну на обмін ліпідів характеризується лі політичним ефектом, спричиненим стимулювальною дією гормону на активність ТГ-ліпази адипоцитів жирової тканини.
Розщеплення адреналіну та норадреналіну каталізується моноамінооксидазами мітохондрій з утворенням гормонально неактивних альдегідів та ванілілмигдальної кислоти.

Дофамін – біогенний амін, що є інтермедіаном у синтезі катехоламінів адреналіну та норадреналіну. Синтез цього аміну та чутливі до нього рецепторні структури локалізуються переважно в гіпоталамусі, мезокортикальній, лімбічній, екстра пірамідній системах головного мозку. Окрім нейромедіаторних властивостей у ЦНС, дофамін має близькі до інших катехоламінів симпатоміметичні властивості. Також дофамін здійснює специфічний саме для нього вплив на ф-цію серцево-судинної системи, спричиняє дилатацію судин нирок, стимулює екзокринну ф-цію підшлункової залози.
8.Стероїдні гормони кори наднирників (С21-стероїди) – глюкокортикоїди та мінералокортикоїди; будова, властивості.
Фізіологічна функція кортикостероїд них гормонів полягає в регулюванні процесів адаптації цілісного організму до змін умов навколишнього середовища та підтриманні внутрішнього гомеостазу, особливо в умовах дії стресорних факторів.
Глюкокортикоїди – кортикостероїди, основним біологічним ефектом дії яких є регуляції вуглеводного обміну, спрямована на стимуляцію синтезу глюкози в печінці, тобто глюконеогенезу. До ггюкокортикоїдів належать: кортизол, кортизон, кортикостерон.
Кортизол - це гормон, який секретується корою надниркових залоз у відповідь на фізичний або емоційний стрес. Його основне завдання - зробити антистресову і протизапальну дію; це означає, що кортизол примушує організм подавити імунну відповідь і припинити реагувати на проблему або больовий подразник.
Оскільки кортизолу властиві властивості иммунорегулятора, його фармакологічні аналоги (наприклад, преднізолон) використовуються для купірування важких алергічних реакцій, лікування артриту і інших запальних захворювань. Про мірі небезпеки, якою супроводжується хронічне підвищення рівня кортизолу, можна судити по тій обережності, з якою підбирається доза препарату, і за украй малою тривалістю курсу терапії.
Кортизон - активують розпад білків в клітинах тканин, підвищують вміст амінокислот в крові, активують дезамінування амінокислот печінки і перетворення їх у вуглеводи, унаслідок чого підвищується вміст глюкози в крові. Глюкокортикоїди посилюють також жировий обмін. Відносяться до протизапальних гормонів, оскільки вони пригнічують утворення антитіл, розвиток набряку, знижують проникність мембран.
9.Жіночі статеві гормони: естрогени, прогест嬬рон. Фізіологічні та біохімічні ефекти; зв'¬¬¬ язок з фазами овуляційного циклу.
До жіночіх статевих гормонів належать Естрогени-похідні естрану Прогестагени-похідні прегнану
Естрогени-синт.у фолікулах яєчників жінок.Естрадіол-найбільш активний представник естрогенів.
Біосинтез естрадіолу-це процес,який відбувається в клітинах внутр.оболонки фолікулів яєчника.Біол.особливості естрогенів.
Естрогени стимулюють розвиток тканин,що беруть участь у реалізації репродуктивної ф-ції жінок,зумовл. Проліферацію епітелію піхви,ендометрію,появу ритмічної рухомості міометрію,також вони відповідають за формування вторинних статевих ознак жіночого організму.
ПРОГЕСТАГЕНИ(ПРОГЕСТЕРОН)
Це гормон,що синт. в жостому тілі яєчників у фазу менструального циклу.Фізіол.функція-підготока матки та інших статевих органів до імплантації плода та розвитку вагітності.
10.Чоловічі статеві гормони (С19-стероїди). Фізіологічні та біохімічні ефекти андрогенів; регуляція синтезу та секреції.
Андрогени — чоловічі статеві гормони хребетних тварин і людини, виробляються головним чином насінниками, а також корою
наднирників і яєчниками. Стимулюють розвиток і функцію чоловічих статевих органів, розвиток вторинних статевих ознак. За хімічною природою —стероїди.
Основним андрогеном є тестостерон,що синт. в клітинах сім*яників.У клітинах-мішенях тестостерон перетворюється в дигідротестостерон.
Біологічні ф-ції полягають у забезп.продуктивної функції чоловічого організму шляхом контролю сперматогенезу та стимуляції розвитку первинних та вторинних статевих ознак.
Крім того,у них є виражений анаболічний ефект,що виявляється стимуляцією синтезу білка в багатьох тканинах.
11.Гормональна регуляція гомеостазу кальцію в організмі. Паратгормон, кальцитонін, кальцитріол.
Гомеостаз кальцію визначається функціонуванням таких анатомо-фізіологічних систем: І)Кісток скелета-резервуара кальцію
ІІ)Тонкої кишки,у верхніх відділах якої здійснюється всмоктування кальцію і фосфатів,які споживаються у складі продуктів харчування
ІІІ)Нирок,уздовж канальців яких відбувається реабсорбція іонів кальцію та фосфатів. ПАРАТГОРМОН
Це сполука,що синтез.в клітинах паращитопод.залоз.Це простий білок,синт. У рибосомах у формі препаратгормону.
-у кістковій тканині паратгормон стимулює фуекц.активність остеокластів,що призв.до резорбції структур кістки та виходу кальцію та фосфатів в кров -в нирках збільшує реабсорбцію кальцію в дистальних відділах та пригнічує реабсорбцію фосфатів
-в кишечнику дія призв.до стимуляції всмокт.кальцію в кров через апікальні мембрани ентероцитів. КАЛЬЦИТРІОЛ Утворюється з вітаміну Д3.
Біол.ф-ція полягає в стимуляції всмоктування кальцію та фосфатів в кишечнику.Кальцитріол підтримує фіз.концентрації кальцію і фосфатів у плазмі крові,що забезп умови для нормальної побудови кісток.
КАЛЬЦИТОНІН Гормон,який синт.в парафолікулярних клітинах щитовидної залози.
Цей гормон є гормоном гіпокальціємійної дії,що зменш.концентрацію іонів кальцію в крові та неорг.фосфатів.Механізм дії полягає в пригніченні ф-ції остеокластів та зменшенні їх утворення.Резорбція кістк.тканини гальмується.
12. Ейкозаноїди: будова, біологічні та фармакологічні властивості. Аспірин та інші нестероїдні протизବпальні засоби як інгібітори синтезу простагландинів.
Ейкозаноїди-сполуки,що належать до біорегуляторів клітинних функцій ліпідної природи.Вони поділяються на:простогландини,тромбоксани та лейкотрієни.Вони утворюються не в залозах внутрішньої секреції,а в тканинах.
І)Простагландини та простацикліни разом складають клас простаноїдів ІІ)Тромбоксани
Біосинтез простогландинів і тромбоксанів.Основне джерело для їх синтезу-арахідонова кислота.Простагландин-синтазний комплекс за рахунок циклооксигенази та пероксидази послідовно перетворює арахідонат на простагландин Н2.
ІІІ)Лейкотрієни. Функції ейказаноїдів
1.Біол.ф-ції простагландинів пов*язані з впливом на скорочувальну функцію гладеньких м*язів.Також можуть виникати розслаблення або спазми бронхів та трахеї 2.Простациклін продукується ендотеліальними клітинами судин.Він протидіє агрегації тромбоцитів.
3.Тромбоксани є фізіологічними антагоністами антитромбічних ефектів простацикліну. 4.Простагландини та лейкотрієни беруть участь у розвитку запальних процесів. Аспірин блокує синтез простагландинів
Метаболізм вуглеводів та його регуляція.
1.Аеробне та анаеробне окислення глюкози , загальна характеристика процесів.
Прості вуглеводи після всмоктування в кишковому тракті та проникнення всередину клітин підлягають метаболічним перетворенням,які становлять підгрунтя їх біоенергетичної функції.Безпосередній і найбільший внесок в утворення АТФ здійснює окислення глюкози до кінцевих продуктів катаболізму – діоксиду вуглецю та води.Крім того,певна кількість вуглеводів,що постійно надходить в організм з продуктами харчування,формують енергетичні депо метаболічного палива у вигляді глікогену та нейтральних жирів.
Основні шляхи внутрішньоклітиннного катаболізму глюкози:
-аеробне окислення,в рез-ті якого глюкоза розщеплюється до СО2 та Н2О
-гліколітичний шлях(гліколіз),в результаті якого глюкоза утворює проміжні продукти катаболізму (піровиниградну або молочну кислоту)
2.Анаеробне окислення глюкози. Послідовність реакцій та ферменти гліколізу.
Анаеробний гліколіз має місце перважно в м*язах при інтенсивній фізичній діяльності ,тобто при відносній кисневій недостатності.Репакції гліколізу перебігають у цитозолі клітини і каталізуються ферментами,що локалізовані в цьому компартменті.Анаеробний гліколіз супроводжується утворенням 2-ох молекул молочної кислоти(лактату)
С6Н12)6--- 2С3Н6О3(лактат)
3.Аеробне окислення глюкози. Етапи перетворення глюкози до CO2 , H2O.
В умовах нормального тканинного дихання аеробне окислення є переважаючим для більшості тканин тваринних організмів і найбільш ефективним з точки зору енергетичної цінності шляхом метаболізму глюкози.Аеробне окислення глюкози до СО2 та Н2О відповідає такому сумарному рівнянню:
С6Н12О6 + 6 О2 = 6 СО2 + 6 Н2О
Складний багатоступеневий процес аеробного окислення глюкози поділяється на такі етапи:
1)Розщеплення глюкози до піровиноградної кислоти.
С6H12O6 + 2 NAD + 2 АДФ + 2 Фн = 2 C3H4O3 + 2 НАДН + 2Н +2АТФ
2)Окислювальне декарбоксилювання піровиноградної кислоти
У результаті цього процесу утворюється ацетил-коА – основний субстрат окислення в ЦТК та відновлена форма НАД Окислювальне декарбоксилювання пірувату каталізується піруватдегідрогеназним комплексом(міст.у мембранах мітохондрій),у прокаріотів у цитоплазмі.
3)Окислення ацетил-коА до двоокису вуглецю та води в ЦТК
ЦТК,функціонально та біохімічно спряжений із ланцюгом електронного транспорту в мембранах мітохондрій,завершує аеробне окислення глюкози до СО2 та Н2О,генеруючи 12 молекул АТФ на кожну молекулу ацетил-коА,що розщеплюється.
4. Окислювальне декарбоксилювання пірувату. Ферменти, коферменти та послідовність реакцій в мультиферментному комплексі.
У результаті окислювального декарбоксилювання пірувату утворюється ацетил-коА –осн.субстрат окислення в ЦТК.
Ферментативні стадії утворення ацетил-коА з пірувату.
Стадія І Каталізується піруватдегідрогеназою(Е1),коферментом якої є ТДФ.На цій стадії відбувається взаємодія пірувату з С-2 тіазольного
кільця молекули тіаміну Стадія ІІ
Каталізується дигідроліпоїлацетилтрансферазою(Е2),яка переносить гідроксиетильну групу від ТДФ(Е1) на простетичну групу ферменту Е2,що є окисленою формою ліпоєвої кислоти.
Стадія ІІІ
Дигідроліпоїлацетилтрансфераза переносить ацетильну групу від відновленої ліпоєвої кислоти на коензим А Стадія ІV
Окислення відновленої форми ферменту Е2 ФАД-залежною дигідроліпоїлдегідрогеназою (Е3)
Стадія V
Перенесення атомів водню від відновленої ФАД-групи дигідроліпохлдегідрогенази на НАД+ з утворенням НАДН Відновлений НАДН,що утв.в результаті окислювального декарбоксилювання пірувату,в аеробних умовах окислюється в мітохондріальному електротранспортному ланцюзі з генерацією 6 молекул АТФ.
5. Гліколітична оксидоредукція : субстратне фосфорилювання та човникові механізми окислення гліколітичного НАДН.
Човникові механізми окислення НАДН Мембрани мітохондрій непроникні для НАДН,тому гліколітичний НАДН,що утворюється в цитозолі,не може безпосередньо
окислюватися НАДН-дегідрогеназою мітохондріального електронотранспортного ланцюга.Для окислення цитозольного НАДН існують човникові системи,що транспортують відновлювальні еквіваленти від цієї сполуки до мітохондрій непрямим шляхом.Сутність цих процесів полягає в тому,що гліколітичний НАДН у цитозолі відновлює певний метаболіт,який здатний проникати через внутрішню мітохондріальну мембрану в матрикс мітохондрій,де він окислюється,відновлюючи внутрішньомітохондріальний НАД,і знову повертається до цитозолю.
Транспорт цитозольного водню в мітохондрії здійснюється малат-аспартатною та гліцерофосфатною човниковими системами.
Малат-аспартатна човникова система
Сутність ії полягає у відновленні за рахунок водню системи(НАДН + Н) оксалоацетату до малату з подальшим транспортом малату всередину мітохондрії і повторним його окисленням до аксалоацетату в цитозоль здійсн.після його перестворення до аспартату.
Гліцерофосфатна човникова система
Функціонує шляхом відновлення(за рахунок гліколітичного водню) діоксиацетонфосфату до гліцерол-3-фосфату(цитозольний процес),транспорту гліцерол-3-фосфату всередину мітохондрії та його окислення в дихальному ланцюзі до діоксіацетонфосфату,який знову повертається в цитозоль.
6.Порівняльна характеристика біоенергетики аеробного та анаеробного окислення глюкози, ефект Пастера.
Енергетика аеробного окислення глюкози
Сумарне рівняння аеробного окислення глюкози,що враховує АТФ,генеровану при субстратному фосфорилюванні на гліколітичному етапі та за рахунок окисного фосфорилювання в мітохондріях,таке:
С6Н12О6 + 6 О2 + 38 АДФ + 38 Фн = 6 СО2 + 6 Н2О + 38 АТФ
Енергетика гліколізу
Сумарний процем аеробного та анаеробного гліколізу можна подати таким рівнянням:
С6Н12О6 + 2 АДФ + 2 Фн = 2 С3Н4О3(С3Н6О3) + 2 АТФ
Ефект Пастера:
Вивчаючи процес бродіння у дріжджів Луї Пастер помітив таку закономірність: як швидкість поглинання, так і загальна кількість використаної клітинами глюкози сильно збільшувалась за анаеробних умов порівняно з аеробними. Причини цього явища, яке було назване ефектом Пастера, стали зрозумілими після детальнішого вивчення процесів катаболізму: у присутності кисню відбувається повне окиснення глюкози до вуглекислого газу та води, що супроводжується синтезом 30—32 молекул АТФ на одну молекулу глюкози, а за його відсутності бродіння дає вихід тільки 2 молекули АТФ на молекулу глюкози. Отже, в анаеробних умовах клітині потрібно спожити у 15 разів більше глюкози, щоб отримати ту ж кількість АТФ
7.Фосфоролітичний шлях розщеплення глікогену в печінці та мязах. Регуляція активності глікогенфосфорилази.
Глікоген
↓
Глюкозо-1-фосфат
↓
Глюкозо-6-фосфат
↓ |
↓ |
М*язи(Піруват(лактат)) Печінка(глюкоза)
8.Біосинтез глікогену: ферментативні реакції, фізіологічне значення. Регуляція активності глікогенсинтази.
Ферментативні реакції синтезу глікогену
1)Утворення нуклеотидцукру-попередника
Усі біохімічні реакції утворення складних вуглеводів – оліго-та полісахаридів потребують наявності метаболічно активних форм моносахаридів,у ролі яких виступають сполучені з цукрами нуклеотиди.Метаболічно активною формою глюкози,що використовується у формуванні нерозгалужених гомополісахаридних ланцюгів глікогену,є УДФ-1-глюкоза.
Реакція каталізується УДФ-глюкозопірофосфорилазою
2)Формування нерозгалужених ланцюгів глікогену
Фермент- УДФ-глікогентрансфераза
3)Формування розгалужень у молекулі глікогену
Розгалуження в молекулі глікогену виникають за рахунок внутрішньомолекулярного переносу олігосахаридного фрагмента з 6-7 мономерів із кінця до С-6 гідроксильну групу глюкози.
Фізіол.значення глікогену
Глікоген є резервною формою глюкози,збереження надлишків якої у вигляді молекул мономерів неможливе у зв*язку з ії високою осмотичною активністю.
9. Механізми реципрокної регуляції глікогенолізу та глікогенезу за рахунок каскадного цАМФ-залежного фосфорилювання ферментних білків.
10. |
Роль адреналіну, глюкагону та інсуліну в гормональній регуляції обміну глікогену в мязах та печінці. |
У м*язах.
Адреналін-стимулює глікогеноліз та гальмує глікогенез шляхом:
А)Активації глікогенфосфорилази за рахунок її цАМФ-залежного фосфорилювання Б)Інгібірування глікогенсинтази за рахунок її цАМФ-залежного фосфорилювання Інсулін- стимулює глікогенез і гальмує глікогеноліз шляхом:
А)Підвищення проникності мембран м*язових клітин для глюкози,що використ.для синтезу глікогену. Б)Зменшення внутрішньоклітинного рівня цАМФ за рахунок активації її розщеплення фосфодіестеразою У печінці
Глюкагон-стимулює глікогеноліз та гальмує глікогенез за механізмом,аналогічним дії адреналіну в клітинах м*язів Інсулін-підвищує активність ферм.реакцій синтезу глікогену за рахунок біохімічних механізмів,близьких до розглянутих вище. Таким чином:
-переважання інсуліну сприяє утворенню в організмі резервів вуглеводів у формі глікогену печінки.
-переважання глюкагону сприяє мобілізації запасів глікогену печінки в умовах зниження рівня глюкоземії,яке спостерігається через декілька годин після споживання їжі.
11.Генетичні порушення метаболізму глікогену (глікогенози, аглікогенози).
Спадкові порушення обміну глікогену
Глікогенози – спадкові хвороби, молекулярною основою виникнення яких є уроджена недостатність синтезу певних ферментів глікогенолізу, пов’язана з дефектами в генетичній системі клітин. При глікогенозах у внутрішніх органах та тканинах (здебільшого в печінці, м’язах, клітинах крові) спостерігається накопичення аномально надмірної кількості глікогену, іноді зі зміненою молекулярною структурою, який не може використовуватися у метаболічних процесах. Клінічно глікогенози проявляються важкою гіпоглюкоземією внаслідок нездатності глікогену печінки розщеплюватися з вивільненням молекул глюкози.
Аглікогенози – спадкові хвороби накопичення глікогену, молекулярною основою яких є генетичні дефекти, що призводять до порушення утворення ферменту глікогенсинтази.
12.Глюконеогенез: субстрати , ферменти та фізіологічне значення процесу.
Глюконеогенез — метаболічний шлях |
утворення глюкози з нецукрових вуглецевих субстратів, |
таких |
як піруват, молочна |
́ |
|
|
|
кислота, гліцерин і глюкогенні амінокислоти
Всі перетворення глюконеогенезу локалізується у цитоплазмі, проте в еукаріот перша реакція цього шляху має місце у мітохондріях
Реакції глюконеогенезу відбуваються переважно в печінці та кірковому шарі нирок.Біосинтез глюкози забезпечує її нормальну концентрацію в умовах зменшеного надходження моносахариду із зовнішнього середовища та вичерпання глікогену печінки та м*язів.
Реакції та ферменти глюконеогенезу:
1.Перетворення пірувату у фосфоенолпіруват.Відб.у 2 етапи
І)Перетворення пірувату в оксалоацетат за участю піруваткарбоксилази
піруват+СО2+АТФ=оксалоацетат+АДФ+Фн
ІІ)Перетворення оксалоацетату в фосфоенолпіруват за участю фосфоенолпіруваткарбоксикінази
оксалоацетат+ГТФ=ФЕП+СО2+ГДФ
2.Перетворення фруктозо-1,6-дифосфату в фруктозо-6-фосфат
Фермент:фруктозо-1,6-дифосфотаза
3.Перетворення глюкозо-6-фосфату в глюкозу
Глюкозо-6-фосфат+Н2О = глюкоза + Фн
Фермент:глюкозо-6-фосфатаза
13.Глюкозо-лактатний (рі) та глюкозо-аланіновий цикли.
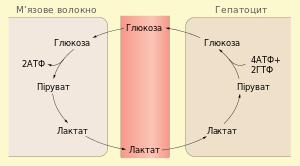
Цикл Корі - сукупність біохімічних ферментативних процесів транспорту лактату з м'язів у печінку, і подальшого синтезу глюкози з лактату, каталізуються ферментами глюконеогенезу. При інтенсивній м'язовій роботі, а також в умовах відсутності або недостатньої кількості мітохондрій (наприклад, в еритроцитах або м'язах) глюкоза вступає на шлях анаеробного гліколізу з утворенням лактату. Лактат не може далі окислюватися, він накопичується (при його накопиченні в м'язах дратуються чутливі нервові закінчення, що викликає характерне поколювання в м'язах). З током крові лактат надходить в печінку. Печінка є основним місцем скупчення ферментів глюконеогенезу і лактат йде на синтез глюкози.
Глюкозо-аланіновій цикл
Метою глюкозо-аланіновогоцікла також є прибирання пірувату, але, крім цього, вирішується ще одна важлива задача - прибирання зайвого азоту з м'язів. При м'язовій роботі і в стані спокою в міоциті розпадаються білки і утворені амінокислоти рансамініруються з a- кетоглутаратом. Отриманий глутамат взаємодіє з піруватом. Утворений аланін є транспортною формою пірувату та азоту з м'яза в печінку. У гепатоциті йде зворотна реакція трансамінування, аміногрупа передається на синтез сечовини, піруват використовується для синтезу глюкози
Глюкоза, утворена в печінці з лактату або аланіну, повертається назад в м'язи, відновлюючи під час відпочинку запаси глікогену.Крім м'язової роботи, глюкозо-аланіновий цикл активується під час голодування, коли м'язові білки розпадаються і багато амінокислоти використовуються як джерело енергії, а їх азот необхідно доставити в печінку.
14. Глюкоза крові(глюкоземія): нормоглікемія , гіпота гіперглікемії, глюкозурія. Цукровий діабетпатологія обміну глюкози.
Нормоглікемія-нормальна кількіть глюкози в крові Гіпо-зменшена кількість глюкози в крові Гіпер-збільшена кількість глюкози в крові Глюкоземія-наявність глюкози в сечі
Цукровий |
діабет — |
група ендокринних |
захворювань, |
що |
розвиваються |
внаслідок |
абсолютної |
чи |
відносної |
недостатності гормону інсуліну, внаслідок чого |
виникає стійке |
підвищення рівня глюкози в крові —гіперглікемія. |
Захворювання |
||||||
характеризується хронічним перебігом і порушенням усіх видів обміну речовин: вуглеводного, жирового,білкового, мінерального і водно-сольового. Характерними симптомами є невгамовна спрага (полідипсія) та надмірне сечовиділення (поліурія), однак ці симптоми можуть бути слабко вираженими, якщо рівень глюкози в крові підвищений помірно.
15.Гормональна регуляція концентрації та обміну глюкози в крові.
Адреналін-стимулює глікогеноліз та гальмує глікогенез шляхом:
А)Активації глікогенфосфорилази за рахунок її цАМФ-залежного фосфорилювання Б)Інгібірування глікогенсинтази за рахунок її цАМФ-залежного фосфорилювання Інсулін- стимулює глікогенез і гальмує глікогеноліз шляхом:
А)Підвищення проникності мембран м*язових клітин для глюкози,що використ.для синтезу глікогену. Б)Зменшення внутрішньоклітинного рівня цАМФ за рахунок активації її розщеплення фосфодіестеразою Глюкагон-стимулює глікогеноліз та гальмує глікогенез за механізмом,аналогічним дії адреналіну в клітинах м*язів
Інсулін-підвищує активність ферм.реакцій синтезу глікогену за рахунок біохімічних механізмів,близьких до розглянутих вище. Таким чином:
-переважання інсуліну сприяє утворенню в організмі резервів вуглеводів у формі глікогену печінки.
-переважання глюкагону сприяє мобілізації запасів глікогену печінки в умовах зниження рівня глюкоземії,яке спостерігається через декілька годин після споживання їжі.
16.Пентозофосфатний шлях окислення глюкози:схема процесу та біологічне значення.
Пентозофосфатний шлях — метаболічний шлях перетворення глюкози, потрібний для отримання відновних еквівалентів НАДФH, що використовуються у процесах біосинтезу багатьох речовин, зокрема жирних кислот та холестерину, та рибозо-5-фосфату, який є важливим попередником в утворенні нуклеотидів. Відбувається у цитоплазмі клітин прокаріот, грибів, рослин та тварин.
ПФШ відбувається у цитозолі клітин, він має кілька біологічних функцій. Однією з них є продукування рибозо-5-фосфату, що
використовується для синтезу |
нукелотидів, |
які |
входять |
до складу РНК та ДНК, |
а |
також |
коферментів, таких |
як АТФ, НАД, ФАД,кофермент А. |
Через це |
ПФШ |
активно |
функціонує у клітинах, |
що |
швидко |
діляться: кісткового |
мозку, шкіри, слизової оболонки кишківника. |
|
|
|
|
|
|
|
Загальна реакція пентозофосфатного шляху має такий вигляд:
3 Глюкозо-6-фосфат + 6 НАДФ+ + 3 Н2О → 6 НАДФH(H+) + 3 CO2 + 2 фруктозо-6-фосфат + гліцеральдегідфосфат;
Пентозофосфатний шлях розділяють на дві стадії:
1)Оксинювальна, в ході якої глюкозо-6-фосфат дегідрогенізується та декарбоксилюється з утворенням НАДФH та рибулозо-5-фосфату, що ізомеризується до рибозо-5-фосфату;
2)Неокиснювальна, в реакціях якої рибулозо-5-фосфат перетворюється до проміжних продуктів гліколізу.
17.Метаболічні шляхи перетворення фруктози та галактози; спадкові ензимопатії їх обміну.
Фруктоза, що потрапляє в організм людини із фруктами та внаслідок розщеплення сахарози в більшості тканин, крім печінки, наприклад у м'язах та нирках, фосфорилюється гексокіназою до фруктозо-6-фосфату із використанням однієї молекули АТФ. У печінці вона має інший шлях перетворення: спочатку фруктокіназа переносить фосфатну групу на C-1 фруктози, утворений фруктозо-1-
фосфат розщеплюється фруктозо-1-фосфатальдолазою до гліцеральдегіду та дигідроксиацетонфосфату. Обидві тріози перетворюються у гліцеральдгед-3-фосфат: перший — під впливом тріозокіназа, другий — під впливом гліколітичного ферменту тріозофосфатізомераза.
Роль:є енергетичним джерелом для руху сперматозоїдів,міститься у кришталику ока.
Спадкові ензимопатії:
Непереносимість фруктози,фруктоземія
Галактоза утворюється в організмі внаслідок розщеплення молочного цукру. Вона поступає у печінку і там перетворюється на глюкозо-6-фосфат за чотири кроки: спочатку галактокіназа каталізує фосфорилювання у першому положенні, на утворений галактозо- 1-фосфат переноситься уридильна група із УДФ-глюкози за участю ферменту галактозо-1-фосфатуридилтрансферази. Продуктами другої реакції є глюкозо-1-фосфат та УДФ-галактоза. Глюкозо-1-фосфат під впливом фосфоглюкомутази перетворюється у глюкозо-6- фосфат і поступає в гліколіз, а УДФ-галактоза використовується для регенерації УДФ-глюкози, що каталізується УДФ-галактоза-4- епімеразою. Дефект будь-якого із ферментів метаболічного шляху перетворення галактози у глюкозу викликає захворювання галактоземію.
Галактоземія проявляється в дитячому віці і виявляється нездатністю перетворювати галактозу в глюкозу,що проявляється розумовою відсталістю,збільшенням печінки,помутнінням кришталика
Метаболізм ліпідів та його регуляція.
1. Катаболізм триацилгліцеролів в адипоцитах жирової тканини: послідовність реакцій, механізми регуляції активності тригліцеридліпази.(191)
Триацилгліцероли(нейтральні жири, жири) потрапляють до організму людини як компоненти тваринної і рослинної їжі. Ліпіди цього класу розщеплюються в травному каналі до моно гліцеридів, вільних жирних кислот та гліцерилу. Основне місце локалізації резервних тригліцеридів в організмі людини – адипоцити жирової тканини(ліпоцити).
Ферментативний гідроліз (ліполіз) триацилгпіцеролів в адипоцитах та інших клітинах, де накопичуються нейтральні жири, є фізіологічним механізмом, що має суттєве значення як резервне джерело енергії, особливо в умовах вичерпання вуглеводних резервів та при стресових ситуаціях. Процес розщеплення триацилгліцеролів із вивільненням жирних кислот, які виходять у кров, отримав назву мобілізації жирних кислот із жирової тканини. Внутрішньоклітинний ліполіз триацилгліцеролів (ТГ) здійснюється в декілька стадій, продуктами яких є діацилгліцероли (дигліцериди — ДГ), моноацилгліцероли (моногліцериди — МГ), іліцерол та вільні жирні кислоти.
Молекулярної основою регуляції активності тригліцеридліпази адипоцитів є її ковалентна модифікація шляхом оберненого фосфорилювання – дефосфорилювання. Фосфорильована форма ТГ-ліпази є каталітично активною, дефосфорильовананеактивною.Фосфорилювання відповідного білка здійснюється за рахунок АТФ при участі ферменту цАМФ-залежної протеїнкінази.
2.Нейрогуморальна регуляція ліполізу за участю адреналіну, норадреналіну, глюкагону та інсуліну.
Адреналін та норадреналін — катехоламіни, що активують ліполіз у жировій тканині за рахунок стимуляції цАМФ-залежного каскадною механізму регуляції активності ТГ-ліпази адипоцитів. Ліполітична дія цих гормонів реалізується за умов фізіологічних (фізичне напруження, зниження температури навколишнього середовища) та психологічних (страх, тривого) стресів, що супроводжуються вивільненням з мозкового шару наднирникових залоз адреналіну, а також стимуляцією симпатичної нервової системи та вивільненням у синапсах нейронів норадреналіну, що взаємодіють із адренергічними рецепторами мембран адипоцитів. Глюкагон — панкреатичний гормон, що стимулює ліполітичну систему в жировій тканині за механізмом, подібним до дії катехоламінів, тобто за рахунок підвищення в адипоцитах вмісту цАМФ, пов’язаного з активацією аденілатциклази. Дія глюкагону проявляється в умовах зниження концентрації глюкози в крові через зменшення її надходження з кишечника або посиленого використання в тканинах.У цілому за рахунок розглянутих біохімічних механізмів метаболічні ефекти катехоламінів та глюкагону призводять до швидкої стимуляції глікогенолізу в печінці і м’язах та ліполізу в жировій тканині, що забезпечує підвищені енерготичні потреби організму за умов стресу або голодування. На відміну від зазначених гуморальних факторів, що активують ТГ-ліпазу адипоцитів, спричиняючи мобілізацію НЕЖК із жирової тканини, гормон інсулін гальмує процес ліполізу та вивільнення жирних кислот. Інгібіруюча дія інсуліну відносно ліполізу в адипоцитах реалізується за рахунок двох біохімічних механізмів: а) зменшення концентрації цАМФ, що може бути пов’язаним з активацією фосфодіестерази цАМФ; б) збільшення проникності мембран адипоцитів до піюкози, результатом чого є активація в жировій тканині гліколізу і, відповідно, накопичення гліколітичних метаболітів діоксіацетонфосфату та 3-фосфотліцеринальдегіду. Ці метаболіти, в свою чергу, є попередниками іліцерол-3-фосфату, що необхідний для реетерифікації жирних кислот при біосинтезі триацилпгіцеролів. Таким чином, стимульоване інсуліном підвищене надходження в адилоцити глюкози переключає метаболізм жирних кислот на використання їх здебільшого в синтетичних реакціях і зменшує їх вихід у кров.
3. |
Реакції окислення жирних кислот (β-окислення); роль карнітину в транспорті жирних кислот |
в мітохондрії.(194- |
|||||||||
195стр) |
|
|
|
|
|
|
|
|
|
|
|
1. |
Дегідрування КоА-похідних жирних кислот за участю ФАД-залежного ферменту ацил-КоА-дегідрогенази.У результаті реакції |
||||||||||
утворюється |
трансненасичене |
(в |
положеннях |
2,3, |
або |
а, |
бета) |
КоА-похідне |
жирної |
кислоти. |
|
2. Гідратація ненасиченого КоА-ацилу ферментом еноїл-КоА -гідратазою з утворення м спиртовою похідною ацил-КоА—3-оксіацилу- КпА (бета- гідроксіацилу-КоА) 3. Дегідрування оксинохідною ацил-КЬА НАД-залежним ферментом 3-аксіацил-КоА-дегідрогеназою. Продукт реакції — 3-кетоацил-

КоА (бета-кетоацил-КоА) 4. Тіолітичне розщеплення 3-кетоацил-КЬА за рахунок взаємодії з молекулою КоА при участі ферменту бета-кетоацил-КоА-тіолази. В результаті реакції утворюється молекула КоА-похідното жирної кислоти, скороченого на два вуглецеві атоми, та ацетил-КоА. Виходячи із зазначеного, сумарне рівняння бета-окислення поширеної в природних триагліцеролах пальмітинової кислоти має вигляд
195стр
Карнітин, яким бере участь у перенесенні молекул ацил-КоА до мітохондріального магриксу.
Транспортна функція карнітину реалізується за човниковим принципом (рис. 14.4.): а) на зовнішній поверхні внутрішньої мітохондріальної мембрани за участю ферменту кариніти-ацилтрансферази І відбувається
утворення ефіру ацилкарнітину: ацил-S-KoA + карнітин |
-ацилкарнітин |
+ |
|
HS-KoA |
|
б) |
транспортний білок карнітин-ацилкарнітин-піранслоказа переносить |
ацилкарнітин |
через мембрану |
мітоходрій; |
|
в) на внутрішній поверхні мембрани фермент карнітин-ациятрансфераза II розщеплює ацилкарнітин у наступній реакції: ацилкарнітин |
|||||
+ |
HS-KoА-------»ацил-S-KoA |
+ |
|
карні |
тин |
Ацил-S-KoA вступає на шлях ß-окислення, а вільний карнітин виходить з мітохондрій і бере участь у транспортуванні нової молекули жирної кислоти.
4.Енергетична вартість β-окислення жирних кислот в клітинах.
1. У кожному циклі бета-окислення вивільняється одна молекула ацетил-КоА, окислення якої в циклі три карбонових кислот супроводжується утворенням 12 молекул АТФ (глава 10). Бета-Окислення пальмітату призводить до утворення 8 молекул ацетил-КоА, повне окислення яких до СО2 та Н20 дасть 96 (12x8) молекул АТФ. 2. У кожному циклі (Бета-окислення утворюються дві молекули відновлених коферментів — ФАДН, та НАДН, які можуть віддавати свої відновлювальні еквіваленти ланцюга електронного транспорту в мітохондріях, сприяючи генерації в результаті окисною фосфорилювання 2 (ФАДН,) та З(НАДН), тобто сумарно 5 молекул АТФ. У разі повного окислення пальмітату в 7 циклах {бета-окислення за рахунок даного механізму утворит ься 35 (5x7) молекул АТФ. Враховуючи витрату 1 молекули АТФ на етапі активації жирної кислоти, загальна кількість молекул АТФ, що може синтезуватися в умовах повного окислення до діоксиду вуглецю та води молекули пальмітату, дорівнює 130 (96+35-1). Виходячи з цього, можна подати сумарне рівняння окислення пальмітинової кислоти в мітохондріях:
С15Н31СООН + 23 О2+ 130 АДФ + 130 Фн ----** 16 СО2 + 16 Н20 + 130 АТФ
5.Окислення гліцеролу: ферментативні реакції, біоенергетика.(197)
Гліцерол, що утворюється при розщепленні триацигліцеролів або гліцерофосфоліиідів, може вступати на шлях катаболізму (окислення) або знову використовуватися для біосинтезу різних класів гліцеридів.1. Включенню гліцеролу до метаболічних перетворень передує його активація, яка полягає в його трансформації за участю АТФ до гліцерол-3-фосфату (альфа-гліце-рофосфату) при дії ферменту гліцеролфосфокінази. 2. альфа-Гліцерофосфат здатний до окислення мітохондріальним ферментом альфагліцерофосфатдегідрогеназою з утворенням гліцеральдегід-3-фосфагу (Г-З-Ф). Гліцеральдегід-З-фосфат є одним з центральних метаболітів гліколітичного окислення глюкози. Подальше перетворення Г-З-Ф, утворенного при окисленні гліцеролу, співпадає з катаболізмом гліколітичного Г-З-Ф: Г-З-Ф----*1,3-диФГК---*3-ФГК----*2-ФГЛ---*ФЕП-**ПІРУВАТ
6.Кетонові тіла. Реакція біосинтезу та утилізації кетонових тіл, фізіологічне значення.(198)
У печінці існує фізіологічно важливий шлях утилізації ацетил-КоА, що призводить до утворення молекул альтернативного метаболічного палива, які використовуються в інших тканинах — так званих кетонових (ацетонових) тілах. До кетонових тіл належать ацетоацетат,бета-гідроксибутират та ацетон. Утворення кетонових тіл відбувається в цитозолі (початкові етапи) та мітохондріях гепагоцитів за рахунок таких реакцій:
1. Конденсація двох молекул ацетил-КоА з утворення м ацетоацетнл-КоА. Реакція каталізується цитозольним ферментом тіолазою. 2. Взаємодія ацетоацетил-КоА з новою молекулою ацетил-КоА з утворенням
бета-гідрокси-бета-метил-глутарил-КоА (бета-ГОМК). При утворенні кетонових тіл реакція відбувається в мітохондріях і каталізується ферментом бета-ГОМК-синтетазою. 3. Розщеплення
бета-гідрокс |
и |
- |
бета- |
метилглутарил-КоА |
мітохондріальним |
ферментом бета-ГОМК-ліазою з утворенням ацето-ацетагу та ацетил-КоА. |
|
|
|||
Бета-гідроксибутират |
утв. З |
ацетоацетату шляхом |
відновлення |
НАД-залежною бета-гідроксибутиратдегідрогеназою: |
|
Ацетон утвр в незначній кількості з ацетативного декарбоксилювання або дії кулюючій крові, за рахунок його не ферментативного декарбоксилювання або дії ферменту ацетоацетатдекарбоксилази. Після утвр в гепатоцитах кетонові тіла виходить у кров і транспортуються в периферичні тканини, де вони виступають як важливі субстрати біологічного окислення. Використанню ацетоацетату як субстрату метаболічного палива передує його активація з утворенням ацетоацетил-КоА. Існує два ферментативні механізми генерації ацетоацетил-КоА в гепаточитах: а) взаємодія ацетоацетату
з |
сукциніл |
КоА: |
199стр |
Б) активація ацетоацетату HS-КоА за участю АТФ: |
|
|
|
7.Порушення обміну кетонових тіл за умов патології (цукровий діабет,голодування).
У нормі концентрація кетонових тіл у крові та більшості тканин незначна ( в середньому 10-20мг-л).Проте, за умов голодування та цукрового діабету створюються метаболічні умови, за яких кількість кетонових тіл у тканинах різко підвищується за рахунок значної активації їх синтезу.При цьому значно зростають як концентрація кетонових тіл у крові(кетонемія), так і їх виділення з сечею(кетонурія). Біохімічною основою зростання вмісту кетонових тіл в умовах патології зменшення ступеня утилізації атецил-КоА в циклі три карбонових кислот внаслідок порушення вуглеводного обміну.
