
304- Органическая химия_Черных В.П. и др_Х., 2007 -776с
.pdf
осноВы Теории реакЦиЙ органических соединениЙ
121
А—В  A—В + Х—Y
A—В + Х—Y
ХY
От органических соединений чаще всего отщепляются такие вещества, как вода, галогеноводороды, аммиак. Реакции отщепления характерны для галогенопроизводных углеводородов, спиртов, галогено-, гидрокси- и аминокислот.
4. Перегруппировки (от англ. rearrangment — перегруппировка, обозначают сим-
волом R ):
А—В  А—В
А—В
ХХ
Перегруппировки включают переход (миграцию) отдельных атомов или групп от одного фрагмента молекулы к другому. К ним весьма склонны непредельные соединения.
5. Реакции окисления и восстановления сопровождаются изменением степени окисления атома углерода, являющегося реакционным центром. Процессы окисления и восстановления неразрывно связаны между собой. Однако при классификации органических реакций окисление или восстановление рассматривается по отношению к органическому веществу.
По количеству молекул, принимающих участие в стадии, определяющей скорость реакции, различают мономолекулярные и бимолекулярные реакции, которые обозна-
чают цифровыми индексами «1» и «2» соответственно. В лимитирующей (самой медленной) стадии мономолекулярной реакции принимают участие молекулы одного реагента, в бимолекулярной — молекулы двух реагентов.
8.5. ПРОМЕЖУТОЧНЫЕ АКТИВНЫЕ ЧАСТИЦЫ
Превращение исходных веществ в продукты реакции в большинстве случаев протекает по сложному механизму, включающему образование промежуточных активных частиц (интермедиатов). Обычно это короткоживущие частицы, которые быстро превращаются в более устойчивые молекулы. Однако некоторые интермедиаты обладают достаточно высокой стабильностью и могут быть выделены из реакционной среды в свободном состоянии. В качестве промежуточных активных частиц чаще всего встречаются карбокатионы, карбанионы и свободные радикалы:
R |
R |
R |
|||
|
|
|
|
|
|
R—C+ |
R—C– |
R—C· |
|||
|
|
|
|
|
|
R |
R |
R |
|||
карбокатион |
карбанион |
свободный радикал |
|||
Карбокатионы и карбанионы образуются в результате гетеролитического разрыва связи С—X, где Х — атом водорода или другой заместитель:
R |
|
|
|
R |
R |
|
|
|
R |
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
R—C :X |
|
|
|
R—C+ + Х– |
R—C: X |
|
|
|
R—C– + Х+ |
||||
|
|
|
|
||||||||||
|
|
|
|
|
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
R |
|
|
|
R |
R |
|
|
|
R |
||||
карбокатион |
карбанион |

Глава 8
122
Свободные радикалы образуются при гомолитическом разрыве связи:
R |
|
|
|
R |
||
|
|
|
|
|
|
|
R—C· ·X |
|
|
|
R—C· + Х· |
||
|
|
|||||
|
|
|
||||
|
|
|
|
|
|
|
R |
|
|
|
R |
||
|
|
|
|
|
свободный радикал |
|
8.5.1. карБокаТионы
Карбокатионами называют органические катионы, содержащие положительно заряженный атом углерода.
Вакантная ð-ÀÎ
R′ Ñ+ R″
R 
Рис. 8.4. Пространственное строение карбокатиона
Атом углерода, несущий положительный заряд, находится в карбокатионе в sp2-гибридизации: три его σ-связи с соседними атомами расположены в одной плоскости; p-атомная орбиталь, ось которой перпендикулярна к плоскости σ-связей, является вакантной (рис. 8.4).
Названия карбокатионов составляются добавлением к наименованию соответствующего радикала слова «катион»:
+ |
|
CH |
+ |
|
CH3 |
+ |
СH |
3 |
—СH—CH |
3 |
|
CH—СH2 |
|
|
3 |
|
CH3 |
|
||
|
|
|
|
|
|
|
метил-катион |
изопропил-катион |
|
изобутил-катион |
|||
Существует несколько основных способов образования карбокатионов:
1. Прямая ионизация соединений в сильно полярных средах характерна для ве-
ществ, в которых атом углерода связан с заместителем сильно полярной ковалентной связью:
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
+ |
|
|
|
|
|
|
|
|
||
|
|
|
H2C—CH |
|
|
CH2 |
|
|
|
Cl |
|
|
|
|
|
|
|
H2C—CH—СH2 |
+ Cl– |
|
|
|
|
||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||
|
|
|
|
аллилхлорид |
|
|
|
|
|
|
|
|
|
аллил-катион |
|
|
|
|
|
|
|
||||||||||||||||||
Процесс ионизации |
|
заметно |
активизируется в |
присутствии |
катализатора, |
||||||||||||||||||||||||||||||||||
в частности кислот Льюиса (AlCl3, FeBr3, ZnCl2 и др.), или протона: |
|
|
|
||||||||||||||||||||||||||||||||||||
|
|
|
|
CH |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
+ |
|
|
|
|
|
|
|
]– |
|
|
|
|
|
|
|||
|
|
|
|
3 |
|
|
|
Cl + AlCl |
3 |
|
|
|
|
|
|
СH |
3 |
+ [AlCl |
|
|
|
|
|
|
|||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
4 |
|
|
|
|
|
|
|
|||||||
|
|
|
|
хлорметан |
|
|
|
|
|
|
|
метил-катион |
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
+ |
|
|
|
|
|
|
|
|
+ |
|
|
|
|
||||
CH |
—CH |
|
|
ОH + H+ |
|
|
|
|
CH |
—CH —O—H |
|
|
|
|
CH |
—СH |
|
+ H |
O |
||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||||||||
3 |
|
2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
3 |
|
|
|
|
2 |
|
|
|
|
|
|
|
|
3 |
|
|
2 |
2 |
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||
|
этанол |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
этил-катион |
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
H |
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
2. Присоединение протона или другой электрофильной частицы к одному из атомов, связанных между собой кратной связью:
|
+ |
|||
H2C—CH2 + H+ |
|
|
|
CH3—СH2 |
|
|
|||
|
|
|
||
этилен |
|
|
|
этил-катион |
Устойчивость карбокатионов определяется возможностью делокализации (рас-
средоточения) заряда в молекуле. Чем в большей степени положительный заряд

осноВы Теории реакЦиЙ органических соединениЙ
123
распределен между другими атомами в молекуле, тем более устойчивым является катион. Степень рассредоточения заряда в карбокатионе обусловлена его строением.
Электронодонорные группы увеличивают электронную плотность в катионном центре, а следовательно, способствуют рассредоточению положительного заряда в катионе, оказывая на него тем самым стабилизирующее влияние. За счет увеличения +I-эффекта и эффекта гиперконъюгации со стороны алкильных групп устойчивость алкильных карбокатионов возрастает при переходе от первичного к третичному:
+ |
+ |
CH3 + |
CH3 |
|
|
||||
СH3 |
CH3—СH2 |
СH |
CH3—С+ |
|
CH3 |
||||
|
|
CH3 |
||
|
|
|
||
метил-катион |
этил-катион |
изопропил-катион |
трет-бутил-катион |
|
|
Устойчивость карбокатионов |
|
||
Если положительно |
заряженный |
атом углерода связан |
с атомом углерода |
|
в sp2-гибридизации или гетероатомом, имеющим неподеленную пару электронов (—O—, —N—, —S— и др.), устойчивость карбокатиона значительно повышает-
ся вследствие делокализации заряда в сопряженной системе:
|
|
+ |
|
|
|
+ |
|
|
|
≡ H |
|
|
|
H |
С |
СH |
2 |
|
H |
С |
|
СH |
2 |
С |
+ СH |
2 |
|
|
|||||||||||||
2 |
|
СH |
2 |
|
СH |
2 |
|
СH |
|||||
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
аллил-катион |
|
||
|
|
|
|
+ |
|
|
|
|
+ |
|
|
|
|
|
|
CH3—O—СH2 |
|
CH3—O—CH2 |
|
|
|||||||
|
|
|
|
|
|||||||||
метоксиметил-катион
Аналогичным образом происходит делокализация заряда в карбокатионах, положительно заряженный атом углерода которых находится в сопряжении с π-электронной системой бензольного кольца. Возможность такой делокализации приводит к более сильному возрастанию устойчивости карбокатиона:
+ |
|
+ СH |
|
СH |
СH |
|
СH |
+ |
СH |
2 |
2 |
2 |
|||||
|
|
2 |
|
≡ |
2 |
|||
|
|
|
|
+ |
+ |
|
|
|
|
|
|
|
|
|
|
бензèë-кàтèîí
Электроноакцепторные заместители, напротив, увеличивают электронный дефицит в катионном центре, тем самым дестабилизируя карбокатион. Так,
+
хлорметил-катион СH2Cl в результате —I-эффекта со стороны атома хлора менее
+
устойчив, чем метил-катион СН3.
Наряду со структурными особенностями большое влияние на стабильность карбокатионов оказывают внешние факторы, в частности сольватация катионов молекулами растворителя, то есть образование вокруг каждого катиона оболочки из молекул растворителя. Чем в большей степени сольватирован катион, тем выше его устойчивость. При прочих равных условиях сольватационный эффект тем выше, чем меньше размер иона и чем менее делокализован в нем заряд. Сольватная оболочка в значительной степени экранирует заряд катиона и ослабляет его
Глава 8
124
взаимодействие с другими ионами, препятствуя таким образом взаимной нейтрализации разноименно заряженных ионов. Сольватационная способность растворителя определяется значением диэлектрической проницаемости ε. Наибольшей сольватационной способностью обладает вода (ε = 80) и серная кислота (ε = 84).
Поскольку карбокатионы чаще всего являются короткоживущими промежуточными частицами, которые при небольшой энергии активации вступают в дальнейшие химические превращения, обнаруживают их в основном с помощью инструментальных методов ЯМР- и УФ-спектроскопии.
8.5.2. карБанионы
Карбанионами называют органические анионы, содержащие отрицательно заря женный атом углерода, то есть трехвалентный атом углерода с неподеленной парой электронов:
R R—C–
R
Анионный центр в зависимости от структуры аниона может иметь тетраэдрическое или плоскостное строение.
Тетраэдрическое строение характерно для насыщенных карбанионов и карбанионов, в которых анионный центр не находится в сопряжении с π-электронами кратной связи. В таких карбанионах отрицательно заряженный атом углерода находится в sp3-гибридизации, а свободная электронная пара занимает sp3-гиб- ридную орбиталь:
Ñ R
R
R
R
Карбанионы, в которых неподеленная пара электронов анионного центра находится в сопряжении с π-электронами кратной связи, имеют плоское строение. При этом отрицательно заряженный атом углерода находится в sp2-гибридизации,
асвободная электронная пара занимает р-атомную орбиталь:
ð-ÀÎ
RO
ÑÑ
R  H
H

осноВы Теории реакЦиЙ органических соединениЙ
125
Плоскую структуру имеют также карбанионы, в которых анионный центр содержит двойную или тройную связь. В таких карбанионах свободная электронная пара занимает sp2- или sp-гибридную орбиталь соответственно:
sð2-ÀÎ |
|
sð-ÀÎ |
R |
R |
|
Ñ |
|
Ñ |
Ñ Ñ |
|
|
|||
|
|||||
|
|
||||
|
|||||
R |
R |
||||
Названия карбанионов составляются добавлением к наименованию соответствующего радикала слова «анион»:
– |
– |
– |
СH3 |
СH3—СH2—СH2 |
(С6H5)3С |
метил-анион |
пропил-анион |
трифенилметил-анион |
Существуют несколько основных способов образования карбанионов:
1. Взаимодействие соединений с достаточно полярной связью С—Н с активными реагентами (щелочами, амидами щелочных металлов и др.):
С6H5 |
|
C—H + NaNH |
|
|
|
|
|
|
|
– |
|
|
С H |
5 |
|
2 |
|
|
|
(С |
H |
) |
С + Na+ + NH |
3 |
|
|
|
|
|
|||||||||
6 |
|
|
6 |
5 |
3 |
|
||||||
С6H5
трифенилметан натрия трифениламид метил-анион
2. Ионизация металлорганических соединений:
|
|
|
|
– |
+ |
C2H5MgBr |
|
|
|
СH3—СH2 |
+ MgBr |
|
|
||||
|
|
|
|||
этилмагния бромид |
|
|
|
этил-анион |
|
Устойчивость карбанионов определяется возможностью делокализации отрица-
тельного заряда. Чем в большей степени заряд рассредоточен между другими атомами в молекуле, тем более устойчив карбанион. Степень делокализации отрица-
тельного заряда определяется прежде всего строением карбаниона. К структурным факторам, определяющим устойчивость, относятся состояние гибридизации атома углерода анионного центра, а также природа и число заместителей, с которыми он связан. При равных других условиях устойчивость карбанионов возрастает с увеличением s-характера гибридной орбитали, которую занимает неподеленная пара электронов анионного центра:
– |
– |
– |
СH3—СH2—СH2 |
(sp3) < СH3—СH—СH (sp2) < СH3—С—С (sp) |
|
пропил-анион |
пропенил-анион |
пропинил-анион |
Устойчивость карбанионов
Таким образом, устойчивость карбанионов возрастает с увеличением электроотрицательности атома углерода анионного центра.
Глава 8
126
Существенное влияние на устойчивость карбанионов оказывают электронная природа и число заместителей, с которыми связан анионный центр. Электронодонорные заместители повышают электронную плотность в анионном центре и тем самым дестабилизируют карбанион. Так, устойчивость простых алкиланионов уменьшается в ряду
– |
– |
|
CH3 |
– |
СH3 |
> CH3—СH2 |
> |
CH3 |
СH |
|
|
|
|
|
метил-анион |
этил-анион |
|
изопропил-анион |
|
Устойчивость алкиланионов
Электроноакцепторные заместители (–I-эффект) оттягивают электронную плотность с анионного центра (делокализуют отрицательный заряд) и, следова-
тельно, повышают устойчивость карбаниона. Например, 2,2,2-трифторэтил-ани- |
|||
– |
—СF |
|
в результате электроноакцепторного влияния со стороны атомов |
он СН |
3 |
||
2 |
|
– |
|
фтора более устойчив, чем этил-анион СН2—СН3.
Устойчивость карбанионов значительно повышается вследствие сопряжения неподеленной пары электронов анионного центра с π-электронами кратных связей или π-электронной системой бензольного кольца. В этом случае отрицательный заряд делокализуется по всей сопряженной системе:
H |
|
– |
|
H |
– |
СH |
|
≡ H |
С – |
СH |
|
С СH |
2 |
С |
2 |
2 |
|||||||
2 |
|
СH |
2 |
|
СH |
2 |
СH |
|
|||
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
аллил-анион |
|
||
– |
– |
СH2 |
|
|
СH2 |
|
|
СH2 |
|
– |
|
СH2 |
|
|
|
|
|
≡ |
СH2 |
||||
|
|
|
– |
|
|
|
|
|
– |
|
|
|
|
|
|
|
|
|
|
|
|
||
бензèë-àнèîí
Еще более устойчивы карбанионы, в которых анионный центр сопряжен
с кратной связью углерод-кислород: |
|
|
|||||||
O |
|
|
|
O– |
O |
||||
– |
|
|
|
|
|
|
|
– |
|
|
|
|
|
|
|
|
|
|
|
R—СH—C—R′ |
|
|
|
R—CH—C—R′ ≡ R—CH—C—R′ |
|||||
|
|
|
|||||||
I. |
|
|
|
II. |
|
|
|||
Поскольку атом кислорода обладает большей электроотрицательностью, чем атом углерода, а следовательно, способен сильнее удерживать отрицательный заряд, вклад структуры II в резонансный гибрид больше вклада структуры I. Поэтому карбанионы такого типа называют енолят-анионами.
На устойчивость карбанионов, как и карбокатионов, наряду со структурными особенностями большое влияние оказывает сольватационный эффект растворителя. Чем в большей степени сольватирован анион молекулами растворителя, тем выше его устойчивость.

осноВы Теории реакЦиЙ органических соединениЙ
127
Для обнаружения карбанионов чаще всего используют спектроскопию в ультрафиолетовой и видимой областях, а также метод ядерного магнитного резонанса.
8.5.3. сВоБодные радикаЛы
Свободными радикалами называют незаряженные частицы, содержащие неспа ренный электрон (одноэлектронную орбиталь).
В органических свободных радикалах неспаренный электрон может находиться у атома углерода, а также у атомов азота, кислорода и других элементов:
R
R—C· R N· R—O·
N· R—O·
R
R
Чаще всего встречаются свободные радикалы, несущие неспаренный электрон на атоме углерода. В таких радикалах атом углерода с неспаренным электроном может иметь плоскостную и тетраэдрическую конфигурацию. Простые алкильные радикалы, а также радикалы, в которых атом углерода с неспаренным электроном находится в сопряжении с π-электронами кратной связи или бензольного кольца, имеют плоское строение радикального центра, то есть атом углерода находится
вsp2-гибридизации; неспаренный электрон занимает р-атомную орбиталь:
ð-ÀÎ
H |
|
|
H |
|
|
H |
|
|
Ñ |
|
|
||
H |
|
Ñ |
|
Ñ |
||
Ñ |
|
|
||||
H |
Ñ |
|
H |
H |
||
H |
|
|
||||
|
|
H |
|
|
||
|
|
|
|
|
|
|
метил-радикал |
|
|
аллил-радикал |
|
бензил-радикал |
|
Третичные алкильные радикалы имеют тетраэдрическое строение радикального центра; неспаренный электрон занимает sp3-гибридную орбиталь:
sð3-ÀÎ
Ñ ÑÍ3
ÑÍ3
Í3Ñ
ÑÍ3
трет-бутил-радикал

Глава 8
128
Как и в случае карбанионов, если атом углерода с неспаренным электроном принимает участие в образовании двойной связи, радикальный центр имеет плоское строение, а неспаренный электрон находится на sp2-гибридизованной орбитали:
sð2-ÀÎ |
|
sð2-ÀÎ |
H
Ñ Ñ
HH
винил-радикал |
фенил-радикал |
Свободные радикалы образуются в результате гомолитического разрыва ковалентной связи в молекуле, который происходит в основном при термических и фотохимических воздействиях:
R· ·N—N· ·R |
|
t |
|
2R· + N2 |
|
|
|
|
|
|
|
||||
азосоединение |
|
|
|
|
|
|
|
O |
|
|
O |
||||
|
|
|
hν |
|
|
|
|
CH3· ·C—CH3 |
|
CH3· + ·C—CH3 |
|||||
|
|
||||||
|
|
||||||
ацетон |
|
|
|
метил- |
|
ацетил- |
|
|
|
|
|
|
радикал |
|
радикал |
Устойчивость свободных радикалов аналогично карбокатионам и карбанионам зависит от их структуры и определяется возможностью делокализации неспаренно-
го электрона. Чем больше делокализация, тем выше устойчивость. Устойчивость алкильных радикалов возрастает в ряду:
· |
|
|
· |
СH3 |
· |
|
|
|
СH3 |
|
|
|
|
|
|
С· |
|||||
СH |
< СH |
|
СH |
< |
СH < СH |
3 |
|
|||
3 |
3 |
2 |
СH3 |
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
СH3 |
||
|
|
|
|
|
|
|
|
|
||
метил-радикал |
этил-радикал |
изопропил-радикал |
трет-бутил-радикал |
|||||||
Устойчивость алкильных радикалов
Алкильные группы за счет +I-эффекта увеличивают электронную плотность в радикальном центре и тем самым частично заполняют одноэлектронную орбиталь вторым электроном, приводя по существу к делокализации. Свободные радикалы, в которых одноэлектронная орбиталь находится в сопряжении с π-элект- ронной системой кратных связей, являются более устойчивыми, так как в данном случае делокализация неспаренного электрона происходит по всей сопряженной системе:
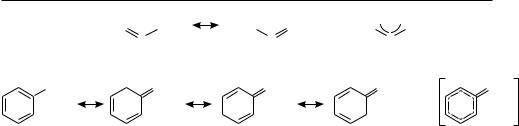
осноВы Теории реакЦиЙ органических соединениЙ |
129 |
|||||
|
|
|
|
|
|
|
|
H2С |
· |
· |
СH2 |
≡ H2С · |
СH2 |
|
СH2 |
H2С |
||||
|
|
СH |
|
СH |
СH |
|
|
|
|
|
|
аллил-радикал |
|
· |
· |
СH2 |
|
СH2 |
СH2 |
· |
СH2 |
|
СH2 |
||||
|
|
· |
|
|
· |
≡ |
|
|
|
|
|
||
бензèë-радикал
Несмотря на то что бензильные и аллильные радикалы более устойчивы, чем простые алкильные, все они обладают высокой реакционной способностью
и существуют только как промежуточные частицы. Наряду с этим имеются
·
и долгоживущие свободные радикалы: трифенилметил-радикал (С6Н5)3С сохраняется в свободном состоянии в растворе при комнатной температуре длительное время.
Поскольку свободные радикалы имеют неспаренный электрон, они обладают магнитным моментом и являются парамагнитными частицами. Это свойство используют для их обнаружения. Метод, основанный на измерении магнитных свойств неспаренных электронов, получил название «электронного парамагнитного резонанса» (ЭПР). Этот метод аналогичен ядерному магнитному резонансу, только вместо ядерного спина в нем фиксируют спин электрона.
Глава 9
АЛИФАТИЧЕСКИЕ УГЛЕВОДОРОДЫ. АЛКАНЫ
Алифатическими углеводородами называют органические соединения, молекулы которых состоят только из атомов углерода и водорода, образующих открытую (незамкнутую) углеродную цепь.
По степени насыщенности углерод-углеродных связей их подразделяют на алканы (предельные углеводороды), алкены (углеводороды с двойной связью), алкадиены (с двумя двойными связями), алкины (с тройной связью).
аЛиФаТические угЛеВодороды
АЛКАНЫ |
|
АЛКЕНЫ |
|
АЛКАДИЕНЫ |
|
АЛКИНЫ |
|
|
|
|
|
|
|
АЛКАНЫ
Алканами называют алифатические углеводороды, в молекулах которых атомы углерода связаны простыми ковалентными σсвязями.
Алканы также называют предельными, или насыщенными, углеводородами. Рань-
ше эти соединения именовались парафинами (от лат. parum affinitas — лишенные сродства), что указывает на их сравнительно низкую реакционную способность.
Общая формула алканов СnН2n+2.
Алканы образуют гомологический ряд, родоначальником которого является метан (табл. 9.1). Каждый гомолог этого ряда отличается от последующего на звено СН2 (гомологическая разность).
Начиная с углеводорода С4Н10, алканы могут иметь как неразветвленную, так и разветвленную углеродную цепь. Алканы с неразветвленной цепью атомов углерода называют нормальными, или н-алканами.
9.1. СТРОЕНИЕ АЛКАНОВ
Все атомы углерода в алканах находятся в состоянии sp3-гибридизации и имеют тетраэдрическую конфигурацию (см. с. 43). Валентные углы между связями равны 109°28′ (тетраэдрический угол). Если углеродный атом связан с четырьмя разными заместителями, то углы несколько отклоняются от тетраэдрического. Расстояние между атомами углерода в алканах составляет 0,154 нм, а между углеродным и водородным атомами — 0,110 нм (рис. 9.1).
