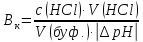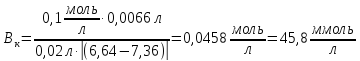- •Приклади виконання вправ Приклад 1
- •Приклад 2
- •Приклад 3
- •Приклад 4
- •Приклад 5
- •Приклад 6
- •Приклад 7
- •Приклад 8
- •Приклад 9
- •Приклад 10
- •Приклад 15
- •Вправи для самостійного виконання
- •2. Комплексоутворення в біологічних системах.
- •Приклади виконання вправ Приклад 1
- •Вправи для самостійного виконання.
- •Приклади розв’язання задач
- •Задачі для самостійного розв’язання.
- •Приклади розв’язання задач
- •Задачі для самостійного розв’язання
- •5. Основи титриметричного аналізу
- •Приклади розв’язання задач
- •Задачі для самостійного розв’язання
- •Приклади розв’язання задач
- •Задачі для самостійного розв’язання
- •Приклади виконання вправ
- •Приклади розв’язання задач
- •Задачі для самостійного розв’язання
- •Додаток. Деякі математичні відомості
- •Таблиця 9. Таблиця десяткових логарифмів
Приклади розв’язання задач
|
Приклад 1 | ||
|
Обчислити
| ||
|
Дано:
|
Знайти:
| |
|
Розв’язок: | ||
|
Записати
рівняння для обчислення
Підставити
значення і розрахувати
| ||
|
|
| |
|
Відповідь:
| ||
|
Приклад 2 | ||
|
Обчислити
| ||
|
Дано:
|
Знайти:
| |
|
Розв’язок: | ||
|
Записати
рівняння для обчислення
Підставити
значення і розрахувати
| ||
|
|
| |
|
Відповідь:
| ||
|
Приклад 3 | |||
|
Обчислити
об’єми розчинів натрій гідрогенфосфату
і натрій дигідрогенфосфату з молярними
концентраціями
| |||
|
Дано:
|
Знайти:
| ||
|
Розв’язок: | |||
|
1) |
Обчислити співвідношення об’ємів вихідних розчинів. Записати
рівняння для обчислення
Спростити рівняння, підставивши значення концентрацій компонентів у вихідних розчинах :
Знайти
співвідношення об’ємів вихідних
розчинів
| ||
|
2) |
Обчислити
об’єми
вихідних розчинів
Враховуючи,
що
| ||
|
Відповідь:
|
| ||
|
Приклад 4 | ||||
|
Обчислити
об’єми розчину амоній хлориду та
розчину амоніаку з молярними
концентраціями
| ||||
|
Дано:
|
Знайти:
| |||
|
Розв’язок: | ||||
|
1) |
Обчислити співвідношення об’ємів вихідних розчинів. Записати
рівняння для обчислення
Спростити рівняння, підставивши значення концентрацій компонентів у вихідних розчинах :
Знайти
співвідношення об’ємів вихідних
розчинів
| |||
|
2) |
Обчислити
об’єми
вихідних розчинів
Враховуючи,
що
| |||
|
Відповідь:
|
| |||
|
Приклад 5 | ||||
|
Обчислити
об’єми розчинів натрій гідрогенфосфату
і натрій дигідрогенфосфату з молярними
концентраціями
| ||||
|
Дано:
|
Знайти:
| |||
|
Розв’язок: спосіб 1 | ||||
|
1) |
Обчислити співвідношення об’ємів вихідних розчинів.. Записати
рівняння для обчислення
Спростити рівняння, підставивши значення концентрацій компонентів у вихідних розчинах :
Знайти
співвідношення об’ємів вихідних
розчинів
| |||
|
2) |
Обчислити
об’єм води і суму
об’ємів
вихідних розчинів
Оскільки
задана молярна концентрація буферного
розчину (
отже:
| |||
|
3) |
Обчислити
об’єми
вихідних розчинів
Скласти систему рівнянь:
| |||
|
спосіб 2 | ||||
|
1) |
Обчислити співвідношення кількостей речовини компонентів буфера. Записати
рівняння для обчислення
Знайти
співвідношення кількостей речовини
| |||
|
2) |
Обчислити сумарну кількість речовини компонентів буфера. Записати
формулу для розрахунку загальної
молярної концентрації буфера та
виразити з неї суму кількостей речовини
| |||
|
3) |
Обчислити кількості речовини компонентів буфера. Скласти систему рівнянь:
| |||
|
4) |
Обчислити
об’єми
вихідних розчинів,
в яких містяться необхідні кількості
| |||
|
5) |
Обчислити
об’єм
води,
який необхідно додати до розрахованих
об’ємів розчинів
| |||
|
Відповідь:
|
| |||
|
Приклад 6 | |
|
Обчислити
буферну ємність гідрокарбонатної
буферної системи плазми крові за
лугом, якщо на титрування 100,0мл її
витрачено 4,59мл розчину калій гідроксиду
з молярною концентрацією
| |
|
Дано:
|
Знайти:
|
|
Розв’язок: | |
|
| |
|
Відповідь:
| |
|
Приклад 7 | |
|
До
20мл крові додали 6,6мл розчину хлоридної
кислоти с молярною концентрацією
| |
|
Дано:
|
Знайти:
|
|
Розв’язок: | |
|
| |
|
Відповідь:
| |

 ацетатного буфера, приготованого з
300мл розчину оцтової кислоти з
ацетатного буфера, приготованого з
300мл розчину оцтової кислоти з та 600мл розчину натрій ацетату з
та 600мл розчину натрій ацетату з .
.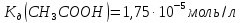






 ацетатної
буферної системи, виразивши молярні
концентрації компонентів буферного
розчину через їх концентрації у
вихідних розчинах та об’єми вихідних
розчинів, взяті для приготування
даного буферного розчину:
ацетатної
буферної системи, виразивши молярні
концентрації компонентів буферного
розчину через їх концентрації у
вихідних розчинах та об’єми вихідних
розчинів, взяті для приготування
даного буферного розчину:
 :
:

 амонійного буферного розчину,
приготованого з 250мл розчину амоній
хлориду з
амонійного буферного розчину,
приготованого з 250мл розчину амоній
хлориду з та 200млводного
розчину
амоніаку (
та 200млводного
розчину
амоніаку ( )
з
)
з
 .
.



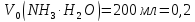


 амонійної буферної системи, виразивши
концентрації компонентів буфера через
концентрації та об’єми вихідних
розчинів:
амонійної буферної системи, виразивши
концентрації компонентів буфера через
концентрації та об’єми вихідних
розчинів:
 :
: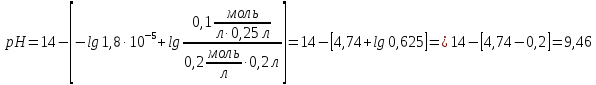

 та
та
 ,
необхідні
для приготування 500мл фосфатного
буферного розчину з
,
необхідні
для приготування 500мл фосфатного
буферного розчину з
 .
.



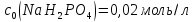



 фосфатної буферної системи, виразивши
концентрації компонентів буфера через
концентрації та об’єми вихідних
розчинів:
фосфатної буферної системи, виразивши
концентрації компонентів буфера через
концентрації та об’єми вихідних
розчинів: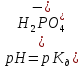


 та
та :
:
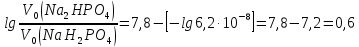
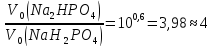

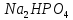 та
та
 .
. ,
скласти
систему рівнянь:
,
скласти
систему рівнянь: 






 і
і
 ,
необхідні
для приготування 400мл амонійного
буферного розчину з
,
необхідні
для приготування 400мл амонійного
буферного розчину з
 .
.







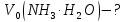
 амонійної буферної системи, виразивши
концентрації компонентів буфера через
концентрації та об’єми вихідних
розчинів:
амонійної буферної системи, виразивши
концентрації компонентів буфера через
концентрації та об’єми вихідних
розчинів:


 та
та :
:



 та
та
 .
. , скласти
систему рівнянь:
, скласти
систему рівнянь: 






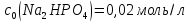 і
і
 ,
а
також води, необхідні для приготування
600мл фосфатного буферного розчину з
молярною концентрацією
,
а
також води, необхідні для приготування
600мл фосфатного буферного розчину з
молярною концентрацією
 і
і .
.










 фосфатної буферної системи, виразивши
концентрації компонентів буфера через
концентрації і об’єми вихідних
розчинів:
фосфатної буферної системи, виразивши
концентрації компонентів буфера через
концентрації і об’єми вихідних
розчинів:


 та
та :
:



 і
і
 .
. в
два рази менша за молярні концентрації
вихідних розчинів (
в
два рази менша за молярні концентрації
вихідних розчинів ( ,
можна
зробити висновок,
що
для приготування буферного розчину
необхідно взяти об’єм води, що дорівнює
половині об’єму буфера (тобто розвести
буфер в два рази).
,
можна
зробити висновок,
що
для приготування буферного розчину
необхідно взяти об’єм води, що дорівнює
половині об’єму буфера (тобто розвести
буфер в два рази).

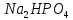 та
та
 .
.




 фосфатної буферної системи, виразивши
співвідношення концентрацій компонентів
буфера через співвідношення кількостей
речовини цих компонентів:
фосфатної буферної системи, виразивши
співвідношення концентрацій компонентів
буфера через співвідношення кількостей
речовини цих компонентів:
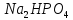 и
и :
:



 і
і :
:







 і
і
 :
:

 і
і ,
щоб отримати 0,6л буферної суміші:
,
щоб отримати 0,6л буферної суміші:




 при зміні
при зміні от 7,4 до 7,7.
от 7,4 до 7,7.



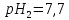




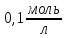 .
При цьому значення
.
При цьому значення змінилось від 7,36 до 6,64. Обчислити
буферну ємність крові за кислотою.
змінилось від 7,36 до 6,64. Обчислити
буферну ємність крові за кислотою.