
- •Кафедра фізики в.В.Соловйов, л.П.Давиденко Конспект лекцій із фізики
- •Полтава 2004
- •Тема: елементи кінематики
- •Лекція іі тема: динаміка частинок план
- •Лекція ііі тема: закони збереження. Тверде тіло план
- •Повний імпульс ізольованої (замкненої) механічної системи не змінюється при будь-яких взаємодіях у ній.
- •Трохи про консервативні системи
- •Швидкість зміни момента імпульсу відносно нерухомої точки о дорівнює результуючому моменту сил усіх зовнішніх сил.
- •Лекція IV тема: механічні коливання
- •Лекція V тема: механічні хвилі
- •Лекція vі тема : елементи механiки суцiльних середовищ
- •Лекція VII тема: макроскопічний стан
- •Лекція viiі тема: статистичний розподіл. Явища переносу
- •Лекція IX тема: основи термодинаміки
- •Лекція X тема: тверді тіла та рідини
- •Лекція XI тема: електростатика план
- •Механізм взаємодії
- •Лекція хii тема: постійний струм план
- •Можна показати, що
- •Лекція хш тема: електричне поле в діелектриках план
- •Лекція х IV тема: магнітне поле план
- •Правило свердлика
- •Лекція XV
- •Тема: електромагнітна індукція.
- •Рівняння максвелла
- •Лекція XVI оптика тема: фотометрія. Інтерференція світла
- •Лекція XVII тема: дифракція
- •Лекція XVIII тема: електромагнітні хвилі в речовині
- •Лекція XIX квантова фізика тема: теплове випромінювання
- •Лекція хх тема: квантова природа світла
- •Лекція ххi тема: будова атома. Теорія бора
- •Лекція ххii тема: елементи квантової механіки
- •Лекція ххiii
- •Лекція ххiv тема: атомне ядро
Лекція VII тема: макроскопічний стан
ПЛАН
1. Статистичний та термодинамiчний методи, макроскопiчнi параметри.
2. Основне рiвняння молекулярно-кiнетичної теорiї. Рiвняння стану iдеального газу.
3. Середня кiнетична енергiя молекул. Молекулярно-кiнетичний змiст температури.
4. Закон рiвномiрного розподiлу енергiї за ступенями вiльностi.
1. Статистична фiзика вивчає властивостi та агрегатнi стани макроскопiчних тiл залежно вiд їх будови й взаємодiї мiж їх частинками (атомами i молекулами) i параметрами їх теплового руху.
Термодинамiка це роздiл фiзики, який вивчає найбільш загальнi властивостi макросистем, якi знаходяться в рiвновазi, та процеси переходу мiж ними.
У статистичнiй фiзицi використовується молекулярно-кiнетичний метод дослiджень. Вiн установлює закони протiкання рiзних процессiв у макротiлах на основi вивчення їх молекулярної структури і механiзму взаємодiї окремих молекул.
Термодинамiка (термодинамiчний метод) використовується для вивчення властивостей тiл без урахування їх внутрiшньої будови. Його основна мета визначення стану термодинамiчної системи.
Термодинамiчна система це сукупнiсть макротiл, якi взаємодiють та обмiнюються енергiєю мiж собою і зовнiшнiм середовищем.
Стан кожної термодинамiчної системи задається термодинамiчними параметрами.
Термодинамiчнi параметри - це сукупнiсть фiзичних величин, якi характеризують властивостi термодинамiчної системи: P,V,T.
Абсолютна температура - це величина, яка характеризує термодинамiчну рiвновагу системи.
Термодинамiчний рiвноважний стан це такий стан, при якому всi термодинамiчнi параметри не змiнюються з часом.
Термодинамiчний процес явище переходу системи iз одного термодинамiчного стану в iнший.
2. Найпростіший об'єкт дослідження у молекулярній фізиці ідеальний газ.
Iдеальний газ це газ, молекули якого можна вважати матеріальними точками , та можна знехтувати взаємодiєю мiж його молекулами.
Знайдемо рiвняння, яке б зв'язувало залежнiсть параметрiв стану газу з кiнетичною енергiєю поступалього руху його молекул.
Із найбільш загальних мiркувань тиск визначається наслiдком ударiв молекул об стiнку посудини з деякою силою, величина якої невiдома. Однак ми можемо порахувати середню силу, яка дiє на стiнку посудини з боку усiх молекул газу.

 Z
l
Z
l










 N
N



 Y
Y
 O
O
Х
Маємо
газ, який знаходиться у кубi з довжиною
ребра l, кiлькiсть молекул N, уздовж кожної
гранi рухається N1
молекул;
![]() зi швидкiстю
зi швидкiстю![]() .
.
Сила дiї одної молекули на грань
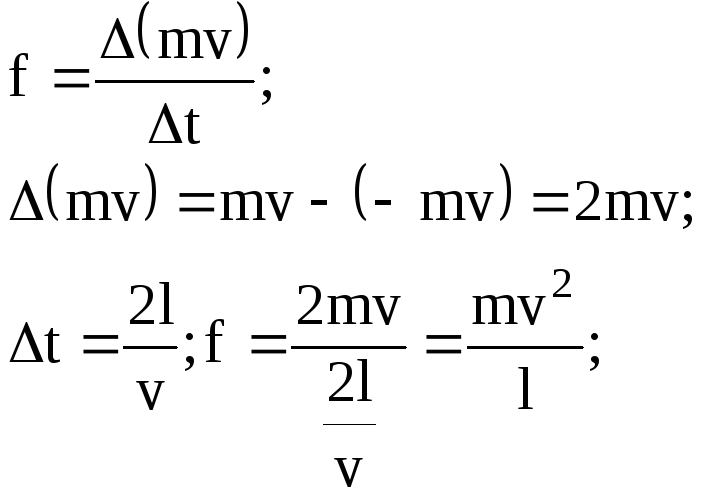
а повна сила всiх N1-молекул на грань l дорiвнює:
![]()
Уведемо середню квадратичну швидкiсть поступального руху молекули газу:

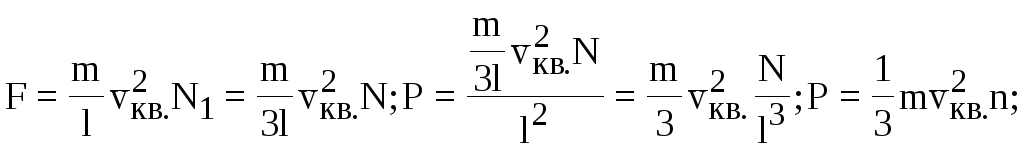
Уведемо середню кiнетичну енергiю поступального руху однiєї молекули газу:
![]() (*)
(*)
![]() (1)
(1)
- основне рiвняння МКТ.
Тиск в ідеальному газовi дорiвнюї 2/3 добутку середньокiнетичної енергiї поступального руху молекули газу на концентрацiю молекул газу.
Це рівняння основне тому, що пов`язує макропараметри з мікрохарактеристиками газу (швидкість однієї молекули).
Воно дає відповідь на питання, чому в газі є тиск. Тому, що молекули володіють кінетичною енергією, б’ють із силою на грані куба і зумовлюють тиск.
![]()
![]()
Тому рівняння КлапейронаМенделєєва є звичайним наслідком основного рівняння молекулярної теорії.
3. Ми знайшли, що
![]() ;
;
![]() ,
,
де
![]()
об`єм одного моля газу;
об`єм одного моля газу;
Nа стала Авогадро; 6.023 1013 моль-1 величина, яка показує кількість молекул, що знаходяться в одному молі газу.
![]()
![]() (2)
(2)
Т
є мірою![]() поступального руху молекул газу.
поступального руху молекул газу.
![]()
![]() стала
Больцмана; К=1.38*10-23
Дж/К.
стала
Больцмана; К=1.38*10-23
Дж/К.
![]() (3)
(3)
- кінетична енергія поступального руху однієї молекули.
Порівнявши (3) і (*), будемо мати:

Другий варіант формули одержимо з урахуванням:
![]() та
та
![]()
![]()
![]() (4)
(4)
Цей вираз є одним із варіантів запису основного рівняння МКТ.
4. Молекули газу можна розглядати як систему матеріальних точок, які здійснюють як поступальний, так і обертальний рух.
Кількість незалежних координат, які визначають положення молекул у просторі, називають кількістю ступенів вільності молекул.
Одноатомний газ (аргон,...): i = 3
Двоатомний газ (NО,CО,H2): i = 5
Триатомний газ та багатоатомний: і = 6 (3 поступальних та 3 обертальних степенів вільності).
Для поступального руху молекул ми знайшли, що
![]() ,
а оскільки поступальному рухові завжди
відповідає 3 степені вільності, то на
кожний ступінь вільності припадає
,
а оскільки поступальному рухові завжди
відповідає 3 степені вільності, то на
кожний ступінь вільності припадає
![]() .
.
У цьому і є зміст закону рівномірного розподілу енергії за степенями вільності:
Статистично,
в середньому, на кожний ступінь вільності
молекули припадає енергія
![]()
Воднорідному багатоатомному газі кожна молекула має
і-ступенів вільності, тому кожна молекула володіє енергією:
![]() (5)
(5)
