
- •ПРЕДИСЛОВИЕ
- •ВВЕДЕНИЕ
- •Глава 1. Получение очищенных фосфорных и суперфосфорных кислот
- •1.1. Тенденции мирового производства фосфорных удобрений и экстракционной фосфорной кислоты
- •1.2. Современные методы очистки экстракционной фосфорной кислоты
- •1.2.1. Очистка от сульфатов, фтора, кремния и катионов металлов
- •1.2.2. Очистка от тяжёлых металлов и мышьяка
- •1.2.3. Очистка от органических примесей
- •Глава 2. Физико-химические основы концентрирования и очистки экстракционной фосфорной кислоты
- •2.1. Термодинамические свойства ортофосфорной кислоты и ее растворов
- •2.2 Плотность и вязкость растворов фосфорной кислоты
- •2.3. Расчет давления паров над экстракционной фосфорной кислотой
- •2.4. Научные основы получения высококонцентрированных кислот с улучшенными и регулируемыми эксплуатационными характеристиками
- •2.4.2 Анализ действия HSО4- и NH4+ при дегидратации и дефторировании экстракционной фосфорной кислоты
- •2.5. Разработка новых марок очищенных и суперфосфорных кислот
- •2.6. Примеры расчета парожидкостного равновесия
- •Глава 3. Адсорбционная очистка экстракционной фосфорной кислоты при дегидратации и дефторировании
- •3.1. Методы активации процессов дегидратации и дефторирования при интенсивном тепломассообмене
- •3.2. Влияние условий дефторирования на состав фосфорной кислоты
- •3.3. Кинетические закономерности процесса дефторирования экстракционной фосфорной кислоты в режиме интенсивного тепломассообмена
- •3.4. Влияние примесей серной кислоты, кремния, железа и алюминия на процесс дефторирования экстракционной фосфорной кислоты
- •3.5. Выбор и модификация адсорбента для удаления примесей из раствора экстракционной фосфорной кислоты
- •3.6. Исследование процесса дефторирования в присутствии серной кислоты с адсорбцией на угольном сорбенте
- •3.7. Исследование процесса регенерации отработанного угольного сорбента
- •Глава 4. Разработка ресурсо- и энергосберегающей технологии получения высококонцентрированных фосфорных кислот
- •4.1. Энергетические концепции получения концентрированных фосфорных кислот при интенсивном тепломассообмене
- •4.2. Разработка аппарата тарельчатого типа с газожидкостным слоем. Расчет и интенсификация тепло- и массопередачи
- •4.4. Аппаратурно-технологическая схема концентрирования и дефторирования экстракционной фосфорной кислоты
- •4.5 Анализ технико-экономических показателей промышленных схем получения концентрированной фосфорной и суперфосфорной кислот
- •4.6. Адсорбционная очистка фторсодержащих газов в производстве очищенной экстракционной фосфорной кислоты
- •Глава 5. Технологические основы получения очищенной экстракционной фосфорной кислоты
- •5.2. Компоновка узла доочистки экстракционной фосфорной кислоты от фтора и других примесей адсорбционным методом
- •5.3. Технологическая схема комбинированного метода очистки
- •5.3.1. Компоновка комбинированной технологической схемы
- •5.3.2. Экологические, энергетические аспекты комбинированной технологической схемы
- •5.4. Очистка экстракционной фосфорной кислоты от сульфатов
- •5.5. Новые марки очищенных фосфорных кислот и способы их получения
- •5.5.1. Получение фосфорных кислот для пищевых и технических целей
- •5.5.2. Получение солей на основе очищенной фосфорной кислоты
- •Заключение
- •Список литературы к главе 1
- •Список литературы к главе 2
- •Список литературы к главе 3
- •Список литературы к главе 4
- •Список литературы к главе 5
- •СОДЕРЖАНИЕ
3.2. Влияние условий дефторирования на состав фосфорной кислоты
Термодинамические расчеты показывают, что фтористые соединения находятся в жидкой фазе в нескольких формах [27, 32]:
– физически растворенные газы, которые находятся в непосредственном равновесии с газовой фазой:
HF |
¾¾® |
HF |
|
газ |
¬¾ |
р |
(VIII) |
|
|
|
SiF |
¾¾® |
SiF |
|
4ГАЗ |
¬¾ |
4Р |
(IX) |
|
|
|
–в виде недиссоциированных соединений с водой – гидратов, в
диссоциированном виде:
¾¾® |
(X) |
HF + Н2О ¬¾ HF ×Н2О |
HF × |
¾¾® |
|
+ |
|
- |
|
|
||
Н2О ¬¾ Н3О |
+ F |
|
|
||||||
|
|
|
(XI) |
||||||
SiF |
+ 2Н |
О |
¾¾® |
SiF ×2Н |
О |
|
|||
4р |
2 |
|
¬¾ |
|
|
4 |
2 |
|
(XII) |
|
|
|
|
|
|
|
|
|
|
–в форме фторфосфорных кислот и комплексных соединений с
алюминием, железом, кремнием и прочее:
HF + Н3PO4 |
¾¾® |
|
|
|
|
(XIII) |
||
¬¾ HF × Н3PO4 |
|
|
|
|||||
SiF2- + Al3+ |
+ 3H |
2 |
O ¾¾® AlF3- |
+ SiO |
×Н |
O + 4H+ |
(XIV) |
|
6 |
|
¬¾ |
6 |
2 |
2 |
|
|
|
Примеси алюминия, железа, а также кальция, магния и др., попадающие в кислоту с минеральным сырьем, затрудняют дефторирование кислоты [32]. Предварительными исследованиями также установлено, что дефторирование ранее используемым классическим методом упаривания с барботированием не позволяет получить чистую фосфорную кислоту (см. рис. 3.1, 3.2). В ряде работ показано, что соединения фтора, являются составной частью сложных комплексов на основе ионов железа, алюминия, кальция, кремния и фосфора
[26 – 32].
127
Таблица 3.3
Материальный баланс процесса концентрирования и дефторирования ЭФК
«Т2»
Статья прихода |
кг/т P2O5 |
мас.% |
|
Статья расхода |
кг/т P2O5 |
мас.% |
|
|
|
|
Концентрированная |
|
|
||
Исходная ЭФК |
2427,18 |
100,0% |
ЭФК |
1587,30 |
100% |
||
P2O5 |
1000,0 |
41,20% |
|
P2O5 |
1000,0 |
63% |
|
SO3 |
19,66 |
0,81% |
|
SO3 |
19,66 |
1,24% |
|
HF (F) |
2,112 |
0,09% |
|
HF (F) |
0,06 |
0,004% |
|
H2SiF6 (F) |
15,049 |
0,62% |
|
H2O |
567,13 |
35,7% |
|
Fe |
0,388 |
0,02% |
|
Fe |
0,39 |
0,02% |
|
H2O |
1389,9 |
57,26% |
|
H2SiF6 (F) |
0,06 |
0,004% |
|
Топочные газы |
4979,82 |
100,0% |
Отходящие газы |
5819,71 |
100% |
||
N2 |
3745,24 |
75,2% |
|
N2 |
3745,24 |
64,35% |
|
H2O |
189,75 |
4% |
|
H2O |
1012,60 |
17,4% |
|
CO2 |
223,25 |
4% |
|
O3 |
802,70 |
13,8% |
|
O2 |
802,70 |
16% |
|
CO2 |
223,25 |
3,8% |
|
Прочее |
18,87 |
0,38% |
|
SiF4 (F) |
14,67 |
0,25% |
|
Итого: |
7407,01 |
100,0% |
|
HF (F) |
2,35 |
0,04% |
|
|
|
|
|
Прочее |
18,87 |
0,32% |
|
|
|
|
|
||||
|
|
|
Итого: |
|
7407,01 |
100% |
|
|
|
|
|
|
|
|
|
Для описания состава газовой и жидкой фазы был произведён анализ на содержание компонентов и составлен материальный баланс по компонентам с учётом состава топочных газов после сжигания. Материальный баланс по сжиганию природного газа рассчитан, исходя из потребностей по концентрированию кислоты «Т2» до кондиции марки «Улучшенная». Баланс по процессу концентрирования представлен в таблице 3.3. Из таблицы видно, что отходящие после процесса топочные газы содержат в своём составе значительное количество паров воды и соединения фтора. Показанные в таблице данные по балансу сопоставлены с анализами абсорбционной воды после санитарного абсорбера для очистки отходящих топочных газов от
128
соединений фтора. Баланс показывает реальное распределение компонентов в газовой и жидкой фазах по соответствующим составляющим.
В лабораторных условиях, поскольку основное внимание уделено соединениям фтора, было количественно определено распределение фтористых соединений по осаждающейся твёрдой, жидкой и отходящей газовой фазам.
Очистку ЭФК проводили на лабораторной установке путём упаривания технической ЭФК («Т2») с составом: 39% Р2О5, 0,052% F; 0,12 % SO4, 1,35% SiO2, 0,017% Al2O3, ρ = 1,322 г/см3. Процесс проводили при температуре 90° С барботированием воздуха со скоростью 1,3 л/мин, при поддержании постоянной концентрации Р2О5 путём добавления дистиллированной воды. Выделяющиеся при дефторировании газы в виде НF и SiF4 поглощали щелочными водными растворами, которые анализировали на содержание соединений фтора и кремния химическими методами [26, 30–32].
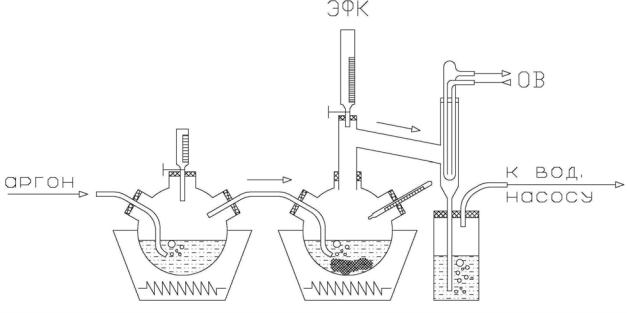
Рис. 3.2. Схема лабораторной установки Размер частиц осаждающейся твёрдой фазы в ЭФК изучен методом
малоуглового рассеяния рентгеновских лучей (МУР) [33]. Он наиболее пригоден, так как первичный размер частиц составил 40–70Å [34, 35]. Другие способы идентификации при столь малых параметрах частиц не применимы. Далее очищенная кислота анализировалась на содержание соединений фтора. Конденсат, улавливаемый колбой– ловушкой (см. схему установки, рис. 3.2) и
129
нейтрализованный раствором щелочи NaOH также анализировался на содержание фтора. Таким образом, удалось выявить общий баланс распределения фтора по фазам для процесса дефторирования ЭФК.
|
0,16 |
|
|
|
|
|
|
|
|
|
1 |
|
|
|
|
г |
0,12 |
|
|
|
|
|
2 |
|
|
|
|
|
|
||
-во F, |
0,08 |
|
|
|
|
|
|
Кол |
|
|
|
|
|
|
|
|
0,04 |
|
|
|
|
|
|
|
0,00 |
|
|
|
|
3 |
|
|
|
|
|
|
|
|
|
|
0 |
20 |
40 |
60 |
80 |
100 |
120 |
|
|
|
|
Время, мин |
|
|
|
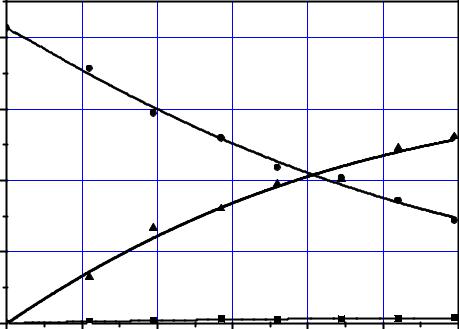
Рис. 3.3. Баланс изменения содержания соединений фтора по фазам при дефторировании ЭФК (40% Р2О5, Т2) с отдувкой воздухом при 90 °C: 1– жидкая; 2– газовая; 3– твердая фазы
Баланс удобно представить в графической форме, где каждая кривая характеризует количественное изменение содержания фтора по соответствующим фазам в процессе дефторирования в массовых единицах. Из рисунка видно каким образом происходит реальное удаление примесей из кислоты и, что наряду с газовой, фтористые соединения удаляются и в твёрдую фазу.
Источником осадка в кислоте являются, как показали исследования, соединения Al, Fe, Si. В частности, нерастворимые комплексы Al и Fe дают
130
