
- •Мпс россии
- •1. Введение
- •2. Физические основы механики
- •Основные механические модели
- •1. Материальная точка.
- •2. Абсолютно твердое тело.
- •2.1. Кинематика материальной точки
- •Основные кинематические уравнения равнопеременного движения:
- •Движение материальной точки по окружности. Угловая скорость и угловое ускорение и их связь с линейными характеристиками движения
- •Для характеристики изменения вектора скорости на величину δv введем ускорение :
- •Угловая скорость и угловое ускорение
- •2.2. Динамика материальной точки и поступательного движения твердого тела
- •Взаимодействие тел. Второй закон Ньютона. Сила. Масса. Импульс. Центр масс
- •2.3. Законы сохранения в механике
- •Момент силы. Момент импульса. Закон сохранения момента импульса
- •Энергия. Работа. Мощность
- •Консервативные и неконсервативные силы
- •Закон сохранения энергии
- •2.4. Принцип относительности в механике
- •2.5. Элементы релятивистской динамики (специальной теории относительности)
- •2.6. Элементы механики твердого тела
- •2.7. Элементы механики сплошных сред
- •Упругое тело. Деформация. Закон Гука
- •3. Электричество и магнетизм
- •3.1. Электростатика
- •Закон Кулона
- •Электрическое поле
- •Принцип суперпозиции электрических полей
- •Поток вектора напряженности электрического поля
- •Теорема Остроградского – Гаусса и ее применение к расчету полей
- •Поле равномерного заряженной бесконечной прямолинейной нити
- •Поле равномерно заряженной плоскости
- •Работа сил электростатического поля при перемещении заряда. Потенциал
- •Связь между напряженностью и потенциалом электростатического поля
- •Идеальный проводник в электростатическом поле
- •Электроемкость уединенного проводника конденсатора
- •Энергия заряженного проводника
- •Энергия электрического поля. Объемная плотность энергии
- •3.2. Постоянный электрический ток
- •Закон Ома
- •Дифференциальная форма закона Ома
- •Закон Джоуля-Ленца
- •Закон Джоуля-Ленца в дифференциальной форме.
- •Правила Кирхгофа для разветвленных цепей.
- •3.3. Магнитное поле
- •Момент сил, действующих на виток с током в магнитном поле
- •Принцип суперпозиции магнитных полей
- •Закон Био-Савара-Лапласа и его применение к расчету магнитных полей
- •Взаимодействие параллельных токов
- •Контур с током в магнитном поле. Магнитный поток
- •Работа перемещения проводника и контура с током в магнитном поле
- •Явление электромагнитной индукции. Закон Фарадея
- •Явление самоиндукции
- •Токи замыкания и размыкания в цепи
- •Явление взаимоиндукции
- •Энергия магнитного поля
- •3.4. Статические поля в веществе Диэлектрики в электрическом поле
- •Магнитные свойства вещества
- •3.5. Уравнения Максвелла
- •Электромагнитные волны
- •3.6. Принцип относительности в электродинамике
- •3.7. Квазистационарное магнитное поле
- •4. Физика колебаний и волн
- •4.1. Кинематика гармонических колебаний
- •Сложение гармонических колебаний
- •4.2. Гармонический осциллятор
- •Свободные затихающие колебания
- •Логарифмический декремент затухания
- •4.3. Ангармонические колебания
- •4.4. Волновые процессы
- •4.5. Интерференция волн
- •Интерференция от двух когерентных источников
- •Стоячие волны
- •Интерференция в тонких пленках
- •4.6. Дифракция волн
- •Принцип Гюйгенса-Френеля
- •Дифракция Фраунгофера от одной щели
- •Дифракция от многих щелей. Дифракционная решетка.
- •4.7. Поляризация света
- •Поляризация при отражении света от диэлектрика
- •Двойное лучепреломление в анизотропных кристаллах
- •Закон Малюса
- •Степень поляризации
- •Вращение плоскости поляризации
- •4.8. Взаимодействие электромагнитных волн с веществом
- •5. Квантовая физика
- •5.1. Экспериментальное обоснование основных идей квантовой механики. Взаимодействие фотонов с электронами
- •Внешний фотоэффект
- •Эффект Комптона
- •Давление света
- •5.2. Корпускулярно – волновой дуализм
- •Соотношение неопределенностей
- •5.3. Квантовые состояния и уравнение Шредингера
- •5.4. Атом
- •Теория Бора для водородоподобных атомов.
- •5.5 Многоэлектронные атомы
- •5.6. Молекулы
- •5.7. Электроны в кристаллах
- •5.8. Элементы квантовой электроники
- •5.9. Атомное ядро
- •Радиоактивность. Закон радиоактивного распада
- •Закономерности α и β - распада
- •Ядерные реакции. Законы сохранения в ядерных реакциях
- •Реакция деления ядра. Цепная реакция. Ядерный реактор
- •Реакции синтеза. Термоядерные реакции
- •Элементарные частицы
- •6. Статистическая физика и термодинамика
- •6.1. Элементы молекулярно-кинетической теории
- •Модель идеального газа
- •Число степеней свободы молекул
- •Среднее число столкновений и средняя свободного пробега молекул
- •Явления переноса
- •Электрический ток в вакууме. Термоэлектронная эмиссия
- •Электрический ток в газах
- •6.2. Основы термодинамики Внутренняя энергия идеального газа. Работа
- •Внутренняя энергия идеального газа
- •Первый закон термодинамики
- •Изопроцессы
- •Термодинамические процессы, циклы
- •Круговые процессы. Второе начало термодинамики.
- •Цикл Карно
- •Фазовые превращения
- •Реальные газы. Уравнение Ван – дер – Ваальса
- •6.3. Функции распределения. Закон Максвелла для распределения молекул по скоростям
- •Барометрическая формула (распределение Больцмана)
- •Порядок и беспорядок в природе. Синергетика
- •Магнетики в тепловом равновесии. Ферромагнетизм
- •7. Заключение Современная физическая картина мира
Фазовые превращения
Фазой называется термодинамически равновесное состояние вещества, отличаются не химическим составом, а физическим свойствами от других равновесных состояний того же вещества (например, вода может находиться в трех фазах: жидком, твердом и в виде пара). Переход вещества из одной фазы в другую называется фазовым переходом.
Различают фазовые переходы IиIIрода. Фазовый переходIрода связан с поглощением или выделением тепла (например, плавление и кристаллизация). Фазовый переходIIрода не связаны с теплотой (например, переход некоторых веществ при определенных температурах в сверхпроводящее состояние см. п.5.7).
Для характеристики фазовых переходов используются диаграммы состояний (обычно в координатах Р – Т). На этих диаграммах можно найти точку одновременного равновесного осуществления трех фаз – тройную точку. Например, тройная точка для воды 273,16 К. Термодинамика позволяет рассчитать равновесие двух фаз одного вещества, пользуясь уравнением Клапейрона – Клаузиуса:
![]() ,
,
где производная от равновесного давления по температуре зависит от теплоты фазового перехода λ, температуры перехода и изменения объема фаз (например, при замерзании воды ее объем возрастает).
Реальные газы. Уравнение Ван – дер – Ваальса
Уравнение Менделеева – Клапейрона для 1 моля идеального газа имеет вид: PV=RT. Молекулы реального газа имеют размеры ~10-10м и поэтому следует учитывать их собственный объем, т.е. в уравнение Менделеева – Клапейрона вводится поправка «в» на объем, занимаемый самими молекулами (V0– в).
Действие сил взаимодействия между молекулами реального газа приводит к дополнительному внутреннему давлению Pi=a/V02, гдеV0– объем 1 моля газа, т.е.
(Р + Pi) = (Р + a/V02)
Поправка «а» и «в» постоянны для данного газа. С учетом этого для 1 моля реального газа уравнение состояния – уравнение Ван – дер – Ваальса примет вид
(Р + a/V02) (V0- в) =RT(6.54)
Это уравнение из-за сделанных упрощений также приближенно описывает состояние реального газа.
На рис. 6.10 проведены изотермы Ван – дер – Ваальса для различных температур. Если сравнивать их с изотермой идеального газа (рис.6.7), то заметим, что только при
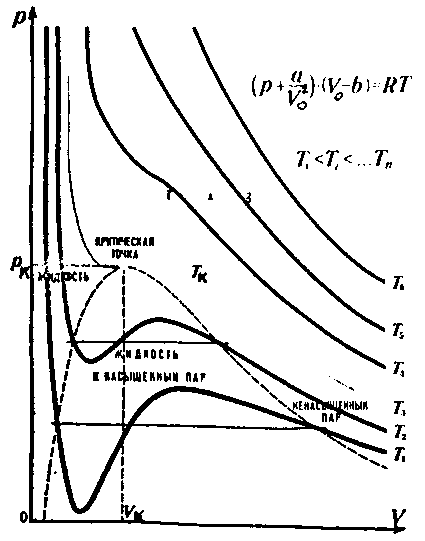
Рис.6.10
высоких температурах они схожи. При низких температурах изотермы отличаются горбами, при этом одному Р соответствует три объема. Среди изотерм Ван-дер-Ваальса есть такая, которая разграничивает изотермы с “горбами” от изотерм без “горбов”. Она отделяет области двухфазного состояния вещества (газообразного и жидкого) и однофазного (газообразного). Эта изотерма называется критической и соответствующие ей параметры Р,Vи Т также называются критическими. Понятие критической температуры Тк было введено Менделеевым. Менделеев рассматривал ее как температуру, при которой исчезают силы взаимодействия между молекулами и жидкость превращается в пар независимо от давления и занимаемого объема (на изотерме ей соответствуеткритическая точка).
6.3. Функции распределения. Закон Максвелла для распределения молекул по скоростям
Молекулы, находясь в состоянии непрерывного теплового движения, сталкиваются, обмениваются импульсами, поэтому скорости их неодинаковы (см.п.6.1). Максвелл для газа, находящегося в состоянии термодинамического равновесия, вывел закон распределения молекул идеального газа по скоростям. Обозначим число молекул,скоростикоторых заключены в интервале отVдоV+dV, черезdN.dNпропорциональноN-общему числу молекул и интервалуdV, т.е.
![]() ,
(6.55)
,
(6.55)
где
![]() -
функция распределения молекул, она
определяет относительное число молекул
из общего числа,скоростикоторых
лежат в интервале отVдоV+dV. Эта
функция
-
функция распределения молекул, она
определяет относительное число молекул
из общего числа,скоростикоторых
лежат в интервале отVдоV+dV. Эта
функция![]() ,
(6.56)
,
(6.56)
где константы
![]() ;
;![]() ;m- масса одной молекулы.
;m- масса одной молекулы.
График f(V) представлен на рис.6.12

Рис.6.12
На графике выберем
интервал скоростей молекул ΔV,
тогда![]() .
На графике любому интервалу ΔVсоответствует площадь ΔS(заштрихована) под кривой, численно
равная относительному числу молекул
.
На графике любому интервалу ΔVсоответствует площадь ΔS(заштрихована) под кривой, численно
равная относительному числу молекул![]() ,
скорости которых заключены в этом
интервале ΔV. Из графика
можно заключить, что относительное
число молекул с малыми скоростями или
с очень большими мало. Наибольшее число
молекул имеют скорости, близкие кVв–наиболее вероятной скорости.
,
скорости которых заключены в этом
интервале ΔV. Из графика
можно заключить, что относительное
число молекул с малыми скоростями или
с очень большими мало. Наибольшее число
молекул имеют скорости, близкие кVв–наиболее вероятной скорости.
![]() (6.57)
(6.57)
С увеличением температуры Т максимум кривой на рис. 6.12 сдвигается вправо (в сторону больших скоростей), растет и величина Vв.
Наиболее удобно распределение Максвелла
выражать через относительную скорость
υ=V/Vв.
Тогда![]()
Экспериментальная проверка распределения Максвелла была выполнена Штерном.
