
14. Хімічні властивості металів
Мета вивчення теми:
- використовувати електрохімічний ряд напруг металів для визначення окисно-відновних властивостей іонів і атомів металів;
- складати рівняння хімічних реакцій металів з водою, водними розчинами лугів, кислот, солей на основі теорії ОВР і з урахуванням гетерогенного характеру взаємодії.
Прості речовини в залежності від властивостей поділяються на метали і неметали. Метали і неметали розрізняють за фізичними властивостями простих речовин. З другого боку, вони відмінні і в хімічних властивостях: метали проявляють відновну активність, їх оксиди і гідроксиди здебільшого мають основний характер, неметали проявляють звичайно окисну дію, а їх оксиди і гідроксиди – кислотний характер.
Як фізичні, так і хімічні властивості металів випливають з особливостей металевого хімічного зв'язку. Зверніть увагу, що в більшості випадків на зовнішньому енергетичному рівні атомів металів знаходяться лише один або два електрони. Значно рідше зустрічаються атоми металів, що містять на зовнішньому рівні три (Аl і елементи підгрупи галію) і більше (Sn, Pb, Bi) електронів. Поясніть, як з особливостей хімічного зв'язку випливають такі характерні фізичні властивості як металевий блиск, висока електро- і теплопровідність, пластичність, ковкість, міцність і пружність, здатність до термо- і фотоелектронної емісії.
У таблиці елементів Д.І.Менделєєва 80% металів. До них відносяться: усі s-елементи (за винятком Н та Не), усі d- та f- елементи, а також частина р-элементів, розташованих під умовною діагональною лінією, що проходить від бору до астату.
Хімічна взаємодія металів з різними реагентами підлягає загальним закономірностям теорії окисно-відновних реакцій. Відносна активність металів оцінюється значеннями їх електродних потенціалів.
При аналізі хімічних взаємодій металів необхідно послідовно вирішити такі питання:
- Метали можуть проявляти тільки відновні властивості. Тому окисник слід знайти серед інших реагентів.
- При виборі окисника користуйтеся величинами ОВ-потенціалів. Перевірте термодинамічну можливість перебігу ОВР за нерівністю: Ме < Ox.
- Проаналізуйте можливість гальмування швидкості реакції внаслідок утворення на поверхні металу щільного шару нерозчинного продукту.
Приклад 1.Які метали і як можуть взаємодіяти з водою?
Розв’язання.При взаємодії металів з водою:
Me0
+ nH+2O
![]()
Red
у ролі потенційного окисника можуть виступати тільки
іони Н води. Покажіть, що інших окисників у розглянутій системі просто немає. Складаємо рівняння можливих напівреакцій окиснення і відновлення:
Ме0
- nē
![]() Men+
Men+
![]() Red
=
Red
=
![]() Men+/
Me
Men+/
Me
H2O
+ ē![]() (1/2)H2
+ OH-
(1/2)H2
+ OH-
![]() Ox
=
Ox
=![]() 2H+
/H2
2H+
/H2
і з урахуванням додаткових множників маємо сумарне рівняння реакції:
Me0
+ nH+2O
![]() Me+n(OH)n
+ (n/2)H20
Me+n(OH)n
+ (n/2)H20
Перевіряємо виконання термодинамічної умови перебігу ОВР: Ме < Ox. Оскільки у воді не виконуються стандартні умови для водневого електрода ([Н+] = 10-7 моль/л), обчислимо його потенціал за рівнянням Нернста:
![]() =
=![]() о
+ (0,059/2) lg[Н+]2
= 0 + (0,059/2)2(-7)
-0,41В.
о
+ (0,059/2) lg[Н+]2
= 0 + (0,059/2)2(-7)
-0,41В.
Таким чином, взаємодія з водою термодинамічно можлива для металів з ОВ-потенціалами меншими за -0,41В. Цій умові у нейтральному середовищі (рН = 7) задовольняє Fe і більш активні метали (табл.1).
У табл.1 наведені величини електродних потенціалів деяких металів у нейтральному середовищі. Значення потенціалів в табл.1 не являються стандартними. Окиснена форма металів відповідає їх існуванню у водних розчинах у формі нерозчинних гідроксидів або оксидів. Варто пам'ятати, що відновна активність лужних і лужноземельних металів у всіх середовищах може бути охарактеризована стандартними значеннями їх ОВ потенціалів (додаток).
Врахуємо фактор гетерогенності. Щоб реакція не гальмувалася щільним шаром продукту, гідроксиди, що утворюються, повинні бути розчинними.
Отже, взаємодіяти з водою можуть тільки метали, що мають величину електродного потенціалу меншу за – 0,41В та утворюють розчинні у воді гідроксиди (луги).
Обом цим умовам задовольняють тільки лужні (підгрупа ІА) та лужноземельні (ІІА ) метали. Помітно реагує з водою з утворенням TlOH також талій – найбільш активний з металів
підгрупи IIIA.
Таблиця 1
Електродні потенціали металів у нейтральному середовищі (рН=7)
|
Напівреакція окиснення |
|
|
Mg + 2H2O – ē Mg(OH)2 + 2H+ |
-2,28 |
|
Be + 2H2O – ē Be(OH)2 + 2H+ |
-2,23 |
|
Al + 3H2O –3 ē Al(OH)3 + 3H+ |
-1,89 |
|
Ti +H2O –2 ē TiO + 2H+ |
-1,72 |
|
Mn + 2H2O – 2ē Mn(OH)2 + 2H+ |
-1,14 |
|
Cr + 3H2O –3 ē Cr(OH)3 + 3H+ |
-1,07 |
|
Zn + 2H2O – 2ē Zn(OH)2 + 2H+ |
-0,81 |
|
Sn + 2H2O – 2ē Sn(OH)2 + 2H+ |
-0,51 |
|
Fe+ 2H2O – 2ē Fe(OH)2 + 2H+ |
-0,46 |
|
H2 – 2ē 2H+ |
-0,41 |
|
Cd + 2H2O – 2ē Cd(OH)2 + 2H+ |
-0,41 |
|
Co + 2H2O – 2ē Co(OH)2 + 2H+ |
-0,32 |
|
Ni+ 2H2O – 2ē Ni(OH)2 + 2H+ |
-0,30 |
|
Pb+ 2H2O – 2ē Pb(OH)2 + 2H+ |
-0,14 |
|
Cu+ 2H2O – 2ē Cu(OH)2 + 2H+ |
+0,20 |
|
Hg+H2O – 2ē HgO + 2H+ |
+0,51 |
|
2Ag+H2O – 2ē Ag2O + 2H+ |
+0,76 |
|
2Au + 3H2O –6 ē Au2O3 + 6H+ |
+1,04 |
Розглянемо взаємодію металів з водними розчинами лугів: Ме + NaOH + H2O = ?
Легко помітити, що в даній системі потенційні окисники – катіони металу Na+ і водню H+. Потенціал водню у лужному середовищі залишається значно вищим ніж у лужних і лужноземельних металів. Наприклад, при рН =14
![]() 2H+/
Н
2H+/
Н![]() =
- 0,059 рН = -0,83В
=
- 0,059 рН = -0,83В
Тому у ролі окисника виступають іони H+ , і перша стадія реакції така ж як при взаємодії металу з водою.
Яка ж роль лугу? Він взагалі не бере участі у реакції, якщо Ме – лужний або лужноземельний метал. Однак луг відіграє важливу роль у тому випадку, коли метал, що реагує, утворює нерозчинний амфотерний гідроксид. Останній розчиняється у лузі, контакт металу з водою поновлюється, і реакція йде до кінця. Зверніть увагу, що у лужному середовищі такі метали існують у вигляді аніонів, що змінює величини їх потенціалів (табл.2).
Таблиця 2
Електродні потенціали деяких металів у лужному середовищі
( рН = 14)
-
Напівреакція окиснення
 о,
В
о,
ВBe + 4OH- - 2ē [Be(OH)4]2-
-2,62
Al + 4OH- - 3ē [Al(OH)4]-
-2,35
Zn + 4OH- - 2ē [Zn(OH)4]2-
-1,22
Sn + 4OH- - 2ē [Sn(OH)4]2-
-0,91
H2 – 2ē 2H+
-0,83
Pb + 4OH- - 2ē [Pb(OH)4]2-
-0,54
Приклад 2.Як взаємодіє цинк із водним розчином лугу?
Розв’язання. ОВ-потенціал цинку (табл.2) менший за потенціал води:
![]() [Zn(OH)4]2-/
Zn = -1,22В
[Zn(OH)4]2-/
Zn = -1,22В
![]() 2H+/
Н
2H+/
Н![]() = -0,83 В
= -0,83 В
Отже, взаємодія Zn з водою термодинамічно можлива. Перша стадія:
Zn + 2Н2О = Zn (ОН)2 + Н2.
Але утворення нерозчинного гідроксиду швидко гальмує процес, тому у воді реакція практично не йде. На другій стадії амфотерний гідроксид цинку розчиняється у розчині лугу з утворенням цинкату:
Zn (ОН)2 + 2NaOH Na2[Zn (ОН)4],
і реакція йде до кінця. Сумарне рівняння взаємодії:
Zn + 2NaOH + 2Н2О = Na2[Zn (ОН)4] + Н2.
Отже, метали, що розчиняються у водних розчинах лугів, повинні задовільняти наступним умовам:
а) електродний потенціал металу в лужному середовищі повинен бути нижчим за потенціал водневого електроду: - 0,059 рН;
б) гідроксид металу має бути амфотерним (або розчинним).
До числа металів, що розчиняються у лузі, але не у воді, відносяться Zn, Al, Be, Pb, Sn та ін. (табл.2).
Розглянемо взаємодію металів з розчинами кислот. Відношення металів до водних розчинів кислот визначається як активністю металу, так і природою кислоти, і її концентрацією.
Приклад 3.Які метали і як взаємодіють із соляною кислотою?
Розв’язання.
У соляній кислоті HCl окисником є тільки
іони Н+
(доведіть, чому у цьому випадку можна
не брати до уваги окисні
властивості води). У
розчинах кислот [Н+]
1 моль/л і
![]() 2H+/
Н
2H+/
Н![]()
0 В.
0 В.
Отже,
взаємодія з HCl
термодинамічно
можлива тільки
для металів з
негативним електродним потенціалом:
![]() Men+/Me00,
тобто, для тих, що розташовані в
електрохімічному ряду до
водню. Як визначити
продукти реакції? Іони водню з кислоти
відновлюються до молекулярного водню,
а продукт окиснення – катіони металу
зв'язуються аніонами Cl-
у сіль. Звідси одержуємо молекулярне
рівняння реакції:
Men+/Me00,
тобто, для тих, що розташовані в
електрохімічному ряду до
водню. Як визначити
продукти реакції? Іони водню з кислоти
відновлюються до молекулярного водню,
а продукт окиснення – катіони металу
зв'язуються аніонами Cl-
у сіль. Звідси одержуємо молекулярне
рівняння реакції:
Ме + nHCl = МеCln + (n/2)Н2
Оскільки хлориди більшості активних металів добре розчинні, фактор гетерогенності, як правило, не накладає обмежень на протікання цієї реакції. Аналогічно взаємодіють з металами й інші кислоти, аніони яких не містять більш активних окисників, ніж ''кислотний'' водень Н+.
Приклад 4.Як метали взаємодіють з азотною кислотою?
Розв’язання. Окисно-відновні реакції за участю азотної кислоти відбуваються за досить складними механізмами. Водень при цьому не виділяється. Це пояснюється тим, що із двох потенційних окисників Н+ (як у будь-якій кислоті) та N+5 (в нітрат-іоні NO3-), сильнішим є NO3- .
![]() 0(NO3-/…)
= + (0,81,2)В
0(NO3-/…)
= + (0,81,2)В
![]() 02H+/
Н
02H+/
Н![]() = 0 (В)
= 0 (В)
Тому азотна кислота окиснює метал за рахунок NO3-, а не Н+.
Можливі шляхи відновлення азотної кислоти можна подати такою загальною схемою:
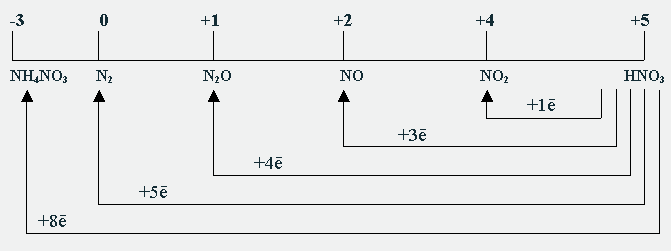
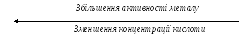
Природа продуктів відновлення азотної кислоти, їх вміст у суміші залежать від активності металу, концентрації НNO3 та температури. При цьому чим менша концентрація кислоти, тим вищий вміст у суміші продуктів більш глибокого відновлення. Запис рівнянь окисно-відновних реакцій за участю азотної кислоти здебільшого умовний, оскільки вказують лише один продукт відновлення, вихід якого за даних умов є максимальним.
У концентрованих розчинах НNO3 головним продуктом її відновлення незалежно від активності металу є NO2. Наприклад:
Сu + 4НNO3(конц) = Сu(NO3)2 + 2NO2 + 2Н2О
Ox: NO3-
+ 1ē +2Н+
= NO2+
Н2О,
![]() 0(NO3-
/ NO2
) = 0,80 В
0(NO3-
/ NO2
) = 0,80 В
Глибина відновлення НNO3 у розведеному розчині зростає в міру підвищення активності металу.
Малоактивні метали (їм відповідають додатні стандартні електродні потенціали) відновлюють розведену НNO3 до NO. Наприклад:
3Сu + 8НNO3 = 3Сu(NO3)2 + 2NO + 4Н2О
Ox: NO3-
+ 3ē + 4Н+
= NO+
Н2О,
![]() 0(NO3-
/ NO) = 0,96 В
0(NO3-
/ NO) = 0,96 В
Активні метали (їм відповідають відємні стандартні електродні потенціали) відновлюють розведену НNO3 переважно до N2O та N2 , наприклад:
4Zn +10НNO3 = 4Zn(NO3)2 + N2O + 5Н2О
Ox: 2NO3-
+ 8ē +10Н+
= N2O+5Н2О,
![]() 0(2NO
- /
N2O) =
1,12 В
0(2NO
- /
N2O) =
1,12 В
5Mg + 12НNO3 = 5Mg(NO3)2 + N2 + 6Н2О
Ox: 2NO3-
+ 10ē +12Н+
= N2+
6Н2О,
![]() 0(2NO3
- /
N2) =
1,25 В
0(2NO3
- /
N2) =
1,25 В
Дуже розведена НNO3 найчастіше відновлюється активними металами до найнижчого ступеня окиснення азоту:
4Mg + 10НNO3 = 4Mg(NO3)2 + NН4NO3 + 3Н2О
Ox: NO3-
+ 8ē +10Н+
= NН4++3Н2О,
![]() 0(NO3
- /
NН4+)
= 0,87 В
0(NO3
- /
NН4+)
= 0,87 В
Концентрована НNO3 на холоді пасивує деякі відносно активні метали, зокрема – алюміній, залізо, кобальт, нікель, хром та їхні сплави внаслідок утворення на поверхні міцних оксидних плівок цих металів.
Слід також памятати, що стійкими в азотній кислоті є тільки золото, платина, осмій, іридій, ніобій, тантал, вольфрам.
Приклад 5.Чому золото не розчиняється в азотній і соляній кислотах, але розчиняється в "царській горілці"?
Розв’язання. "Царська горілка" - це суміш концентрованих азотної і соляної кислот у співвідношенні 1:3. У кожному з цих реагентів, узятих окремо, золото стійке: ОВ-потенціал азотної кислоти (+0,81,2 В) і, тим більше, соляної (0 В) недостатній для окиснення золота (+1,50 В).
У присутності соляної кислоти катіони Au3+ утворюють комплексний аніон [AuCl4]-. За рахунок цього ОВ-потенціал золота різко знижується :
Au + 4Сl-
- 3ē
[AuCl4]-
,
![]() ºRed
= +1,00 B
ºRed
= +1,00 B
і стає близьким до потенціалу окисника NO3- :
NO3-
+ 4H+
+ 3ē
NO + 2H2O,
![]() ºOx
= +0,96B.
ºOx
= +0,96B.
Завдяки цьому "царська горілка" легко розчиняє платину, золото та інші неактивні метали, перетворюючи їх на комплексні хлориди, що сприяє перебігу процесу окиснення металів:
Au + HNO3 + 3HСl = AuСl3 + NO + 2H2O ,
AuСl3 + HСl H[AuCl4].
Хоча стандартна ЕРС сумарної реакції
Au + 4HСl + HNO3 = H[AuCl4] + NO + 2H2O
трохи менша нуля: Еº = 0,96-1,00 = -0,04 В, у реальних умовах (висока концентрація кислоти) ОВ-потенціал окисника підвищується, і розчинення золота протікає з достатньою швидкістю.
Як видно, у цьому випадку соляна кислота відіграє роль не окисника, а постачальника лігандів (Cl-), що утворюють з катіоном Au3+ міцний комплекс. У результаті цього відновна активність золота підвищується і стає достатньою для реакції із сильним окисником – азотною кислотою.
Аналогічно в "царській горілці" розчиняються і деякі інші благородні метали, наприклад, платина:
3Рt + 4 HNO3 + 18HСl = 3H2[РtCl6] + 4NO + 8H2O.
Приклад 6. У чому відмінність у дії на метали розведеної і концентрованої сірчаної кислоти?
Розв’язання. У сірчаній кислоті Н2SO4, також як і в азотній, два потенційних окисника: Н+ і S+6(сірка в ВСО) у сульфат-іоні SO42-. Але, на відміну від HNO3, у Н2SO4 окисно-відновні потенціали двох ймовірних окисників досить близькі:
![]() º2H+/
Н
º2H+/
Н![]() = 0 В і
= 0 В і
![]() 0
(SO42-/…)
= (0,170,36)
В
0
(SO42-/…)
= (0,170,36)
В
Тому, Н2SO4 може окиснювати або за рахунок SO42-, або за рахунок іонів водню залежно від концентрації кислоти та активності металу.
У розведеній Н2SO4 окисником є катіони Н+, тому що їхня концентрація в цьому випадку досить велика завдяки високій ступені дисоціації кислоти. Тому розведена кислота окиснює (розчиняє) тільки ті метали, що розміщені в ряду електрохімічних потенціалів до водню (за умови утворення розчинних сульфатів):
Zn + Н2SO4 = ZnSO4 + Н2.
Запамятайте, що продуктом відновлення розведеного розчину сірчаної кислоти є водень Н2.
Висновок.
Розведена Н2SO4
діє на метали
аналогічно соляній кислоті (з виділенням
водню) при
![]() 0(
Меn+/Ме)
0.
0(
Меn+/Ме)
0.
У концентрованій Н2SO4 окисником є аніони SO42- (S+6), через високу концентрацію сульфат-іонів і малу концентрацію іонів Н+.
Продукти відновлення концентрованої Н2SO4 можуть бути різними залежно від активності металу та умов проведення процесу. Послідовне відновлення концентрованої сірчаної кислоти і основні форми продуктів реакції можна подати нижченаведеною загальною схемою.
В разі взаємодії з малоактивними металами концентрована Н2SO4 відновлюється до SO2. До малоактивних металів умовно можна віднести метали, що розташовані в ряду напруг починаючи приблизно з кадмію.
Сu + Н2SO4(конц) = СuSO4 + SO2+ 2Н2О
Оx: SO42-
+ 2ē + 4Н+ =
SO2+
2Н2О,
![]() º
(SO42-/
SO2) =
0,17 В
º
(SO42-/
SO2) =
0,17 В
Більш активні метали відновлюють концентровану Н2SO4 до елементарної сірки, або навіть до Н2S. Найчастіше утворюється суміш продуктів відновлення сірчаної кислоти. Наприклад, під час взаємодії цинку з Н2SO4(конц) відбуваються переважно дві реакції:
3Zn + 4Н2SO4(конц) = 3ZnSO4 + S + 4Н2О
Оx: SO42-
+ 6ē + 8Н+ =
S+
4Н2О,
![]() º
(SO42-/
S) = 0,36 В
º
(SO42-/
S) = 0,36 В
4Zn + 5Н2SO4(конц) = 4ZnSO4 + Н2S + 4Н2О
Оx: SO42-
+ 8ē + 10Н+ =
Н2S+
4Н2О,
![]() º
(SO42-/Н2S
)= 0,15 В
º
(SO42-/Н2S
)= 0,15 В
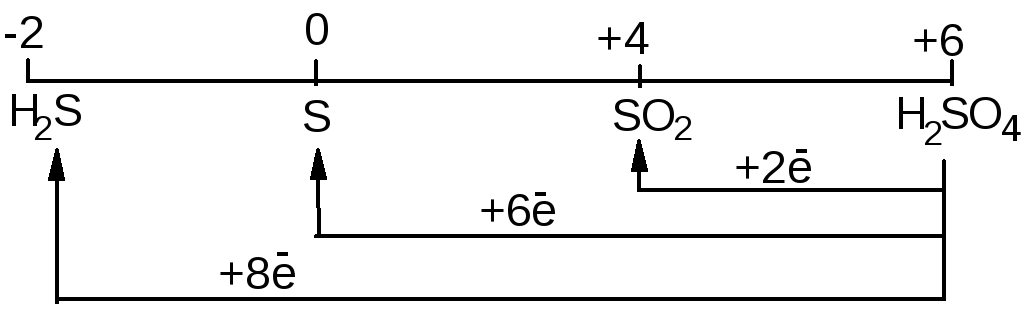
з більшення
активності металу
більшення
активності металу
Внаслідок пасивації значна частина металів (особливо d-елементів) практично не розчиняється у концентрованій Н2SO4. До них відносяться: Al, Fe, Cr, тощо.
У концентрованій сірчаній кислоті не розчиняються також благородні метали ( Au, Pt тощо).
Висновок. Глибина відновлення SO42- при розчиненні металів у концентрованій Н2SO4 змінюється в залежності від активності металу і температури:
SO42- + 4Н+ + 2ē SO2 + 2Н2О ( з малоактивними Ме),
SO42- + 8Н+ + 6ē S + 4Н2О ( з більш активними Ме),
SO42- + 10Н++8ē Н2S+ 4Н2О(з найбільш активними Ме).
ДОМАШНЄ ЗАВДАННЯ
1. Охарактеризуйте хімічне відношення кальцію, цинку, міді і свинцю до води і розчину лугу. Приведіть рівняння відповідних реакцій. Чи припустимо застосування свинцю для виготовлення водопровідних труб?
2. Чому розчини лугів не можна зберігати в алюмінієвій тарі? Обґрунтуйте відповідь рівняннями реакцій, що відбуваються.
3. У якій кислоті можна розчинити срібло? А платину? Складіть рівняння реакцій розчинення.
У задачах 4 – 7 складіть рівняння взаємодії вказаного металу з
соляною, сірчаною (розведеною і концентрованою) і азотною (розведеною і концентрованою) кислотами.
4. Магній.
5. Залізо.
6. Мідь.
7. Ртуть.
8. Якими реагентами (кислотами і лугами) і в якій послідовності треба обробити порошкоподібну суміш алюмінію, нікелю і міді, щоб одержати розчини, що містять тільки один із цих металів?
9. Визначте масові частки компонентів суміші, що складається з порошків алюмінію, магнію і міді, якщо при обробці суміші масою 2,5 г надлишком розчину гідроксиду натрію виділилося 1,12 л водню, а при обробці такої ж маси суміші соляною кислотою виділилося 2,24 л водню (н.у.).
Відповідь: 36%Al, 48%Mg,16%Cu.
10. При взаємодії 8 г порошкоподібної суміші заліза і магнію із соляною кислотою, виділилося 4,48 л водню (н.у.). Яка масова частка заліза в суміші? Відповідь: 70%.
15. Е Л Е К Т Р О Л І З
Мета вивчення теми:
- визначати можливість і послідовність перебігу процесів електролізу;
- складати рівняння катодних і анодних процесів, а також
загальну схему електролізу розплавів і водних розчинів електролітів з нерозчинним і розчинним анодами;
- виконувати розрахунки кількості, маси і обєму речовин, які отримують при електролізі.
Електролізом називають сукупність окисно-відновних та інших фізикохімічних процесів, які відбуваються при пропусканні крізь розчин або розплав електроліту постійного електричного струму.
Е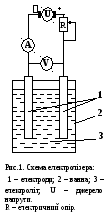 лектроліз
проводиться у електролізерах, основними
складовими частинами яких є електроди
і ванна, у якій знаходиться іонний
провідник – електроліт (рис.1). На
електрод, що зєднаний
із негативним полюсом зовнішнього
джерела електричного струму, надходять
електрони. Тому на цьому електроді
відбувається процес відновлення. Це –
катод. На другому електроді, що зєднаний
із позитивним полюсом, перебігає процес
окиснення. Це – анод.
лектроліз
проводиться у електролізерах, основними
складовими частинами яких є електроди
і ванна, у якій знаходиться іонний
провідник – електроліт (рис.1). На
електрод, що зєднаний
із негативним полюсом зовнішнього
джерела електричного струму, надходять
електрони. Тому на цьому електроді
відбувається процес відновлення. Це –
катод. На другому електроді, що зєднаний
із позитивним полюсом, перебігає процес
окиснення. Це – анод.
Перебіг процесу електролізу можливий за умовою, що напруга зовнішнього джерела перевищує деяку мінімальну величину (напругу розкладу). Напруга розкладу залежить перш за все від природи електроліту і дорівнює різниці Е між рівноважними потенціалами електродів (або іншими словами – ЕРС гальванічного елемента, який утворюється при електролізі). За реальних умов напруга електролізу перевищує Е за рахунок поляризацій катода к і анода а, а також омічного падіння напруги на провідниках першого та другого роду в електричному колі:
U = E +к+а+ I (r1 + r2)
де I – електричний струм, А; r1 і r2 – електричний опір провідників першого і другого роду відповідно, Ом.
Катодні процеси. На катоді відновлюються катіони або нейтральні молекули, що знаходяться біля нього. Наприклад:
Cu2++ 2ē Cu,
Fe3++ ē Fe2+,
2H2O + 2ē H2 + 2OH.
Термодинамічну умову відновлення частинок на катоді можна сформулювати, якщо зважити, що катод діє як відновник. Отже, умовою перебігу катодного процесу є нерівність: Ox катод, де Ох – частинка з окисними властивостями, що відновлюється на катоді. Коли в розчині чи розплаві є декілька здатних до відновлення частинок, то на катоді в першу чергу відновлюватимуться ті з них, які є сильнішими окисниками і тому мають більші значення ОВ-потенціалів.
Приклад 1. В якій послідовності будуть виділятися на катоді метали при електролізі розплаву, що містить катіони Na+ і Al3+?
Розв’язання. Розташуємо ОВ-системи, що відповідають вказаним катіонам, у порядку зменшення їх ОВ-потенціалів:
-
ОВ-система:
Al3+/Al
Na+/Na
ОВ-потенціал, В:
1,66
2,71
Саме у такому порядку частинки будуть відновлюватися на катоді при підвищенні напруги від зовнішнього джерела і відповідному зменшенні катодного потенціалу. Спочатку відновлюється алюміній:
Al3+ + 3ē Al
Лише після практично повного осадження алюмінію на катоді почнеться виділення натрію:
Na+ + ē Na
В водних розчинах слід враховувати можливість катодного відновлення іонів водню чи молекул води:
2H+ + 2ē H2
2H2O + 2ē H2 + 2OH
Якщо зважити на те, що концентрації молекул Н2О і іонів H+ пов'язані рівновагою процесу автодисоціації води
H2O H+ + OH ,
легко зрозуміти, що обом наведеним рівнянням відповідає та сама ОВ-система, потенціал якої залежить від концентрації іонів водню, тобто величини рН (рис.2). За рівнянням Нернста можна розрахувати:
(2H+/H2) = – 0,059 рН
і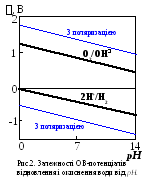 у нейтральному середовищі(2H+/H2)
= – 0,41 В.
у нейтральному середовищі(2H+/H2)
= – 0,41 В.
При тих величинах густини струму, що реально застосовують при електролізі, стає помітною поляризація електродів.Поляризація електрода, на якому виділяється газ, звичайно значно більша, ніж при виділенні металу. Тому при підвищенні струму потенціал відновлення води значно зменшується (рис.2).
Враховуючи на можливі зміни ОВ-потенціалів (внаслідок поляризації, зміни рН, концентрації іонів тощо) метали умовно поділяють на такі три групи відносно здатності їх катіонів до катодного відновлення із водних розчинів.
Першу групу складають метали з потенціалами значно меншими за рівноважний потенціал водневого електрода у воді (–0,41 В). До них відносять метали від початку ряду і приблизно до Al включно. Такі метали не виділяються на катоді при електролізі водних розчинів, тому що їх потенціали завжди менші за потенціал води ((Men+/Me)< (2H+/H2)), навіть якщо зважати на значну поляризацію електродів або можливі зміни інших факторів, що впливають на величини ОВ-потенціалів. На катоді відновлюється вода з виділенням водню.
У другу групу попадають метали з потенціалами, що трохи більші або менші за рівноважний потенціал води (–0,41 В). Вони стоять в електрохімічному ряду приблизно між алюмінієм і воднем. Зміна концентрації іона Меn+, рН розчину, поляризація електродів при різній густині струму можуть змінити співвідношення між величинами потенціалів іонів водню і катіонів металу ((Men+/Me)< (2H+/H2) або (Men+/Me)> (2H+/H2)). Отже, при електролізі водних розчинів, що містять катіони металів другої групи, в залежності від умов процесу на катоді може виділятися тільки водень, або одночасно водень і метал, або тільки метал.
Третю групу становлять метали, потенціали яких значно більші за потенціал водневого електрода. До них відносять метали, що стоять в електрохімічному ряду за воднем. Зміни умов електролізу не спроможні змінити співвідношення між потенціалами металів і води: (Men+/Me) > (2H+/H2). Тому на катоді за будь яких умов відновлюється метал: Меn+ + nē Me.
Анодні процеси. Анод діє як окисник, що приймає електрони від частинок електроліту і через зовнішнє коло передає їх до позитивного полюса джерела струму. Наприклад:
2Сl 2ē Cl2,
2H2O 4ē O2 + 4H+,
2SO42 – 2ē S2O82.
Отже, умовою перебігу анодного процесу є така нерівність: Red < анод, де Red – частинка з відновними властивостями, яка окиснюється на аноді. Якщо в електроліті є кілька здатних до окиснення частинок, то при поступовому підвищенні зовнішньої напруги і відповідно потенціала анода в першу чергу окиснюються ті з них, які є сильнішими відновниками і мають менші ОВ-потенціали.
Слід мати на увазі, що під час електролізу може окиснюватись і матеріал анода, якщо його ОВ-потенціал не досить високий. Тому розрізняють електроліз із інертним і активним анодом. Для інертних анодів, що не окиснюються при електролізі, найчастіше використовують графіт або такі благородні метали як платина. Активні або розчинні аноди виготовляють з менш стійких металів, таких як Fe, Ni, Cu та інших, здатних окиснюватись під час електролізу.
Під час електролізу водних розчинів слід враховувати можливість анодного окиснення гідроксид-аніонів або води:
4ОH 4ē О2 + 2Н2О
2H2O 4ē О2 + 4H+
Два наведених рівняння відображають два можливі механізми окиснення в тій самій ОВ-системі, потенціал якої так залежить від величини рН середовища (рис.2):
(ОH/О2) = 1,23 – 0,059 рН
У нейтральному середовищі (рН =7):
(ОH/О2) = 0,82 В.
Здатність багатьох анодних реакцій до значної поляризації утруднює їх аналіз на основі рівноважних ОВ-потенціалів. В багатьох випадках можна користуватися такою спрощеною схемою послідовності анодних процесів:
а) Якщо анод розчинний, він окиснюється у першу чергу:
Me nē Men+
б) Під час електролізу водних розчинів із інертним анодом на аноді спочатку окиснюються такі одноатомні аніони як S2, I, Br, CI: S2 – 2ē S і т.д.
Вони мають потенціали у межах від –0,5 до +1,4 В і поляризуються значно менше води.
в) За відсутністю або після вичерпування одноатомних аніонів на аноді окиснюється вода, потенціал якої внаслідок поляризації досягає 1,5 В і більше (рис.2).
г) Аніони кисневмісних кислот (SO42, PO43, NO3, СO32 та інші), а також фторид-іони F мають дуже високі потенціали і з водних розчинів не окиснюються. На аноді відбувається електрохімічне окиснення води з виділенням газоподібного кисню.
Розгляд процесу електролізу рекомендується проводити у такій послідовності: а) написати рівняння процесів дисоціації електролітів, вказати катіони та аніони; б) визначити частинки, які знаходяться біля катода і біля анода; в) скласти рівняння катодного та анодного процесів; г) написати сумарне рівняння електролізу; д) визначити продукти, шо нагромаджуються під час електролізу в прикатодному та прианодному просторах.
Приклад 2. Складіть схему електролізу водного розчину сульфату калію з інертним анодом.
Розв’язання. Складаємо рівняння процесів дисоціації у розчині, вказуємо стрілками напрямок міграції іонів і визначаємо частинки, що зосереджується біля катода та анода:
К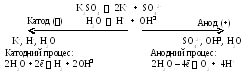 алій
- метал, умовно віднесений до першої
групи, тому на катоді електрохімічно
відновлюється вода. Умовно вважають,
що у кислому середовищі прирН
<
7
відновлюються іони водню, а при рН
7
– молекули води. Біля аноду кисневмисний
сульфат-іон не буде окиснюватись, замість
цього окиснюється вода. Також умовно
приймають, що при рН
>
7
окиснюються гідроксид-іони, а в
нейтральному і кислому середовищі –
молекули води.
алій
- метал, умовно віднесений до першої
групи, тому на катоді електрохімічно
відновлюється вода. Умовно вважають,
що у кислому середовищі прирН
<
7
відновлюються іони водню, а при рН
7
– молекули води. Біля аноду кисневмисний
сульфат-іон не буде окиснюватись, замість
цього окиснюється вода. Також умовно
приймають, що при рН
>
7
окиснюються гідроксид-іони, а в
нейтральному і кислому середовищі –
молекули води.
Складаємо сумарне рівняння електролізу:
2
 H2O
+ 2ē
H2
+ 2OH
2
2
H2O
+ 2ē
H2
+ 2OH
2
2
2H2O 4ē О2 + 4H+ 4 1
Для цього складемо алгебраїчно подвоєне рівняння катодного процесу з рівнянням анодного процесу і зважимо, що 4H+ + 4OH 4Н2О. Отримуємо:
2Н2О 2H2 + O2
На початку процесу електролізу до виходу на його стаціонарний режим у просторі біля катоду нагромаджуються іони K+ і OH. Це дає можливість із прикатодного простору одержувати гідроксид калію. Аналогічно визначаємо, що з прианодного простору можна одержувати розведену сірчану кислоту.
Приклад 3. Схема електролізу водного розчину CuI2 з графітовим анодом.
Розв’язання. Розглядаємо процес електролізу за такою ж схемою, як і в попередньому прикладі:
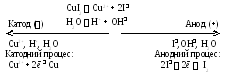
На катоді відновлюються катіони міді (третя група катіонів). Катод вкривається міддю. На аноді окиснюються йодид-іони, виділяється йод. Сумарне рівняння електролізу:
CuI2 Cu2+ + 2I Cu + I2
За рахунок міграції іонів в прикатодному просторі збільшується кислотність (рН зменшується), а біля анода зростає лужний характер розчину (рН зростає).
Приклад 4. Як перебігає електроліз водного розчину CuI2 з мідним анодом?
Розв’язання. Мідний електрод розчинний. Тому на аноді окиснюється мідь, а катодний процес такий же, як і в попередньому прикладі.
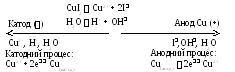
Сумарний процес полягає в переносі міді з анода на катод:
Cu(анод) Cu(катод)
Маса анода зменшується, а катода – збільшується. Такий процес використовують для очищення (рафінування) міді та інших металів.
Кількісні закони електролізу були вперше встановлені англійським фізиком М.Фарадеєм.
Перший закон Фарадея. Маса речовини, що утворюється на електроді, прямо пропорційна кількості пропущеної електрики:
m = k Q = k I
де m – маса речовини, що виділилася на електроді, г; k – коефіціент пропорційності, який називають електрохімічним еквівалентом, г/Кл; Q = (I ) – кількість електрики, Кл; I – струм, А; - час, с.
Електрохімічний еквівалент – це маса речовини, що утворилася на електроді при пропусканні крізь електроліт одного кулона електрики. Його величина обчислюється за формулою:
k = Mекв /F
де F – константа Фарадея; F = 96485 Кл/моль 96500 Кл/моль.
Тоді перший закон Фарадея можна виразити формулою:
m = (Mекв/F) I
а для газоподібних речовин:
V = (Vекв/F) I
де Vекв - молярний обєм еквівалентів газу за даних умов.
Другий закон Фарадея. При проходженні однієї і тієї ж кількості електрики маси різних речовин, що утворюються на електродах, пропорційні молярним масам їх еквівалентів:
m(A) : m(B) = Мекв(А) : Мекв(В)
або
nекв(А) = nекв(В).
Приклад 5. Струм силою 5А пропускали крізь водний розчин сульфату калію на протязі двох годин. Розрахуйте масу водню і обєм кисню (н.у.), які виділилися на електродах.
Розв’язання. За першим законом Фарадея:
![]()

Приклад 6. При електролізі водного розчину СuCI2 на аноді виділилися 4,48 л хлору (н.у.). Знайдіть масу міді, яка виділилась на катоді.
Розв’язання. За другим законом Фарадея:
nекв(CI2) = nекв(Cu)
або
![]()
звідки знаходимо масу міді, що виділилась на катоді:
![]()
Якщо потенціали двох або кількох електродних реакцій однакові або близькі за величинами, то такі реакції перебігають одночасно. Електрика, що пройшла через систему, витрачається на всі ці реакції. Доля загальної кількості електрики, що витрачається на виділення однієї з речовин, називається виходом за током цієї речовини:
![]()
де Qi – кількість електрики, витраченої на перетворення i-тої речовини, Q – загальна кількість електрики, що пройшла крізь розчин.
ДОМАШНЄ ЗАВДАННЯ
1. Сформулюйте термодинамічну умову перебігу катодних процесів. У розчині знаходяться катіони Hg2+, Cu2+, Zn2+ і Au3+ (концентрація їх 1 моль/л). Які з них будуть відновлюватися при потенціалі катода +0,6В відносно стандартного водневого електрода?
2. Сформулюйте термодинамічну умову перебігу анодних процесів. У розчині знаходяться іони Sn2+, CI, Fe2+, I (1моль/л). Які з них будуть окиснюватися на аноді при потенціалі +0,6В відносно стандартного водневого електрода?
3. Яка послідовність катодних процесів? В якій послідовності при поступовому підвищенні напруги будуть виділятися метали при електролізі розчину, який містить в однаковій концентрації катіони Ni2+, Ag+, Zn2+, Cu2+?
4. Яка послідовність анодних процесів? В якій послідовності при поступовому підвищенні напруги будуть окиснюватися Fe2+, Sn2+, I, OH, якщо концентрація їх у розчині однакова?
5. Складіть рівняння електродних реакцій при електролізі водних розчинів фосфату калію і хлориду натрію з нерозчинними анодами.
6. Складіть рівняння електродних реакцій при електролізі водного розчину сульфату нікелю(II): а) з нерозчинним анодом, б) з нікелевим анодом.
7. Розрахуйте масу речовини, яка розклалась при електролізі водного розчину сульфату калію з нерозчинним анодом, а також обєм О2, масу КОН і Н2SO4, що були отримані при електролізі, якщо на катоді виділилось 1,12 л Н2, виміряного за нормальних умов. Відповідь: 2,7 г; 0,56 л; 5,6 г; 4,9 г.
8. При електролізі водного розчину сульфату цинку з нерозчинним анодом на катоді виділилось 0,1 л Н2, виміряного за нормальних умов. Електроліз проводили 2 години при струмі в 2,5А. Визначте вихід за током водню і цинку. Відповідь: 47,9 ; 52,1.
9. Скільки часу треба пропускати струм силою 2,5А крізь розчин нітрату срібла, щоб виділити 15 г срібла?
Відповідь: 5361 с = 1 год. 29 хв. 21 с.
10. При електролізі розчину сульфату натрію на аноді виділилось 5,6 л О2 (н.у.). Який обєм водню виділився на катоді? Відповідь: 11,2 л Н2.
