
general_chem2
.pdf111
Таким образом, активность атомов металлов как восстановителей и их катионов как окислителей существенно зависит от среды, в которой находится металл.
Оценка активности окислителей
Ниже указаны ионы, являющиеся потенциальными окислителями (Ох) в
следующих реагентах |
|
|
|
|
||
Н2О Н+ + ОН ; HCl Н+ + Cl ; |
|
|
||||
|
|
Ox |
|
Ox |
|
|
2 |
4 |
+ |
2 |
+ |
|
|
H |
SO |
2Н + SO4 |
; HNO3 Н + NO3 |
|
||
|
|
Ox |
Ox |
Ox |
Ox |
|
Как видно, окислительные свойства воды и соляной кислоты обусловлены только |
||||||
ионами водорода Н+. Активность этого окислителя зависит от величины pН раствора |
||||||
|
|
|
|
2H /H 2 = 0,059 рН |
||
(При рН = 0, т.е. в сильнокислом растворе, o |
= 0,0 В, в нейтральной среде (рН |
|||||
|
|
|
|
|
2H |
/H2 |
= 7) 2H /H 2 = 0,41 В, а в сильнощелочной (рН = 14) потенциал понижается до 2H /H 2 =
0,83 В.
Серная и азотная кислоты содержат по два потенциально возможных окислителя: катионы водорода и анионы кислотных остатков. Последние проявляют окислительные свойства за счет серы и азота, имеющих высшие степени окисления (S+6 и N+5).
В серной кислоте в зависимости от условий окислителем может быть либо Н+ (разбавленная кислота), либо кислотный остаток (концентрированная). В азотной кислоте
окислительная активность NO3 значительно выше, чем Н+. Поэтому и разбавленная, и концентрированная HNО3 окисляет металлы анионом NO3 .
Из этого следуют такие выводы:
а) В реакциях металлов с водой, растворами соляной и разбавленной серной кислот одним из продуктов реакции является молекулярный водород:
2Н+ + 2ē Н2
б) При взаимодействии металлов с азотной (разбавленной и концентрированной) и концентрированной серной кислотами свободный водород, как правило, не выделяется. Катионы водорода в этих реакциях переходят в молекулы воды.
Оценка активности металла (восстановителя) и реагента (окислителя) необходима для выяснения термодинамической возможности взаимодействия между ними, условием
которого является убыль энергии Гиббса ( G < 0). Для ОВР это равнозначно
положительному значению э.д.с реакции Е: Е > 0 или, что то же, условию: Ох > Red. Однако, термодинамическая возможность реакции сама по себе еще не означает,
что она будет протекать с достаточной скоростью. Все рассматриваемые реакции являются гетерогенными и протекают на поверхности металла. От того, накапливаются ли продукты реакции на этой поверхности, зависит наличие контакта между металлом и реагентом, что и определяет в конечном счете скорость процесса. Если поверхность металла покрывается плотными пленками продуктов реакции (оксидными, гидроксидными, солевыми и другими), то подвод реагента к металлу затрудняется и реакция затормаживается или практически прекращается. О таких реакциях говорят, что они протекают в первый момент.
Пример 1. Взаимодействуют ли с водой следующие металлы: серебро, алюминий, кальций?

112
Решение. Используя табл. 1 и 2, составляем уравнения предполагаемых полуреакций для рассматриваемых взаимодействий (в каждом из них окислителем Ох является вода):
Red (?): Ca 2ē Ca2+ |
= 2,87 B |
Red (?): Al + 3H2O 3ē Al(OH)3 + 3H+ |
= 1,89 B |
Red (?): 2Ag + H2O 2ē Ag2O + 2H+ |
= +0,76 B |
Ox (?): 2H+ + 2ē H2 |
= 0,41 B |
Сравнение потенциалов взятых металлов и ионов Н+ в нейтральной среде показывает, что термодинамически возможно взаимодействие воды с кальцием и
алюминием (Е = ( Ох Red) > 0), но не с серебром (Е < 0)
Са + 2H2O = Са(ОН)2 + H2 2Al + 6H2O = 2Al(ОН)3 + 3H2
Однако учитывая растворимость образующихся продуктов, заключаем, что с алюминием реакция практически не будет протекать, так как Al(ОН)3 нерастворим и поэтому тормозит реакцию на поверхности металла. Гидроксид кальция растворим в воде и переходит в раствор, что обеспечивает постоянный контакт между реагирующими веществами.
Обобщая рассмотренный пример, можно прийти к выводу, что с водой
взаимодействуют металлы, имеющие < 0,41 В, причем гидроиды этих металлов должны быть растворимы в воде. Этим двум условиям удовлетворяют щелочные, щелочно-земельные и некоторые другие металлы, например, лантан и таллий.
Пример 2. Почему алюминий растворяется в растворе щелочи?
Решение. В сильнощелочном растворе, в отличие от воды, окисленная форма алюминия представляет собой не нерастворимый гидроксид Al(ОН)3, а хорошо
растворимый гидроксоалюминат [Al(ОН)4] или [Al(ОН)6]3 . Это объясняется амфотерным характером гидроксида алюминия, т.е. способностью алюминия, в зависимости от рН, находиться в водном растворе как в виде катионов (основных остатков), так и анионов (кислотных остатков).
Уравнения полуреакций взаимодействия с водой имеют вид
Red: Al + 4OH 3ē [Al(OH)4] |
2 |
= 2,35 В |
Ox: 2H2O + 2ē H2 + 2OH |
3 |
= 0,83 В |
и уравнение ОВР
2Al + 6H2O + 2OH 2[Al(OH)4] + 3H2
Эта реакция термодинамически возможна: E°= 0,83 ( 2,35) = +1,52 В > 0. Кроме того, она не тормозится нерастворимым продуктом и протекает с достаточной скоростью.
Таким образом, как видно из решения примеров 1 и 2, алюминий практически устойчив в воде, но не устойчив в щелочах.
В учебной литературе реакцию алюминия с водным раствором щелочи часто представляют по стадиям:
а) взаимодействие металла с водой
2Al + 6H2O = 2Al(OH)3 + 3H2
б) растворение амфотерного гидроксида щелочью
Al(OH)3 + КОН = К[Al(OH)4]
и суммарно
2Al + 6H2O + 2КОН = 2К[Al(OH)4] + 3H2
113
В такой интерпретации роль щелочи сводится к устранению с поверхности металла нерастворимого гидроксида, препятствующего дальнейшему взаимодействию металла с водой. Однако не следует думать, что на поверхности металла действительно сначала накапливается, а затем растворяется слой нерастворимого гидроксида. Фактически там сразу же образуются алюминат-ионы.
Можно заключить, что с растворами щелочей взаимодействуют (кроме металлов,
реагирующих с растворителем водой) металлы с < 0,83 В (при pН = 14), причем гидроксиды этих металлов должны быть амфотерны. Пять наиболее часто встречающихся из таких металлов указаны в табл.3.
Пример 3. Составьте уравнения реакций меди и магния с разбавленной и концентрированной серной кислотой.
Решение. В разбавленной H2SО4, как и в воде, окислителем являются катионы Н+, но их концентрация в этом случае значительно выше и поэтому можно принять, что
2H /H 2 ≈ 0,0 В. Учитывая, что потенциалы систем Cu2+/Сu и Mg2+/Mg соответственно
равны +0,34 и 2,37 B, приходим к заключению, что, с термодинамической точки зрения, с разбавленной H2SО4 из данных двух металлов может взаимодействовать только магний
Mg + H2SО4 = MgSО4 + H2
Образующийся сульфат магния растворим в воде и не накапливается на поверхности металла. Поэтому эта реакция не тормозится ее продуктами.
В концентрированной H2SО4 окислителем является S+6 в кислотном остатке. Это
довольно активный окислитель особенно, если учесть, что в концентрированной серной кислоте образуются также, другие анионы, имеющие значительно больший ОВпотенциал. Поэтому с концентрированной H2SО4 взаимодействуют даже такие малоактивные металлы, как медь, серебро и ртуть. Продуктами взаимодействия являются сульфат металла, вода и восстановленная форма окислителя, причем разная в зависимости
от активности металла: SО2 в случае малоактивного металла; S и Н2S если металл активный
SO24 + 4Н+ + 2ē SО2 + 2H2О
SO24 + 8Н+ + 6ē S + 4H2О
SO24 + 10Н+ + 8ē Н2S + 4H2О
Конечно, нет резкой границы, разделяющей активные и малоактивные металлы. К последним условно можно отнести металлы, расположенные в ряду напряжений, начиная примерно с кадмия.
Чаще всего при взаимодействии металла (особенно активного) с концентрированной H2SО4 образуется не один, а смесь нескольких продуктов
восстановления серной кислоты в разном количественном соотношении в зависимости от активности металла и концентрации кислоты. В учебных задачах требуется обычно указать преимущественный продукт восстановления.
Исходя из этого, магний как очень активный металл при взаимодействии с концентрированной серной кислотой образует в основном Н2S и серу, а медь SO2
4Mg + 5H2SО4(конц) = 4MgSО4 + Н2S + 4H2О 3Mg + 4H2SО4(конц) = 3MgSО4 + S + 4H2О Cu + 2H2SО4(конц) = CuSО4 + SO2 + 2H2О
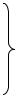
114
Контрольный вопрос. Почему свинец не растворяется в воде, плохо растворяется в соляной кислоте, практически нерастворим в разбавленной серной, но растворяется в слабой уксусной кислоте?
Пример 4. Какой азотной кислоты разбавленной или концентрированной - потребуется больше для растворения одной и той же навески серебра?
Решение. В азотной кислоте окислителем является нитрат-ион NO3 . Это сильный
окислитель с ОВ-потенциалом от 0,8 до 1,0 В. Кроме того, нитраты практически всех металлов растворимы. Поэтому азотная кислота лучший растворитель металлов.
Продуктами реакции являются нитрат металла, вода и один из продуктов восстановления азотной кислоты. Если HNО3 концентрированная, то она восстанавливается преимущественно до NО2 практически независимо от активности металла
NO3 + 2Н+ + ē NО2 + H2О
Разбавленная азотная кислота восстанавливается тем глубже (до более низких степеней окисления азота), чем активнее металл
NO3 + 4Н+ + 3ē NО + 2H2О |
|
(для малоактивных Ме) |
||
NO3 + 5Н+ + 4ē |
1 |
N2О + 5 |
H2О |
|
|
2 |
2 |
|
|
NO3 + 6Н+ + 5ē |
1 |
N2 + 3H2О |
(для активных Ме) |
|
|
2 |
|
|
|
NO3 + 10Н+ + 8ē NH4 + 3H2О
Исходя из этого, серебро, как малоактивный металл, действует с HNО3 следующим образом
Ag + 2HNО3(конц) = AgNО3 + NО2 + H2О
3Ag + 4HNО3(разб) = 3AgNО3 + NО + 2H2О
Согласно этим уравнениям, на один моль атомов серебра требуется 2 моль HNO3 концентрированной и 4/3 моль HNO3 разбавленной. Как видно, если иметь в виду число моль HNO3, то в концентрированной кислоте их требуется больше, чем в разбавленной. Но это не означает, конечно, что и по объему концентрированной кислоты потребуется больше, чем разбавленной.
При взаимодействии металлов с разбавленной азотной кислотой, как и с концентрированной серной, обычно образуются смеси различных продуктов ее восстановления. Чем активнее металл, тем больше в смеси продуктов доля соединений с более низкой степенью окисления азота, т.е. более глубоко восстановленных форм окислителя. При взаимодействии с малоактивными металлами, расположенными в ряду напряжений, начиная примерно с кадмия, основным продуктом восстановления разбавленной азотной кислоты является NО; при взаимодействии с более активными
металлами, например, цинком, марганцем, бериллием N2О или N2, а при взаимодействии
с очень активными металлами, например, с магнием аммиак NH3, который, взаимодействуя с азотной кислотой, переходит в нитрат аммония NH4NО3.
Эти рекомендации и следует использовать при составлении конкретных уравнений реакций. Например
5 |
2 |
|
3Cd +8 H N O3(разб) = 3Cd(NО3)2 |
+ 2 NO + 4H2О |
|
5 |
o |
|
5Zn + 12 H N O3(разб) = 5Zn(NО3)2 + N2 |
+ 6H2О |
|
115
5 |
-3 |
|
4Mg + 10 H N O3(разб) = 4Mg(NО3)2 |
+ N H4 NO3 |
+ 3H2О |
Контрольный вопрос. Почему при взаимодействии металлов с соляной кислотой
водород выделяется, с азотной водород не выделяется, а с серной выделяется, если кислота разбавленная, или не выделяется, если кислота концентрированная?
|
|
|
Продукты взаимодействия металлов с водой, |
|
Таблица 5 |
||||
|
|
|
|
|
|||||
|
водными растворами щелочей и кислот при комнатной температуре |
||||||||
|
|
|
|
Группы металлов |
|
|
|||
|
|
|
I |
II |
|
III |
|
IV |
V |
H2О |
|
щелочь + H2 |
* |
|
|
|
|
|
|
H2О + ОН |
|
щелочь + H2 |
для Be, Al, Zn, Sn, Pb |
|
|
|
|||
(щелочь) |
|
[Me(OH)x](x n) + H2 |
|
||||||
|
|
|
|
|
|
||||
HCl, H2SO4(разб) |
|
хлорид сульфат** + H2 |
|
|
|
|
|||
|
|
|
|
|
|||||
H2SO4(конц) |
|
|
|
сульфат + H2О + |
|
|
|
|
|
|
|
|
(H2S); S; SO2 |
|
SO2 |
|
|||
|
|
|
|
|
|
|
|
||
HNO3(конц) |
|
|
нитрат (иногда гидроксид или оксид)*** + H |
2О + |
|
||||
|
NO2 |
(N2; N2O) |
|
|
NO2 |
|
|||
|
|
|
|
|
|
||||
HNO3(разб) |
|
|
|
нитрат + H2О + |
|
|
|||
|
NH3 |
(NH4NO3) |
(NH4NO3); N2; N2O |
|
NO |
||||
|
|
|
|
||||||
Примечания: * прочерк в таблице означает отсутствие взаимодействия;
**при условии, что хлорид или сульфат металла растворим;
***некоторые металлы при взаимодействии с концентрированной
HNO3 окисляются до гидроксидов (V, Re, Tc и др.) или оксидов
(Ti).
Обобщая рассмотренный выше материал, можно условно разделить все металлы по их активности, оцениваемой по величине стандартного электродного потенциала, на
следующие пять групп: |
|
|
|
|
I группа |
|
очень активные металлы |
|
< 2,5 B |
II группа |
|
активные металлы |
2,5 |
B < < 0,7 B |
III группа |
|
малоактивные металлы |
0,7 |
B < < 0,0 B |
IV группа |
|
неактивные металлы |
0,0 B < < +1,0 B |
|
V группа |
|
благородные металлы |
+1,0 B < |
|
В таблице 5, удобной для учебных целей, показаны возможность протекания и продукты реакции металлов различных групп с водой и водными растворами кислот и щелочей.
Пример 5. Возможна ли реакция между железом и водным раствором сульфата никеля?
Решение. Применяя стандартный подход к решению этой задачи, рассмотрим величины ОВ-потенциалов. Атомы железа в этой реакции являются восстановителем. На
роль окислителя "претендуют" катионы Ni2+ и анионы SO24 . Активность окислителя Ni2+ оценивается величиной = 0,25 В. Окислительные свойства анионов SO24 в нейтральной среде, в отличие от кислой, практически не проявляются из-за

116
существенного понижения ОВ-потенциала при повышении рН и высокого перенапряжения восстановления этого иона.
Исходя из этого, в рассматриваемой реакции окислителем являются катионы Ni2+, имеющие более высокий ОВ потенциал. Уравнения полуреакций:
Ni2+ + 2ē Ni |
Oxo |
= 0,25 В |
Fe 2ē Fe2+ |
oRed |
= 0,44 B |
и суммарно
Ni2+ + Fe Ni + Fe2+
или в молекулярном виде
Fe + NiSO4 FeSO4 + Ni
Стандартная э.д.с реакции составляет
Eo oOx oRed = 0,23 ( 0,44) = +0,19 В.
Таким образом, как следует из последнего примера, металл вытесняет другие металлы, стоящие за ним в электрохимическом ряду напряжений, из растворов их солей.
Пример 6. Можно ли раствор хлорида железа(III) FeCl3 хранить в медной таре?
Решение. Если исходить из положения металлов в ряду напряжений ( oFe3 /Fe = 0,04 В, oCu 2 /Cu = +0,34 В), то реакция
3Cu + 2FeCl3 = 3CuCl2 + 2Fe
представляется термодинамически невозможной ( oOx < oRed ). Но окислитель Fe3+ может
восстановиться не только до свободного железа, но и до катиона Fe2+. Потенциал системы Fe3+/Fe2+ (+0,77 В) выше, чем у меди, и взаимодействие становится возможным, но с образованием других веществ:
Fe3+ + 1ē Fe2+ |
2 |
|
Oxo |
= +0,77 В |
|
||||
Cu 2ē Cu2+ |
1 |
|
oRed |
= +0,34 B |
|
Как видно, в медной таре раствор FeCl3 хранить нельзя в таком растворе медь неустойчива.
Пример 7. Возможна ли реакция цинка с раствором хлорида алюминия?
Решение. Казалось бы, такая реакция невозможна. Цинк не вытесняет алкминий из его соли, как следует из положения этих металлов в ряду напряжений ( oAl3 /Al = 1,66 В,
oZn 2 /Zn = 0,76 В).
Но все же цинк в растворе А1С13 растворяется. Дело в том, что он взаимодействует не с катионами А13+, а с соляной кислотой продуктом гидролиза хлорида алюминия
А1С13 + Н2О А1ОНС12 + НС1 Цинк взаимодействует по уравнению
Zn + 2HCl = ZnCl2 + Н2
Суммарное уравнение процесса растворения цинка
Zn + 2А1С13 + 2Н2О 2А1ОНС12 + ZnCl2 + Н2
(Может ли в результате такого взаимодействия образоваться гидроксид алюминия? Напишите соответствующие уравнения реакций.)
117
Контрольный вопрос. Объясните, почему алюминий взаимодействует с раствором соды Na2CО3? Составьте уравнения протекающих реакций.
Пример 8. Как зависит устойчивость кадмия и цинка в водных растворах от величины рН?
Решение. В кислой среде (рН < 7) оба металла находятся в водном растворе в виде катионов Сd2+ и Zn2+. Уравнения полуреакций их взаимодействий имеют вид
Cd 2ē Cd2+ |
= 0,40 B |
Zn 2ē Zn2+ |
= 0,76 B |
2H+ + 2ē H2 |
= 0,0 B |
Как видно, и для кадмия, и для цинка термодинамически возможно взаимодействие с ионами Н+
Ме + 2H+ Ме2+ + H2
Скорость этой гетерогенной реакции пропорциональна концентрации катионов водорода, а она тем ниже, чем больше рН раствора. Поэтому в кислой среде оба металла неустойчивы, но с ростом рН скорость их растворения будет уменьшаться.
В области рН, близкой к 7, окисленной формой рассматриваемых металлов являются гидроксиды Cd(OH)2 и Zn(OH)2. С учетом этого уравнения полуреакций принимают вид:
Cd + 2Н2О 2ē Cd(ОН)2 |
= 0,41 B |
Zn + 2Н2О 2ē Zn(ОН)2 |
= 0,81 B |
2H+ + 2ē H2 |
= 0,41 B |
Как видно, потенциалы и металлов, и воды понизились в нейтральной среде по сравнению с кислой. Обе реакции термодинамически возможны, но их протекание тормозится вследствие образования на поверхности металлов нерастворимых продуктов. Поэтому и цинк, и кадмий практически не взаимодействуют со средой при рН ≈ 7.
В щелочных растворах (рН > 7) окисленной формой кадмия является, как и в нейтральной среде, гидроксид Cd(ОН)2. Последний не растворяется в воде и не взаимодействует с раствором щелочи. Поэтому нерастворимый продукт обеспечивает устойчивость кадмия как в воде, так и в растворе щелочи.
Этого нельзя сказать о цинке, гидроксид которого амфотерен. Поэтому окисленная форма цинка в щелочном растворе представляет собой растворимый гидроксокомплекс
[Zn(ОН)4]2 . С учетом этого уравнения полуреакций имеют вид
Zn + 4ОН 2ē [Zn(ОН)4]2 |
= 1,22 B |
2Н2О + 4ē H2 + 2ОН |
= 0,83 B |
Как видно, потенциал цинка в щелочной среде, по сравнению с нейтральной и, тем более, кислой, резко понижается и, хотя потенциал окислителя тоже понижается, реакция между цинком и раствором щелочи термодинамически возможна. Реакция проходит до конца, так как образующийся на поверхности цинка растворимый гидроксокомплекс щелочного металла не препятствует ее протеканию.
Суммарное уравнение реакции имеет вид:
Zn + 2Н2О + 2ОН [Zn(ОН)4]2 + H2
Скорость этого процесса, как видно из уравнения, пропорциональна концентрации
ионов ОН в растворе. Поэтому устойчивость цинка в сильнощелочных растворах понижается с увеличением рН.
118
Таким образом, устойчивость кадмия в водных растворах повышается с ростом рН, достигая предельного значения в области рН ≈ 7, а устойчивость цинка сначала
повышается с ростом рН до рН ≈ 7, а при pН > 7 понижается (рис.1.).
v |
v |
Cd |
Zn |
0 |
7 |
pH |
0 |
7 |
pH |
Рис.1. Зависимость скорости растворения кадмия и цинка от рН водного раствора
Пример 9. Почему золото не растворяется в азотной и соляной кислотах, но растворяется в царской водке?
Решение. Царская водка это смесь концентрированных азотной и соляной кислот в соотношении 1:3. В каждом из этих реагентов, взятых в отдельности, золото устойчиво:
потенциал азотной кислоты (+0,8 1,2 В) и, тем более, соляной ( o2H /H 2 = 0,0 В) не достаточен для окисления золота.
В присутствии соляной кислоты катионы Аu3+ образуют комплексный анион [AuCl4] . За счет этого ОВ-потенциал золота резко понижается:
Au + 4Cl 3ē [AuCl4] |
oRed = +1,00 B |
и становится близким к потенциалу окислителя NO3 |
|
NO3 + 4H+ + 3ē NO + 2H2O |
Oxo = +0,96 B |
Хотя стандартная эдс суммарной реакции |
|
Au + 4HCl + HNO3 = H[AuCl4] + NO + 2H2O
несколько меньше нуля:
E = 0,96 1,00 = 0,04 B
в реальных условиях (высокая концентрация кислоты) ОВ-потенциал окислителя повышается и растворение золота протекает с достаточной скоростью.
Как видно, в этом случае соляная кислота играет роль не окислителя, а поставщика
лигандов (Cl ), образующих с катионом Аu3+ прочный комплекс. В результате этого восстановительная активность золота повышается и становится достаточной для реакции
с сильным окислителем азотной кислотой.
Аналогично в царской водке растворяются и некоторые другие благородные металлы, например, платина.
Следует обратить внимание на то, что некоторые металлы "не вписываются" в рассмотренные выше общие закономерности. Так, активные металлы алюминий и хром практически не взаимодействуют с азотной кислотой, особенно концентрированной. Железо устойчиво при обычных условиях в концентрированной серной кислоте. В этих реагентах данные металлы пассивируются, что обусловлено образованием на их поверхности устойчивых защитных пленок.
Знание общих химических, свойств металлов необходимо для решения важных технических задач: выбора конструкционных материалов, материалов для ремонта, защиты от коррозии, определения совместимости материалов и продуктов и т.д.

119
21. КОРРОЗИЯ МЕТАЛЛОВ
Основные понятия: коррозия, коррозионная среда, механизмы коррозии, коррозия химическая и электрохимическая, коррозионный гальванический элемент, катодный, анодный и смешанный контроль коррозии, перенапряжение выделения продуктов коррозии, деполяризаторы, пассивация металлов, анодные и катодные покрытия,
электрохимическая защита протекторная и катодная.
Перечень умений: классифицировать процессы коррозии по их видам, записывать электронные уравнения электродных процессов и суммарное уравнение коррозии, составлять схему коррозионного гальванического элемента, составлять схемы защиты металла от коррозии.
Коррозия самопроизвольное разрушение металлов в результате их окислительновосстановительного взаимодействия с окружающей средой.
В процессах коррозии восстановителем выступает металл, а окислителем вещества из окружающей среды. Коррозия является гетерогенным процессом, протекающем на поверхности металла.
Процессы коррозии классифицируют по различным признакам:
а) по геометрической картине разрушения металла: равномерная, пятнистая, точечная, питтинг, межкристаллитная, растрескивающая;
б) по внешним условиям протекания: коррозия в сухих газах, атмосферная, почвенная (грунтовая), коррозия под действием блуждающих токов;
в) по физико-химическому механизму: химическая и электрохимическая.
Химическая коррозия процесс, в котором полуреакции окисления металла и восстановления окислителя происходят одновременно (при перескоке каждого отдельного электрона) и пространственно не разделены. Схематически это можно показать
ne
Me + Ox Me 

 Ox MeOx
Ox MeOx
следующим образом Коррозия такого типа протекает, например, в сухих газах, в которых наиболее
распространенными агрессивными агентами являются O2, Cl2, SO2 и SO3, NO и NO2, H2S и другие. Движущей силой процесса коррозии как и любой химической реакции при
постоянных р и Т является уменьшение энергии Гиббса: G < 0. Так, энергии Гиббса образования оксидов большинства металлов значительно меньше нуля. Это означает, что металлы термодинамически неустойчивы в кислородсодержащих средах и коррозия с образованием оксидов протекает самопроизвольно.
Пример 1. Какой процесс вероятнее всего будет протекать npi химической коррозии серебра, если в коррозионной среде одновременно присутствуют кислород и сероводород?
Решение. Прежде всего, запишем уравнения возможных взаимодействий серебра с окислителями и рассчитаем для этих реакций изменения энергии Гиббса. Взаимодействие с кислородом
2Ag(к) + 1/2O2(г) = Ag2O(к)G = G (Ag2O) = 11,20 кДж
Взаимодействие серебра с сероводородом
120
2Ag(к) + Н2S(г) = Ag2S(к) + Н2(г)
G = G (Ag2S) G (Н2S) = 40,42 ( 33,80) = 6,62 кДж
Кроме того, возможно и взаимодействие одновременно с кислородом и сероводородом по реакции
2Ag(к) + 1/2O2(г) + Н2S(г) = Ag2S(к) + Н2Oг)
для которой
G = G (Ag2S) + G (Н2О) G (Н2S) = 40,42 228,8 + 33,80 = 235,42 кДж Последний процесс характеризуется наибольшей убылью G° из трех
рассмотренных, и потому именно он является термодинамически наиболее вероятным. Скорость химической коррозии зависит от температуры, концентрации окислителя
и скорости его диффузии к поверхности металла. Последний фактор часто является определяющим, хотя в начальный момент при заданной температуре скорость может определяться концентрацией окислителя. В результате взаимодействия металлов со многими агрессивными агентами на поверхности образуются пленки продуктов реакции (оксиды, сульфиды и т.д.), плотность и толщина которых лимитирует диффузию окислителей к поверхности металла, а следовательно, и скорость коррозии в целом. Именно этим обусловлена высокая устойчивость на воздухе таких металлов как Al, Ti, Ni, Co, Cr и многих других. С другой стороны, в случае железа оксидные пленки рыхлые и процесс его коррозии продолжается до полного разрушения металла.
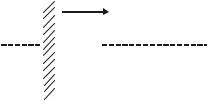
Электрохимическая коррозия отличается тем, что при ее протекании
Ме + Ох Ме+n + Red полуреакции окисления металла и восстановления окислителя
Ме nē Ме+n
Ох + nē Red
пространственно разделены. Электрохимическая коррозия протекает в результате работы множества коррозионных микрогальванических элементов, возникающих на поверхности металла, соприкасающейся с электролитом, вследствие разного рода неоднородностей. Анодный и катодный процессы идут на различных участках поверхности металла, а электроны переходят по металлу от анодных участков к катодным.
Анодный |
|
Металл |
Электролит |
Анодный |
||
|
|
Me |
Men+ |
|||
участок |
|
|
||||
|
|
|||||
Перенос |
|
|
|
|
|
процесс |
|
e |
|
|
|||
n |
|
|
||||
электронов |
|
|
|
|
+ Ox Red |
Катодный |
|
|
|
|
|||
|
|
|
|
|
||
Катодный |
|
|
|
|
процесс |
|
|
|
|
|
|||
участок |
|
|
|
|
|
|
|
|
|
|
|
|
|
Основными причинами неоднородности металлических изделий и появления анодных и катодных участков являются:
контакт деталей, изготовленных из различных металлов; внутренняя химическая неоднородность металлов и сплавов, проявляющаяся в
наличии в них кристаллитов (зерен) разного состава, выделений различных фаз на границах кристаллитов и т.п.;
неоднородность отдельных кристаллитов по составу;
неравномерная деформация деталей и конструкций;
неоднородность коррозионной среды;
температурные градиенты;
электрические, магнитные поля и т.д.
