
ЛР 4 кор
.pdf
11
аеробних мікроорганізмів відносяться гриби і багато бактерій, зокрема, оцтовокислі.
За характером живлення всі мікроорганізми поділяють на 2 групи (табл. 1.). Автотрофи (autos - сам, trophe - живлення) здатні синтезувати всі необхідні їм органічні сполуки з CO2 як єдиного джерела вуглецю. Гетеротрофи (heteros -інший) - мікроорганізми, джерелом вуглецю для яких є органічні сполуки. Вони здатні споживати будь-які прості й складні вуглецеві сполуки - цукри, амінокислоти, багатоатомні спирти, парафіни та ін..
Таблиця 1
Типи метаболізму бактерій
Тип живлення |
Джерела енергії, H/e-, вуглецю |
|
|
|
|
Фотолітотрофи – |
Енергія світла |
|
автотрофи |
Неорганічні донориH/e- |
|
CO2 джереловуглецю |
||
|
||
|
|
|
Фотоорганотрофи |
Енергія світла, |
|
Органічні донори H/e- |
||
– гетеротрофи |
||
Органічні джерела вуглецю |
||
|
||
Хемолітотрофи |
Хімічні джерела енергії(неорганічні) |
|
– |
Неорганічні донори H/e- |
|
автотрофи |
CO2 джерело вуглецю |
Хемоорганотрофи Хімічні джерела енергії(органічні)
–гетеротрофи Органічні донори H/e- Органічні джерела вуглецю
Приклади
мікроорганізмів
Водорослі
сульфобактерії
ціанобактерії
Пурпурні і зелені бактерії
Нітрифікуючі бактерії, залізобактерії
Найпростіші
Гриби
Більшість
бактерій
Ступінь вираження гетеротрофії у бактерій може бути найрізноманітніша. Найвищу гетеротрофність мають прокаріотичні організми, які здатні жити тільки всередині живих клітин (рикетсії, хламідії). Їх метаболічні шляхи повністю залежать від організму хазяїна. Такі мікрорганізми називають облігатними (суворими) паразитами.
Однак багато мікробів можна вирощувати на штучних живильних середовищах, до складу яких входять білки, пептиди, вітаміни, фрегменти нуклеїнових кислот. Такі форми бактерій, здатних рости поза клітинами людини або тварин при створенні необхідних умов, називають факультативними паразитами.
Більшість бактерій, що зустрічаються на земній кулі (понад 99 %), належать до сапрофітів. Вони безпосередньо від живих організмів не залежать і живляться за рахунок мертвих органічних залишків.
12
Мікроорганізмам необхідний азот для синтезу азотомістких сполук. Джерела його можуть бути різноманітними. Одні бактерії здатні засвоювати молекулярний азот повітря (бульбочкові мікроби), інші використовують різноманітні субстрати. Бактерії, як правило, засвоюють азот у відновленій формі - це солі амонію, сечовини, органічні сполуки (амінокислоти, пептиди). Однак окислені форми азотистих сполук (нітрати) також можуть бути засвоєні мікробами. У клітині вони відновлюються до аміаку за допомогою ферментів нітратредуктази й нітритредуктази.
Дикі штами бактерій здатні синтезувати всі необхідні їм речовини з обмеженого числа органічних сполук, наприклад, глюкози та солей амонію. Вони називаються прототрофами. Окремі мікроорганізми (варіанти прототрофів) втратили здатність до синтезу деяких необхідних їм ростових факторів, отже не можуть рости на мінімальних живильних середовищах. Їх називають ауксотрофними організмами.
Джерела енергії та донори електронів. Залежно від джерела енергії,
що засвоюють мікробні клітини, їх поділяють на фототрофи і хемотрофи. Фототрофні бактерії здатні використовувати енергію сонячного світла. Їх інакше називають фотосинтезуючими бактеріями. Патогенних
для людини серед них немає. Інші прокаріоти, |
які одержують енергію за |
|||
рахунок |
окисно-відновних |
реакцій |
в |
субстратах, |
називаються хемотрофами.
Для здійснення різноманітних реакцій клітині необхідні електрони. Речовини, які в процесах біохімічних перетворень віддають електрони, називаються донорами. Молекули, які одержують електрони, називаються акцепторами.
Мікроорганізми, для яких джерелом електронів є неорганічні сполуки типу Н2, Н2S, NH3+ , Fe +2 та інші, називаються літотрофами (litos - камінь). Інші бактерії, для яких донором електронів виступають органічні речовини, називаються органотрофами.
Залежно від способу одержання енергії, донора електронів та джерела вуглецю для засвоєння можна виділити 8 основних типів прокаріотичних організмів: фотолітоавтотрофи й фотолітогетеротрофи, фотоорганоавтотрофи й фотоорганогетеротрофи, хемолітоавтотрофи й хемолітогетеротрофи, хемоорганоавтотрофи й хемоорганогетеротрофи.
Однак опису фізіологічних процесів буває недостатньо, щоб зробити остаточний висновок про вид виділених мікробів. Тому додатково вивчають біохімічні властивості бактерій.
Біохімічні методи ідентифікації. Найчастіше досліджують цукролітичні, протеолітичні, пептолітичні, гемолітичні властивості. Насамперед, утворення ферментів: декарбоксилаз, оксидаз, каталаз,
13
плазмокоагулаз, ДНК-аз, а також фібринолізину. Ідентифікаційне значення має здатність до перетворення нітратів у нітрити. Для цього застосовують спеціальні живильні середовища, які засівають мікроорганізмами (строкатий ряд Гісса, МПБ, згорнута сироватка, молоко та ін.). Визначення виду збудника за його біохімічними властивостями називається біохімічною ідентифікацією. Біохімічна активність мікробів надзвичайно різноманітна. Вона залежить від характеру і кількості тих ферментів, які мікробна клітина продукує і виділяє в зовнішнє середовище.
Для дослідження здатності бактерій розщеплювати білки (протеолітичні властивості) використовують молоко або середовище з желатином. Протеоліз у молоці виражається розчиненням згустка казеїну, який утворено бактеріями, що згортають молоко. При зростанні в молоці мікроби, що виділяють протеолітичні ферменти, через кілька днів викликають пептонізацію молока. Пептонізація супроводжується розчиненням згустку казеїну під дією ферменту казеінази, випаданням осаду і проявленням молочної сироватки.
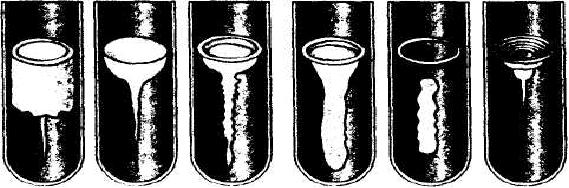
Середовища із желатином готують на м’ясній воді, додаючи 1 % пептону, 0,5 % хлориду натрію та 10-20 % желатину. Посів роблять уколом. Мікроби, що володіють протеолітичними властивостями, розріджують желатин (рис.7). Більшість протеолітичних мікроорганізмів дають різний характер розрідження: пошарове (що йде рівно, зверху вниз), воронкоподібне, кратероподібне, ріповидне, в формі панчохи.
Рис. Ідентифікація за типом розрідження желатинового стовпчику
Протеолітичні властивості мікробів проявляються виділенням в зовнішнє середовище протеолітичних ферментів, які розщеплюють білки до проміжних продуктів (пептони, поліпептиди, амінокислоти) або до продуктів кінцевого розпаду (індол, сірководень, аміак та ін.).
Індолоутворення визначають за здатністю мікроба розщеплювати амінокислоту триптофан під дією ферменту тріптофанази. Індол виявляють за допомогою реактиву Ерліха. До бульонной культурі додають
14
1 см3 сірчаного ефіру, після чого пробірку добре струшують. Потім дають ефіру відстоятися і по стінці обережно нашаровуються спочатку 1 см3 першого реактиву Ерліха. Реактив Ерліха готують завчасно (1 г парадиметиламидобензальдегиду розчиняють в 95 см3 спирту і 20 см3 HCI, щільність 1,19). Потім додають 1 см3 другого реактиву Ерліха (водний насичений розчин надсірчанокислого калію). За наявності індолу (позитивна реакція) на кордоні нашарованих рідин з'являється кільце малинового кольору.
Можна індол виявляти шляхом використання індикаторних папірців. Фільтрувальний папір просочують першим реактивом Ерліха, потім її висушують на повітрі і нарізають на тонкі смужки. Первинний колір просочених реактивом Ерліха папірців жовтий. Зберігають індикаторні папірці у стерильній банці з притертою пробкою. Для визначення індолу роблять посів в пробірку з МПБ, під пробку вставляють індикаторну папірець (нижній кінець папірці не повинен торкатися до середовища) і культивують при 37°С протягом 24 - 48 год. Якщо культура бактерій розкладає білок з утворенням індолу, нижня частина: індикаторного папірця забарвлюється в малиновий колір.
Для виявлення сірководню робиться посів уколом (всередину стовпчика) по стінці в агар з ацетатом свинцю (МПА з 5% пептону і 0,25 % ацетату свинцю) або в пробірку з МПБ, в яку під пробку над середовищем поміщається смужка стерильного фільтрувального паперу, просоченого розчином ацетату свинцю. Якщо досліджувана культура при розкладанні білка виділяє сірководень, то з'являється темно-буре фарбування (почорніння) за місцем уколу в щільному середовищі або на фільтрувальному папірці (у МПБ).
Визначення аміаку починають з того, що під пробку з бульонною культурою поміщають рожеву лакмусовий індикаторний папірець, культуру термостатують при 37°С протягом 1-3 діб. За наявності аміаку лакмусовий індикаторний папірець набуває синього забарвлення.
Для визначення здатності мікроорганізмів розщеплювати цукор використовують спеціальні рідкі, напіврідкі і щільні живильні середовища з відповідними вуглеводами і індикатором.
Цукролітична здатність мікробів визначається за ферментативним розщепленням багатоатомних спиртів і деяких вуглеводів, іменованих цукрами, на альдегіди, кислоти, газоподібні продукти (вуглекислий газ СО , метан СН4 і водень Н2).
Набір рідких або напіврідких середовищ з вуглеводами і індикатором називають «строкатим» рядом. Назва «строкатий» ряд обумовлено тим, що під дією ферментів зростаючого мікроба використані цукри розкладаються до продуктів проміжного розпаду (кислота). У результаті накопичення кислоти знижується pH середовища, змінюється
15
колір індикатора і середовища. За відсутності у мікробів якого-небудь ферменту вуглеводи не розщеплюються, pH залишається незмінним, індикатор залишається в знебарвленій формі, колір середовища не змінюється.
Для визначення цукролітичної здатності бактерій використовують найчастіше середовища Гісса з індикатором. Вони складаються з пептонної води, вуглеводів і індикатора (кислий фуксин, знебарвлений розчином їдкого лугу).
Якщо досліджувана культура мікроба під дією ферменту розкладає вуглевод з утворенням кислоти, то відбувається відновлення кольору індикатора і фарбування середовища (в рожево-малиновий колір з індикатором Андреде або в блакитний з індикатором «ВР»). Кислота вступає в реакцію з лугом або розоловой кислотою і нейтралізує їх.
Якщо розщеплення вуглеводу йде до кінцевих npoдуктов, тобто до СО2 і води, то наявність газу визначається в газовках (якщо середовища рідкі) або бульбашки газу виявляють в товщі полурідкого середовища.
Посіви на вуглеводні середовища (з глюкозою, лактозою, сахарозою, манітом, дульцітом та ін.) проводять розпрямленою у вигляді стрижня бактеріологічною петлею и уколом по центру середовища.
Отже, загальний процес ідентифікації бактерій за видовою приналежністю проводять у декілька етапів:
1)визначення морфологічних особливостей (колоній і окремих клітин);
2)оцінка фізіологічних особливостей (за відношенням до кисню та за типами харчування);
3)ідентифікація за продуктами ферментативної активності (розщеплення протеїнів, вуглеводів).
Після визначення особливостей МКО остаточну ідентифікацію виду проводять за допомогою «Визначника мікробів» Р. А. Ціона або «Короткого визначника бактерій Берги».
Молекулярно-генетичні методи. Для виявлення та ідентифікації бактерій, вірусів, грибів і найпростіших останнім часом почали широко використовувати молекулярно-генетичні методи.
Реакція гібридизації ДНК і РНК (реакція генних зондів). Послідовність нуклеотидів ДНК і РНК є унікальною для геномів всіх мікроорганізмів. Будь-яку ділянку нуклеїнової кислоти можна визначити за допомогою комплементарної копії ДНК чи РНК, міченої ферментом або радіоактивною міткою (ДНК- і РНК-зонди). Такі зонди отримані для більшості патогенних бактерій і вірусів. За їх допомогою проводять ідентифікацію ДНК або РНК збудників бактеріальних і вірусних інфекцій у клінічному матеріалі. Реакція молекулярної гібридизації є дуже чутливою і високоспецифічною. Вона дає змогу виявляти ДНК або РНК в дуже малих кількостях (1-10 пг).
16
Методика реакції генних зондів зводиться до того, що виділені з патологічного матеріалу ДНК або РНК збудників денатурують і наносять на спеціальні мембрани з нітроцелюлози.
Після чого вносять ДНКабо РНК-зонди, витримують певний час, роблять багаторазову промивку, щоб видалити реагенти, що не прореагували. Якщо використовували зонди з радіоактивною міткою, результат визначають за допомогою -лічильника. У випадку, коли зонд мічений ферментом (наприклад, пероксидазою), то до такого зонда додають субстрат (наприклад, ортофенілдіамін). Ферментація субстрату призводить до зміни кольору, який можна спостерігати неозброєним оком.
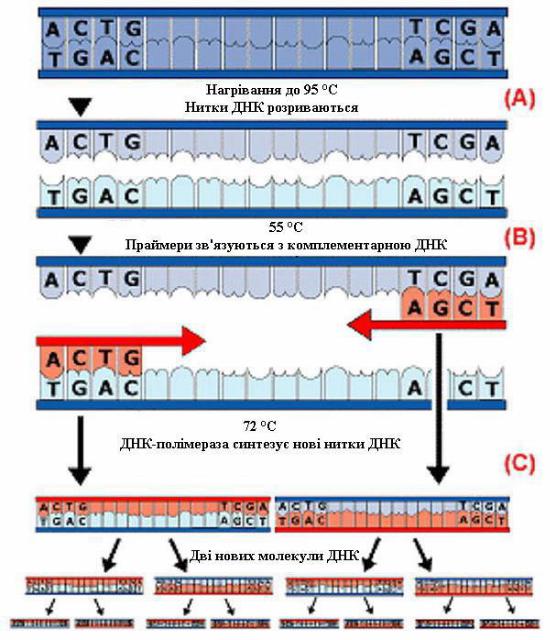
Рис. 8. Схема полімеразно-ланцюгової реакції (ПЛР)
17
Полімеразна ланцюгова реакція (ПЛР) (рис.8) – один із найновіших методів виявлення та ідентифікації бактерій і вірусів у досліджуваних матеріалах. Принцип реакції базується на багаточисленному копіюванні (селективній ампліфікації) досліджуваної ДНК ферментом ДНКполімеразою. Утворені копії ДНК ідентифікують за допомогою методу електрофорезу.
Реакцію проводять в три етапи. На першому етапі при температурі 95 °С проходить денатурація двониткової молекули ДНК, її розплетення і розходження ниток.
На другому етапі (ренатурація) відбувається гібридизація праймерів, тобто утворення дволанцюгових комплексів праймер-матриці, які необхідні для ініціювання синтезу ДНК. Температура суміші при цьому знижується до 55 °С.
На етапі синтезу (75 °С) проходить подовження комплементарних ниток ДНК за допомогою ферменту ДНК-полімерази. Проводять 15-35 циклів синтезу.
Багаторазове повторення приводить до збагачення ДНК у досліджуваному матеріалі.
Метод ПЛР дуже чутливий. Його використовують для виявлення будьякого інфекційного агента, якщо відома нуклеотидна послідовність гена (або його фрагмента), специфічного виключно до даного збудника. Доцільно використовувати ПЛР у тих випадках, коли бактерії чи віруси мають високу мінливість і знаходяться у досліджуваному матеріалі в малій кількості (навіть одна молекула геномної ДНК).
Зараз ПЛР належить до високоефективного молекулярно-генетичного - методу, який доступний багатьом лабораторіям. Тривалість дослідження становить 2-3 години. Особливо доцільно використовувати його при визначенні та ідентифікації збудників туберкульозу, сифілісу, гонореї, мікоплази, вірусів СНІДу, герпесів, гепатитів, ротата ентеровірусів.
ПРАВИЛА ПОСІВУ МІКРООРГАНІЗМІВ
Щоб не забруднити чисті культури супутніми МКО з повітря або з поверхні робочих місць впродовж виділення бактерій зі зразків, що вивчаються: м’яса і м’ясних продуктів, молока та молочних продуктів, води та ін., необхідно суворо дотримуватися певних правил.
Посів проводять бактеріологічною петлею (голкою) або пастерівською піпеткою. Техніка посіву залежить від консистенції живильного середовища.
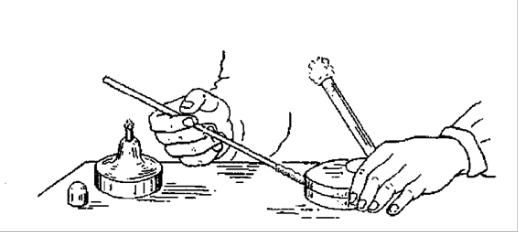
Запалюють спиртівку або газовий пальник. У ліву руку беруть пробірки (чашки Петрі і т.і.): першу - з культурою бактерій, що має бути розмножена і другу - зі стерильним мясопептонним скошеним агаром.
18
Тримають пробірки в похилому положенні великим і вказівним пальцями. Отвори пробірок мають бути звернені у бік полум'я пальника (поверхню агару зверху).
У правій руці тримають бактеріологічну петлю (голку, піпетку), за необхідності, прожарюють її над полум’ям пальника до червоного кольору, потім швидко проводять через полум’я 2-3 рази петлетримач. Мізинцем і безіменним пальцями правої руки беруть одночасно зовнішні кінці ватно-марлевих пробок двох пробірок, виймають їх близько полум’я з пробірок, обпалюють краї обох пробірок, стежачи за тим, щоб частина пробок, що входять в пробірки, ні до чого не торкалася. У відкриту пробірку з культурою бактерій або посівним матеріалом вводять бактеріологічну петлю, охолоджують її доторканням до внутрішньої стінки пробірки, а потім обережно знімають (відокремлюють) частину мікробного нальоту або іншого матеріалу і швидко переносять його в іншу пробірку (чашку Петрі) зі свіжим стерильним живильним середовищем (рис.1, 5).
Петлю опускають до дна пробірки в конденсаційну рідину скошеного мясопептонного агару або злегка торкаються поверхні живильного середовища у чашці Петрі та роблять посів культури по поверхні агару штрихом, тобто зигзагоподібними рухами петлі вільно ковзаючи по поверхні середовища, не травмуючи її.
Рис. 5. Посів з пробірки на чашку Петрі зі щільним поживним середовищем.
Потім виймають бактеріологічну петлю, обпалюють края пробірок, закривають їх пробками, проводячи їх швидко через полум’я. Прожарюють петлю над полум’ям. На пробірці маркером надписують дату посіву, інші необхідні дані (одночасно реєструють їх в зошиті чи журналі).
Посів можна проводити уколом по центру середовища або уколом по стінці. Посів уколом по центру проводять бактеріологічною петлею шляхом проколювання стовпчика агару або желатину в середній частині, стежачи за тим, щоб голка ніде не підходила до стінок пробірки. Не
19
доводячи на сантиметр до дна пробірки, голку витягують, обпалюють на полум’ї спиртівки до червоного розжарювання (вбивають залишки мікробів), після чого край пробірки ще раз обпалюють на вогні, проводять через полум'я пробку і закривають пробірку. Край пробірки під час посіву тримають близько полум’я. Бактеріологічну голку поміщають в штатив, а пробірку, зазначивши на ній дату посіву і місце, звідки було взято матеріал, поміщають у термостат. Для посіву уколом по стінці матеріал вводять голкою біля стінки в МПА, що застиг стовпчиком.
Коли проводять посіви у рідке середовище (МПБ, молоко), бактеріологічну петлю з набраним на неї матеріалом вносять у пробірку з дотриманням усіх пересторог, описаних вище. Матеріал ретельно перемішують у пробірці, весь час змиваючи його середовищем. При посіві пастерівської піпеткою поверхню її обпалюють у полум’ї спиртівки, охолоджують, віднісши в бік від вогню, потім, обломивши стерильним пінцетом запаяний кінець, набирають у неї матеріал, швидко вносять у пробірку і проводять посів так само, як це роблять петлею, дотримуючись правил стерильності. Краще користуватися піпетками, загорнутими у папір і простеризованими в автоклаві. Після використання піпеток їх поміщають у посудину з дезинфікуючою рідиною.
Посіви з пробірками (чашками) ставлять у термостат і культивують протягом 16-24 год за оптимальної для мікроорганізмів температурі.
7. Практичні завдання
1)Механічне розділення мікроорганізмів (метод Коха).
Готують суспензії (змиви) мікроорганізмів за варіантом зразку
(продукти харчування, грунт і т.і.)
Проводять послідовні розведення отриманої суспензії мікроорганізмів до 108.
Методом Дригальського висівають на підготовлене середовище по 1 мл із варіантів розведень 104, 106, 108. Підписують чашки та розташовують їх у термостаті за оптимальної температури культивування.
Занотовують у зошит: характеристику зразку, послідовність дій, кількість посівів за варіантами розведення, склад поживного середовища.
2) Оцінка культуральних властивостей
Описують культуральні властивості ізольованої колонії, що виросла на чашці Петрі. Характер зростання колонії вивчають візуально і при малому збільшенні об'єктива мікроскопа. Дослідження ведуть при малому збільшенні зі звуженою діафрагмою і кілька опущеним конденсором. Форму колонії замальовують в зошиті.
Описують характер росту на твердому живильному середовищі і готують з культури препарати «роздавлена» або «висяча крапля» для визначення рухливості бактерій.
20
З колонії готують мазки, фарбують за Грамом і мікроскопують під імерсійним об'єктивом (збільшення х100 (90)). Визначають форму клітин, їх розташування, наявність спор і встановлюють здатність сприймати барвники (грампозитивні-фіолетові, грамнегативні-червоні). Форму клітин замальовують у зошиті.
За результати випробувань формулюють висновки.
8. Завдання до виконання лабораторної роботи
1.Записати у робочий зошит тему та мету роботи.
2.Провести практичну частину роботи.
3.Написати теоретичний звіт.
4.Зробити висновки про виконану роботу.
9. Література
1.Пирог Т.П. Загальна мікробіологія / Т. П. Пирог. - К.: НУХТ, 2004. - 471
с.
2.Микробиология: практикум / [Бранцевич Л.Г., Лысенко Л.Н., Овод В.В.,
Гурбик А.В.]- К.: Высш. шк., 1987. - 200 с.
3.Теппер Е.З. Практикум по микробиологии / Е.З. Теппер, В.К. Шильников, Г.И. Переверзев. - М.: Из-во «Колос», 1972. - 199 с.
