
IgnatovSG
.pdf11
5. Токсичность наноматериалов может оцениваться с помощью микробиологических приемов.
СОДЕРЖАНИЕ РАБОТЫ
Объекты и методы исследований
В работе использовали бактерии Escherichia coli, Micrococcus luteus, Salmonella typhimurium, Salmonella enteritidis, Acetobacter aceti, Mycobacterium tuberculosis, Bacillus brevis, Bacillus subtilis, Bacillus thuringiensis, Pseudomonas aeruginosa, Yersinia pseudotuberculosis, Streptomyces avermitilis и ас-
комицет Neurospora crassa. Для индукции специфических ферментативных активностей микроорганизмы культивировали на минимальных средах с различными источниками углерода. Мицелий аскомицета выращивали на модифицированной среде Фогеля, содержащей минеральные соли, сахарозу и биотин.
Выделение мембран проводили путем осмотического лизиса сферопластов (Игнатов и др. 1981), полученных после обработки клеток лизоцимом с последующей промывкой центрифугированием при охлаждении. Путем субстратной индукции получали цитоплазматические мембраны (ЦПМ) с заранее заданными ферментативными свойствами. Наличие нативной иммобилизации ферментативных ансамблей в липидном бислое обеспечивает более стабильную и чувствительную систему анализа. Поверхностный заряд ЦПМ изменяли, используя положительно заряженные цетилтриаммоний бромид и полилизин и отрицательно заряженные додецилсульфат натрия и полиаспарагиновую кислоту.
Для проведения криоиммобилизации клетки и мембраны смешивали с заранее приготовленным 10 %-ным раствором поливинилового спирта. Суспензию раскапывали по пластиковой поверхности и помещали в холодильник для формирования криогеля. После 24 ч экспозиции при низкой температуре гранулы иммобилизованных клеток и мембран оттаивали, промывали несколько раз фосфатным буфером (рН 7,4) и хранили в нем. Приготовлен-
12
ные заранее навески иммобилизованных биокатализаторов использовали для детекции соответствующих активностей.
Для размножения и титрования фагов использовали полужидкий L-агар с 0,4 %-ной глюкозой. Для экспериментов использовали заранее размноженные фаги в концентрации – 1010–1011 частиц/мл.
Исследования антиоксидантной активности соединений проводили в электрохимической ячейке, имеющей трехэлектродную конфигурацию. Ячейка объемом 1мл включала Ag/AgCl/ 1M KCl электрод сравнения и Pt обратный (рабочий) электрод. Циклическую вольтаметрию осуществляли с использованием системы "Автолаб". Для измерения антиоксидантной активности модифицированный золотой электрод поляризовали при +150мВ по отношению к Ag/AgCl. В качестве потенциостата использовали «Биоанализа-
тор» фирмы Kreijci Engineering (Чехия).
При определении лактата для приготовления чувствительной к кислороду волоконно-оптической системы готовили тонкую силановую пленку с чувствительным к кислороду флуоресцентным красителем, рутений дифенилфенантролином, которую механически крепили на конце оптического волокна. Пленку готовили путем приготовления фотополимеризующего раствора, содержащего мономер силоксана, раствора красителя и индуктора на поверхности чашки. При помощи УФ лампы индуцировали полимеризацию раствора и механическое включение красителя в полимер. Полимерную пленку помещали в раствор дистиллированной воды и хранили в темноте перед использованием. На поверхность этого чувствительного к кислороду слоя помещали препарат ЦПМ, адсорбированный на целлюлозном диске. Всю конструкцию крепили на оптическое волокно нейлоновой сеточкой с помощью резинового кольца.
АСМ-измерения проводили на атомно-силовом микроскопе Nanoscope IIIa (Digital Instruments, США) в режимах постоянного и прерывистого контакта. При измерениях в контактном режиме сканирования использовали коммерческие кантилеверы из нитрида кремния (Si3N4) с жёсткостью 0,06,
13
0,32, 0,58 и 0,12 Н/м (в зависимости от объекта). Для измерений в режиме прерывистого контакта на воздухе использовали коммерческие кантилеверы из кремния с номинальной жесткостью 42 Н/м. Резонансная частота сканирования лежала в диапазоне 280-310 кГц. Измерения в жидкости проводили с использованием жидкостной ячейки (Digital Instruments, США) для режима прерывистого контакта, применяя коммерческие кантилеверы из нитрида кремния жесткостью 0,58 Н/м, при частоте сканирования 8-10 кГц.
Мышиные перитонеальные макрофаги получали путем инъекции стерильного раствора NaCl (0,9 %) в перитонеальную область мышей. После абдоминального массажа собирали перитонеальную жидкость, которую помещали на покровное стекло в присутствии среды 199 с 10 %-ной эмбриональной телячьей сывороткой в стерильной чашке Петри с нанообразцами. Затем добавляли 100 мкл бактериальной суспензии (106 клеток/мл) и культивировали 2 час при 37 °С. После инкубации монослой макрофагальных клеток на покровном стекле фиксировали этанолом и окрашивали по Романовскому. Изменения бактерицидной активности макрофагов изучали с помощью светового микроскопа Olympus BX41.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЙ Глава 1 Электрооптические методы исследования
На примере клеток E. coli и B. thuringiensis показана эффективная возможность оценки жизнеспособности бактерий на основных этапах биотехнологического производства биопрепаратов - этапах ферментации, концентрирования и сушки. На получение и обработку электрооптических данных уходит не более 20 мин. При определении интактных клеток учитывался тот факт, что в интервале 7,5 ≤ lgfo ≤ 7,8 (где fo частота задаваемого поля) электрооптический сигнал практически равен нулю. Оценку инактивирующего воздействия оценивали (в %) путем сравнения величины электрооптического эффекта (ЭОЭ) до и после воздействия в выбранном нами интервале частоты электрического поля. Электрооптические результаты сравнивали с результа-

14
тами, полученными путем высева бактериальных клеток на твердые питательные среды, с последующим подсчетом колониеобразующих единиц (КОЕ). Как видно из табл. 1, электрооптический метод позволяет аккуратно и быстро оценить жизнеспособность микроорганизмов после определенного экстремального воздействия.
Таблица 1 - Изменение ЭОЭ и жизнеспособности клеток E.coli и B. thu-
ringiensis на этапах ферментации, концентрирование и сушки |
|
||||
Биотехнологический |
E. coli |
|
B. thuringiensis |
||
этап |
Выживаемость |
|
ЭОЭ, % |
Выживаемость |
ЭОЭ, % |
|
клеток, % |
|
|
клеток, % |
|
Инокулят |
100 |
|
100 |
100 |
100 |
Ферментация |
80±8 |
|
78±8 |
82±8 |
80±8 |
Концентрирование |
67±8 |
|
65±8 |
68±8 |
67±8 |
Сушка |
13±7 |
|
9±7 |
40±7 |
39±7 |
Небольшое занижение результатов выживаемости бактериальных клеток, получаемое электрооптическим методом, объясняется тем, что данный метод регистрирует как летальные, так и сублетальные повреждения бактерий. Данные повреждения и их репарация детально исследованы при изучении замораживания и оттаивания клеток, а также при их лиофилизации. Оказалось, что при замораживании-оттаивании активность мембраносвязанных оксидазных и дегидрогеназных ферментов, а также содержание цитохромов не меняется. Не наблюдается также структурных перестроек в липидной фазе мембраны и изменений в ее липидном составе. Однако замораживаниеоттаивание вызывает повреждение целостности клеточного барьера, с последующим разобщением окислительного фосфорилирования. В ходе восстановительных процессов (репарации) после экстремальных воздействий наблюдается восстановление целостности клеточного барьера, с последующим восстановлением синтеза АТФ в ответ на искусственно созданную протондвижущую силу.
Выбор электрофизических параметров эксперимента определялся тем, чтобы для данного вида микроорганизмов электрооптический сигнал успевал за минимально возможное время достичь максимума при включении поля и
15
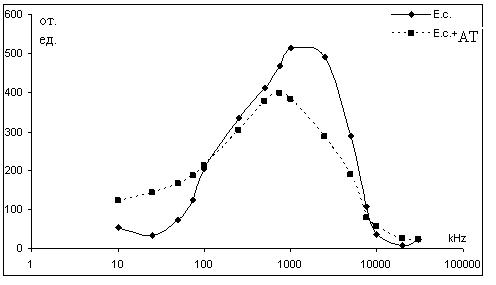
вернуться к исходному уровню при его выключении. Измерение поляризационных параметров клеток как функции частоты электрического поля или частотной дисперсии анизотропии поляризуемости (ЧДАП) – позволяет определить физиологическую активность клеток. После оптимизации состава поддерживающей среды и электрофизических параметров электрооптических измерений было изучено влияние реакции антиген-антитело на ЧДАП комплекса микроорганизм – антитело. К суспензии бактерий (E. coli или S. enteritidis) в фосфатно-солевом буфере добавляли раствор антител, специфичных, соответственно, к E. coli или S. enteritidis. Полученную смесь инкубировали 20 мин при 37 °С и легком помешивании. Полученную суспензию помещали в измерительную ячейку электрооптического анализатора. Под действием переменного электрического поля (напряженность Е=100 в/см; время действия t=2 сек.; диапазон частот f=10-30000 кГц) происходили изменения оптических свойств суспензии, которые регистрировали в виде ЧДАП (рис. 1-2). В качестве контроля использовали бактерии, не взаимодействовавшие с антителами.
Рисунок 1 - ЧДАП суспензии бактерий E. coli после взаимодействия со специфическими антителами
На основании полученных результатов можно дать некоторую оценку электрофизических и морфометрических параметров полученных комплексов ан-
16
тиген-антитело. Общее снижение амплитуды электрооптического сигнала в присутствии антител может быть следствием образования конгломератов бактериальных клеток. Сдвиг максимума ЧДАП в область низких частот указывает на возможное нарушение целостности бактериальных мембран.
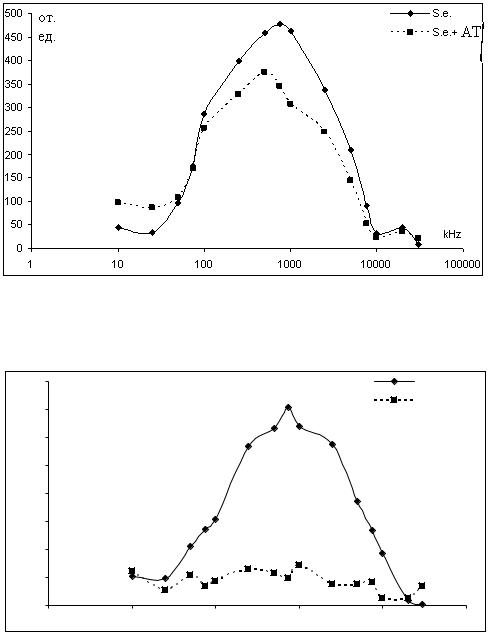
Рисунок 2 - ЧДАП суспензии бактерий S. enteritidis после взаимодейст- |
|||||
вия со специфическими антителами |
|
|
|
||
400,00 |
ед |
|
|
|
E.c.контроль |
|
|
|
|
E.c./V18 |
|
350,00 |
от. |
|
|
|
|
|
|
|
|
||
300,00 |
|
|
|
|
|
250,00 |
|
|
|
|
|
200,00 |
|
|
|
|
|
150,00 |
|
|
|
|
|
100,00 |
|
|
|
|
|
50,00 |
|
|
|
|
|
0,00 |
|
|
|
|
kHz |
|
|
|
|
|
|
1 |
10 |
100 |
1000 |
10000 |
100000 |
Рисунок 3 - ЧДАП после взаимодействия бактериальной суспензии кле- |
|||||
ток E.coli 057 c фагом V18/A157 |
|
|
|
||
Была изучена возможность использования электрооптического метода для идентификации микроорганизмов путем анализа специфического взаимодействия микробных клеток с бактериофагом. На рис. 3 представлены ЧДАП контрольной суспензии бактерий E. coli и ЧДАП тех же бактерий по-
17
сле 30-минутной инкубации с фагом V18/А157. На рис. 4 показаны ЧДАП контрольной суспензии S. enteriditis и суспензии тех же бактерий после 30минутной инкубации с фагом 39. Здесь же представлена ЧДАП суспензии бактерий S. enteriditis после 30-минутной инкубации с фагом V18/А157 – специфичным для E. coli, очевидно, невзаимодействующим с бактериями S. enteriditis. Полученные данные подтверждают возможность использования бактериофагов для идентификации микроорганизмов.
400,00 |
ед. |
|
|
|
S.e.контроль |
|
|
|
|
S.e./39 |
|
350,00 |
от. |
|
|
|
|
|
|
|
S.e./V18 |
||
|
|
|
|
||
|
|
|
|
|
|
300,00 |
|
|
|
|
|
250,00 |
|
|
|
|
|
200,00 |
|
|
|
|
|
150,00 |
|
|
|
|
|
100,00 |
|
|
|
|
|
50,00 |
|
|
|
|
|
0,00 |
|
|
|
|
kHz |
|
|
|
|
|
|
1 |
10 |
100 |
1000 |
10000 |
100000 |
Рисунок 4 - ЧДАП после взаимодействия бактериальной суспензии кле-
ток S. enteriditis c фагами V18/A157 и 39
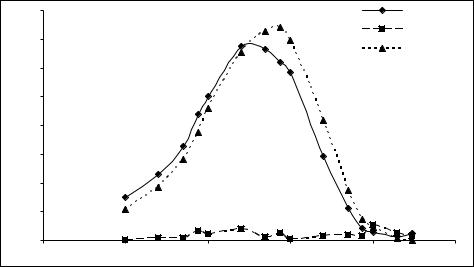
При исследовании взаимодействия клеток B. thuringiensis с фагом Vf, было обнаружено, что если проводить инкубацию бактерий с фагом без аэрации (как в вышеуказанных случаях с E. coli и S. enteriditis), то даже спустя 90 минут не наблюдается существенного изменения ЧДАП (рис. 5).
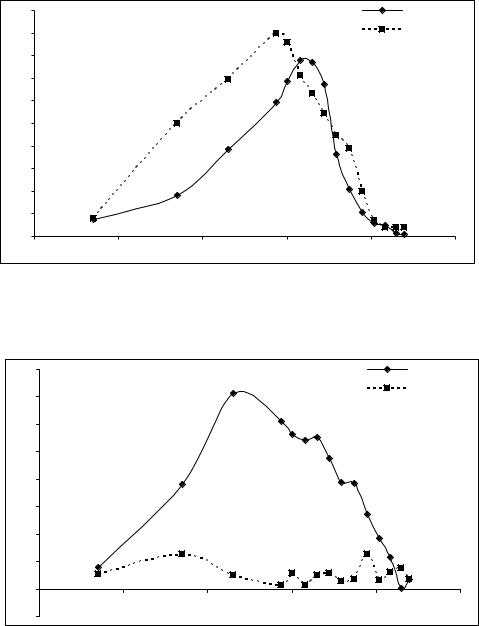
Однако при инкубации клеток B. thuringiensis с бактериофагом Vf в условиях аэрации результаты получаются сходными с теми, которые были получены при изучении взаимодействия с фагами факультативно анаэробных бактерий E. coli и S. enteriditis (рис. 6). Через 60 мин инкубации бактерий с фагами ЧДАП практически исчезает, что указывает на драматическое нарушение целостности бактериальных оболочек в этих условиях определения.
18
1000 |
ед. |
|
|
|
B.t.контроль |
900 |
|
|
|
B.t./Vf |
|
от. |
|
|
|
||
|
|
|
|
||
|
|
|
|
|
|
800 |
|
|
|
|
|
700 |
|
|
|
|
|
600 |
|
|
|
|
|
500 |
|
|
|
|
|
400 |
|
|
|
|
|
300 |
|
|
|
|
|
200 |
|
|
|
|
|
100 |
|
|
|
|
kHz |
0 |
|
|
|
|
|
|
|
|
|
|
|
1 |
10 |
100 |
1000 |
10000 |
100000 |
Рисунок 5 - ЧДАП после взаимодействия бактериальной суспензии кле- |
|||||
ток B. thuringiensis без аэрации c фагом Vf |
|
|
|||
1600 |
ед. |
|
|
|
B.t.контроль |
|
|
|
|
B.t./Vf |
|
1400 |
от. |
|
|
|
|
|
|
|
|
||
1200 |
|
|
|
|
|
1000 |
|
|
|
|
|
800 |
|
|
|
|
|
600 |
|
|
|
|
|
400 |
|
|
|
|
|
200 |
|
|
|
|
kHz |
0 |
|
|
|
|
|
|
|
|
|
|
|
1 |
10 |
100 |
1000 |
10000 |
100000 |
-200 |
|
|
|
|
|
Рисунок 6 - ЧДАП после взаимодействия бактериальной суспензии кле- |
|||||
ток B. thuringiensis при аэрации c фагом Vf |
|
|
|||
Для улучшения измерения ЭОЭ при низкой величине напряженности ориентирующего поля был разработан численный алгоритм определения анизотропии поляризуемости бактериальных клеток, снимающий существенные ограничения на проведение эксперимента.
19
Глава 2 Биосенсоры
Целью данной части работы является разработка новой генерации биосенсоров на основе системы искусственного носа, ферментов, фагов, бактериальных клеток или их фрагментов для увеличения чувствительности и скорости определения глюкозы, лизина, лактата, а также для определения концентрации бактерий.
2.1 Бесконтактное определение микроорганизмов
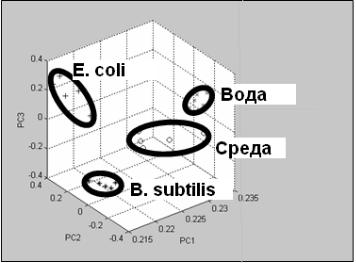
Разработан бесконтактный метод определения бактерий с применением системы искусственного носа на основе высокоплотных волоконнооптических биосенсорных пучков. Принцип определения бактерий основан на анализе воздушного пространства над образцом для определения летучих компонентов (ЛК). Известно, что выделяемые бактериями ЛК определяют специфический запах бактерий, что может служить характерным признаком данной бактерии. Сенсорным элементом являются полистирольные микросферы с флуоресцентным красителем интерколированные в проксимальный конец волоконной системы. ЛК способны влиять на микроокружение микросфер, изменяя флуоресцентные характеристики красителя. Таким образом, анализируя летучие вещества, можно идентифицировать бактерии (рис. 7).
Рисунок 7 - Бесконтактная идентификация бактерий при использовании системы искусственного носа
20
Развивая данный подход, была показана принципиальная возможность использования простой модификации метода спектрофотометрического анализа для быстрого выявления присутствия микроорганизмов либо по выделению ими ЛК, либо по их поглощению из окружающей среды. Кроме того, данный метод позволяет различить мутанты N. сrassa, дефектные по метаболизму азота, от штамма дикого типа. По-видимому, nit-2 и nit-6 гены гриба связаны с образованием ЛК у этого организма.
2.2 Биосенсор для определения глюкозы
Биосенсоры представляют собой недорогую альтернативу классическому анализу веществ в ходе биотехнологических процессов. Антибиотик авермиктин играет большую роль как в медицине, так и в ветеринарии. Он продуцируется бактериями S. avermitilis в ходе процесса длительного культивирования (72 ч). Характерно, что максимальный выход этого антибиотика наблюдается в короткий промежуток времени при минимальной концентрации глюкозы в среде. Для оптимизации условий выделения антибиотика важно определить минимальную концентрацию глюкозы в среде очень быстро, так как авермиктин быстро распадается при отсутствии глюкозы. Был разработан глюкозный биосенсор для контроля концентрации авермиктина. Для приготовления глюкозного модуля использовали бычий сывороточный альбумин, глюкозооксидазу и глутаровый альдегид. Глюкозный модуль помещали на торец рО2-электрода. Линейный ответ биосенсора наблюдали в диапазоне концентраций глюкозы от 1 до 30 мМ. Данная система очень перспективна для быстрого определения глюкозы в среде культивирования бактерий с целью увеличения выхода антибиотика.
2.3 Разработка бисенсорной системы узнавания на основе бактериальных клеток и их фрагментов с помощью криоиммобилизации
Бактериальные клетки можно рассматривать как систему, содержащую различные ферменты в их естественном окружении, для конструирования биосенсоров. Такая биокаталитическая система на основе бактерий осуществляет ферментативные реакции в оптимальных, естественных условиях, и,
