
- •37. Факторы, определяющие скорость реакций биологических процессов.
- •Принцип обратной связи и лимитирующего звена (определяющей реакции) и их роль в регуляции скоростей протекания биологических процессов.
- •Энергия активации реакции (процесса). Экспериментальной определение величины энергии активации.(см №42 тоже)
- •Основные положения теории ферментативной кинетики и общей теории механизма действия ферментов.
- •Вывод и анализ уравнения Михаэлиса-Ментен для односубстратной ферментативной реакции.
- •7 Основных постулатов для выполнения уравнения Михаэлиса-Ментен.
- •Графическии анализ результатов кинетического исследования ферментативной реакции (v0 число "оборотов", Vmах,Кm).
- •Использование уравнения Лайнуивера-Берка для определения кинетических характеристик ферментативной реакции.
- •Кинетика ингибирования ферментативных реакций. Обратимое и необратимое ингибирование. Типы обратимого ингибирования.
-
Кинетика ингибирования ферментативных реакций. Обратимое и необратимое ингибирование. Типы обратимого ингибирования.
1) ОБРАТИМЫЕ
2) НЕОБРАТИМЫЕ (КАК ПРАВИЛО- НЕПРИРОДНОГО ПРОИСХОЖДЕНИЯ - NaF (ингибитор фосфатаз), п-хлормеркурибензоат (связывает группировки -SH), диизопропилфторфосфат (протеиназ и эстераз)- эти ингибиторы действуют необратимо.
ОБРАТИМЫЕ ИНГИБИТОРЫ- клеточные метаболиты и типы ингибирования
а) КОНКУРЕНТНОЕ ингибирование б) НЕКОНКУРЕНТНОЕ ингибирование в) БЕСКОНКУРЕНТНОЕ ингибирование
51а) КОНКУРЕНТНОЕ ИНГИБИРОВАНИЕ- когда за активный центр фермента вместе с субстратом конкурирует ИНГИБИТОР: Е + I = EI Ki = [E][I] / [EI], чем меньше Ki, тем сильнее ингибитор.
Так, малоновая (1), щавелевоуксусная (2) и глутаровая (3) кислоты ингибируют фермент СУКЦИНАТДЕГИДРОГЕНАЗУ, субстратом которой является янтарная кислота (4)
(СУКЦИНАТ),
так как они сходны по строению с
субстратом:
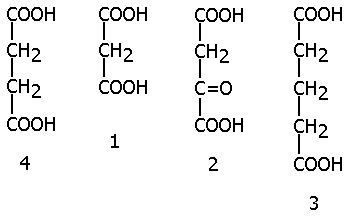
Другой пример. Сульфаниламидные антибактериальные препараты имеют сходное строение с парааминобензойной кислотой и являются конкурентными ингибиторами в синтезе бактериями фолиевой кислоты (фактора роста бактерий). У человека нет такого метаболического пути и в лечебных дозах они не влияют на жизнедеятельность человека, оказывая общий БАКТЕРИОСТАТИЧЕСКИЙ эффект (нарушая в некоторой степени деятельность кишечной микрофлоры):

52.2) НЕКОНКУРЕНТНОЕ ИНГИБИРОВАНИЕ ПРОЯВЛЯЕТСЯ ПРИ СВЯЗЫВАНИИ ИНГИБИТОРА С ФЕРМЕНТОМ ВНЕ АКТИВНОГО ЦЕНТРА, но при этом меняется структура активного центра и связь с субстратом становится невозможной. E + I ---> EI, EI + S ----> (невозможно)
3) БЕСКОНКУРЕНТНОЕ ИНГИБИРОВАНИЕ - результат присоединения ингибитора ТОЛЬКО ПОСЛЕ образования ЭНЗИМ СУБСТРАТНОГО КОМПЛЕКСА: E + S = ES ES + I = ESI
53. ОПРЕДЕЛЕНИЕ ТИПА ИНГИБИРОВАНИЯ 1) КОНКУРЕНТНЫЙ ИНГИБИТОР увеличивает Кm и не изменяет V max. 2) НЕКОНКУРЕНТНЫЙ ингибитор не изменяет Кm и снижает V max. 3) БЕСКОНКУРЕНТНЫЙ ингибитор в одинаковой степени снижает Кm и V max: Некоторые продукты ферментативных реакций также выступают в роли ингибиторов. Так, глюкоза ингибирует фермент Г-6-фосфатазу: Глюкозо-6-фосфат + Н2О -- Глюкоза + Н3РО4
54. предмет, задачи молекул. биофизики. Методы исследования
Биофизика-физика макроскопических систем-клеток и организмов.
Предмет - Изучает строение и физ хим свойства биофункциональных молекул (прежде всего биополимеров-белков, нуклеиновых кислот). Основной задачей мол биофизики является вскрытие физических механизмов, ответственных за биофункциональность этих молекул (напимер, ферментативная активность белков).
Малые различия в мол струк-ре- важно для реализации хим. баланса в живой системе(хиральность-оптически-активные конфигурации, конформации молекул-поворотные изомеры).
Методы: ЭПР(Электронный Парамагнитный Резонанс), ЯМР(Ядерный магнитный резонанс), При исследовании строения и конформационных превращений Биополимеры широко используются как очищенные природные Биоп, так и их синтетические модели, которые проще по строению и легче поддаются исследованию. Так, при изучении белков моделями служат гомогенные или гетерогенные полипептиды (с заданным или случайным чередованием аминокислотных остатков). Моделями ДНК и РНК являются соответствующие синтетические гомогенные или гетерогенные полинуклеотиды. К методам исследования Биоп и их моделей относятся рентгеноструктурный анализ, электронная микроскопия, изучение спектров поглощения, оптической активности, люминесценции, методы светорассеяния и динамического двойного лучепреломления, седиментационный метод, вискозиметрия, физико-химические методы разделения и очистки и ряд др. Все методы, разработанные для изучения синтетических полимеров, применимы и к Биополимеры При трактовке свойств Биополимеры и их моделей, закономерностей их конформационных превращений используются также методы теоретической физики (статистической физики, термодинамики, квантовой механики и др.).
В мол. биоф. нету проблем, связ. с неравновесным поведением живой открытой системы-биополимеры хорошо иссслед in vitro.
55. биополимеры как основа организации биоструктур, особенности строения, функции
БИОПОЛИМЕРЫ (от греч. bios-жизнь и polymeres - состоящий из многих частей, многообразный), прир. высоко-мол. соединения, являющиеся структурной основой всех живых организмов. Обеспечивают их нормальную жизнедеятельность, выполняя разнообразные биол. функции. К Б. относятся белки, нуклеиновые кислоты, полисахариды. Известны также смешанные Б., напр. липопротеины (комплексы, содержащие белки и липиды), гликопротеины (соед., в молекулах к-рых олиго- или полисахаридные цепи ковалентно связаны с пептидными цепями), липополисахариды (соед., молекулы к-рых построены из липидов, олиго-и полисахаридов).
Основные структурные компоненты живого организма являются биополимерами (белки и НК).
Специфика - состоят из ограниченного числа повторяющихся сегментов (мономеры, связанные между собой в полипептидную цепь, НК). Атомы, повороты и вращающиеся вокруг одинарных связей - большое количество состояний (конформаций). В зависимости от химического строения и внешних условий молекулы Биополимеры могут находиться либо в одной или в нескольких преимущественных конформация
Биополимер - макросистема. Основные параметры:
1. Размеры
2. Форма
3. Степень свёрнутости
Существуют и взаимодействия - силы притяжения и отталкивания, ограниченное число вариантов.
Нуклеиновые кислоты выполняют в клетке генетические функции. Последовательность мономерных звеньев (нуклеотидов) в дезоксирибонуклеиновой кислоте - ДНК (иногда в рибонуклеиновой кислоте - РНК) определяет (в форме генетического кода) последовательность мономерных звеньев (аминокислотных остатков) во всех синтезируемых белках и, т. о., строение организма и протекающие в нём биохимические процессы.
Белки выполняют в клетке ряд важнейших функций. Белки-ферменты осуществляют все химические реакции обмена веществ в клетке, проводя их в необходимой последовательности и с нужной скоростью. Белки мышц, жгутиков микробов, клеточных ворсинок и др. выполняют сократительную функцию, превращая химическую энергию в механическую работу и обеспечивая подвижность организма в целом или его частей. Белки - основной материал большинства клеточных структур
56. Типы взаимодействия в биополимерах
Существуют различные типы взаимодействий в биологических полимерах, от которых в основном зависит вторичная структура макромолекул. Взаимодействия Ван?дер?Ваальса Силы Ван?дер?Ваальса играют большую роль в образовании конденсированных жидких и твердых состояний, во взаимодействиях на поверхности раздела фаз. Ими определяются взаимодействия в газах и возникающие отклонения от законов идеальных газов. В первом приближении эти отклонения подчиняются известному уравнению Ван?дер?Ваальса для газов (р + a/v2)(v?b)= nRT, Биологические макромолекулы можно также рассматривать как своего рода конденсированную систему, состояние которой определяется слабыми невалентными взаимодействиями. Именно последние и дают основной вклад в стабилизацию конформационного состояния и его изменение в процессах функционирования. К Ван?дер?ваальса относят ориентационные, индукционные и дисперсионные взаимодействия.
Водородная связь. Заряд?дипольные взаимодействия Наряду с обычными силами Ван?дер?Ваальса большую роль в стабилизации биоструктур играют также водородные связи и электростатические взаимодействия между заряженными и полярными
группами. В частности, известно, что водородные связи стабилизируют вторичную структуру полипептидных цепей.
Электростатические взаимодействия. Этот вид взаимодействий не только дает вклад в энергию водородных связей, но и играет важную самостоятельную роль в стабилизации биоструктур. Различные атомы в пептидных цепочках сильно различаются по характеру распределения на них зарядов.
Потенциал внутреннего вращения. Как было показано, энергия ближних взаимодействий атомных групп, проявляющаяся при вращении их вокруг единичных связей, определяет общую конформационную энергию полимерной цепи. Природа этих взаимодействий связана в основном с отталкиванием атомов, у которых перекрываются электронные оболочки, вследствие чего появляется тормозящий энергетический потенциал внутреннего вращения, препятствующий вращению атомных групп. В зависимости от расстояния между вращающимися атомными группами при изменении угла поворота вокруг единичной связи значение тормозящего потенциала будет различно и, следовательно, различные поворотные изомеры дают различный вклад в информационную энергию всей молекулы.
Поворотная изомерия. Различающиеся между собой устойчивые конформации, возникающие в результате поворотов вокруг единичных связей, называются поворотными изомерами.
57. Факторы стабильности пространственной структуры биологических макромолекул
2 типа цепей:
I. Свободно сочленённая полимерная цепь состоит из большого числа сегментов, сегменты – много атомов. Данная цепь из сегментов взаимно независимых в отношении ориентации в пространстве.
- Свободно сочленённые - молекула белка.
М.б. равен длине всех аминокислот, если вытянута цепь во всю длину. Вероятность, что определённый сегмент в определённой точке по отношению к другому сегменту -функция распределения (w).
Свойство свободно сочленённой цепи - гибкость. Сворачивание цепи в клубок определяется ее гибкостью.
При растяжении действует расклинивающая сила (действует не бесконечно в растворе). В определённом состоянии силы стягивания преобладают над набуханием.
II. Червеобразная цепь - цепь у которой в пределе среднее значение угла между двумя атомами в одинарной связи стремиться к 0. При этом длина звена стремиться к 0. Цепь полимера приобретает постоянную кривизну. Характерна для биополимера, имеющего длину менее 50 сегментов. (М=100 Да). Известны крупные полимеры. (ДНК 2)
Говорят о персистентной длине (а), а достаточно хорошо связана со среднеквадратичным расстоянием.
Для ДНК а=50нм. Жёсткость обусловлена тем, что пары оснований располагаются друг над другом(стопка).
Для белковых молекул характерна свободно сочленённая цепь, ДНК - червеобразная. Молекула белка может находиться в двух состояниях:
1. Клубок
2. Глобула.
Если в макромолекуле отсутствуют объёмные взаимодейтвия, для таких биополимеров характерна форма клубка.
Если в биополимере существует какие-либо объёмные взаимодействия, то они приводят к уменьшению количества возможных конформации и стабилизируют тот или иной биополимер. Чем больше объёмные взаимодействия, тем меньше возможных конформации. Форма - глобула. В отличие от клубка r - вектор меньше чем r биополимера.
Биополимеры могут переходить из клетки в клетку в глобуле. Это зависит от температуры. Существуют температура, при которой отталкивание мономеров полностью компенсирует их притяжение. Данная температура - температура фазового перехода. При данной температуре биомолекула находится в форме клубка.
Снижение температуры приводит к тому, что силы притяжения начинают преобладать. Пространственная структура более компактная и упорядоченная. В этом состоянии биополимеры приобретают форму глобулы.
Все виды взаимодействий между атомами независимо от их физической природы при формировании различных макромолекулярных связей можно разделить на 2 основных типа:
взаимодействия ближнего порядка между атомами соседних звеньев;
дальние взаимодействия между атомами, которые хотя и отстоят по цепи далеко друг от друга, но случайно встретились в пространстве в результате изгибов цепи.
Сворачиваемость цепи в клубок определяется термодинамической гибкостью: чем больше гибкость, тем меньше h2. В растворе наиболее вероятная конформация полимера - свернутый клубок, в котором энтропия системы максимальна. При растяжении полимеров происходит развертывание клубка и уменьшение размера возможных конформаций, что сопровождается уменьшением энтропии.
В полимерных нитях, вследствие взаимосвязанности звеньев, изменение плотности в одной точке пространства связано с изменением плотности в другой точке, то есть существует пространственная корреляция плотности. Если в макромолекуле отсутствует объёмное взаимодействие, то она не имеет достоверной пространственной структуры. В этом состоянии флуктуация (изменение вероятности) плотности имеет значение того же порядка, что и сама плотность. Такое состояние носит название клубка.
Условия существования клубка и глобулы.
Вследствие объёмных взаимодействий сблизившиеся участки могут притягиваться или отталкиваться. Повышение температуры приводит к увеличению отталкивания между мономерами, а понижение - к сближению. Существует температура, при которой отталкивание компенсируется притяжением. Эта температура называется -точкой или - температурой. В этой точке объёмное взаимодействие отсутствует, и макромолекула представляет собой клубок с размерами порядка l*N1/2. Клубок сохраняется при повышении температуры выше точки В реальных макромолекулах объёмное
58 биофизика белков: строение полипептидной цепи, разнообразие типов пространственной структуры молекул Белки - также гетерополимеры; молекулы их образованы одной или несколькими полипептидными цепочками, соединёнными дисульфидными мостиками. В состав полипептидных цепей входит 20 видов различных мономерных звеньев - остатков аминокислот. Биологические функции белков. могут находиться либо в одной или в нескольких преимущественных конформациях, либо принимать многие более или менее равновероятные конформации. Белки делят по пространственной структуре на фибриллярные (нитевидные) и глобулярные; белки-ферменты, белки-переносчики, иммунные и некоторые другие имеют, как правило, глобулярную структуру. Для ряда белков - гемоглобин, миоглобин, лизоцим, рибонуклеаза и др. - эта структура установлена во всех деталях (с определением при помощи рентгеноструктурного анализа расположения каждого атома). Она определяется последовательностью аминокислотных остатков и образуется и поддерживается относительно слабыми взаимодействиями между мономерными звеньями полипептидных цепей в водно-солевом растворе (кулоновские и дипольные силы, водородные связи, гидрофобные взаимодействия), а также дисульфидными связями. Глобула белка формируется так, что большинство полярных гидрофильных аминокислотных остатков оказывается снаружи и контактирует с растворителем, а большинство неполярных (гидрофобных) остатков находится внутри и изолировано от взаимодействия с водой. Молекулы белка, обладающие избытком неполярных групп, когда часть из них оказывается на поверхности глобулы, образуют высшую, т. н. четвертичную структуру, при которой несколько глобул агрегируют, взаимодействуя между собой в основном неполярными участками. Пространственная структура каждого белка-фермента уникальна и обеспечивает необходимое для его функционирования расположение в пространстве всех звеньев, но надежную взаимосвязь органов, а также их механическую целостность и защиту.
Пептидная связь.
4 атома N,H,C,O располагаются в одной плоскости. Из химии известно, что вращение в молекуле вокруг ординарной связи приводит к появлению поворотных изомеров.
В белках вращение вокруг пептидной связи C-N затруднено (энергия активации 40 - 80 кДж/моль), т.к. эта связь имеет характер двойной связи и, кроме того, в пептидной группе имеет место водородная связь между группой С=O и атомом водорода группы N-H (с энергией активации 20-30 кДж/моль).
Поэтому белок можно рассматривать как цепь связанных друг с другом плоских пептидных звеньев. Вращение этих звеньев возможно лишь вокруг одинарных связей -углерода и аминокислот
Нахождение наиболее устойчивой конформации белковой цепи требует минимизации ее полной энергии, включая энергию внутримолекулярных водородных связей. Полинг и Кюри установили 2 основных варианта структуры белковой цепи, которые называются альфа -спираль и бэтта -спираль
Аморфные участки - депо строительного материала, который в случае необходимости используется для построения упорядоченных участков.
Белки:
1. уровень - первичная структура
2. уровень - структурные сегменты (вторичная структура) Основная роль -Н-Н связи.
3. формирование элементарных комплексов. Стабилизации - А-Д-В и ионные взаимодействия.
4. формирование доменов.
5.формирование глобулярных белков, фибриллярных белков (конечная третичная структура)
Связи:
1.Гидрофобные взаимодействия сближают фрагменты. Осуществляется внутри альфа спирали и в участках с более компактным расположением
2. Электростатическое притяжение
3. поперечные ковалентные связь, остаток Cys.
4. Водородная связь.
Четвертичная структура - гемоглобин М=64500 4 цепи Пируватдегидрогеназный комплекс, М=4600000
Функции белков:
1. Ферменты
2. транспортные белки (гемоглобин)
3. пищевые и запасные (казеин, яичный альбумин)
4. Структурные (коллаген, кератин)
5. Защитные (тромбин)
Биополимеры, в особенности т. н. активных центров. В то же время она не абсолютно жестка и допускает необходимые в процессе функционирования (при взаимодействии с субстратами, ингибиторами и другими веществами) конформационные сдвиги и изменения.
1)каталитическая (или ферментативная) функция
2)Механохимическая функция сократительных белков лежит в основе мышечного сокращения. Сократительные белки - это ферменты, в результате каталитической деятельности которых химическая энергия превращается в механическую работу. Существование клетки и целостного организма требует пространственного разграничения мембранами, которые характеризуются различными проницаемостями. Белки, входящие в состав мембран в комплексе с липидами, 3)обеспечивают активный транспорт, как в клетке, так и из нее в направлении против градиента концентрации. Переходя от клетки к многоклеточному организму, мы встречаем новые специфические функции белков.
4)для запасания (примером является миоглобин) и переноса (гемоглобин) кислорода. Эта функция белков сходна с ферментативной, но отличается от нее тем, что молекулярный кислород не испытывает превращений в этих процессах. Специализированные белки высших организмов - гаммаглобулины - защищают организм от чужеродных биополимеров, выполняя тем самым иммунологическую функцию. Специальные (фибриллярные) белки входят в состав кожи, костей, волос, сухожилий и выполняют опорную функцию, обеспечивая не жесткую
59. Физические свойства белков, денатурация, ренатурация. биороль
Природные белковые тела наделены определенной, строго заданной пространственной конфигурацией и обладают рядом характерных физико-химических и биологических свойств при физиологических значениях температуры и рН среды. Под влиянием различных физических и химических факторов белки подвергаются свертыванию и выпадают в осадок, теряя нативные свойства. под денатурацией следует понимать нарушение общего плана уникальной структуры нативной молекулы белка, преимущественно ее третичной структуры, приводящее к потере характерных для нее свойств (растворимость, электрофоретическая подвижность, биологическая активность и т.д.). Большинство белков денатурирует при нагревании их растворов выше 50–60°С.
Внешние проявления денатурации сводятся к потере растворимости, особенно в изоэлектрической точке, повышению вязкости белковых растворов, увеличению количества свободных функциональных SH-групп и изменению характера рассеивания рентгеновских лучей. Наиболее характерным признаком денатурации является резкое снижение или полная потеря белком его биологической активности (каталитической, антигенной или гормональной). При денатурации белка, вызванной 8М мочевиной или другим агентом, разрушаются в основном нековалентные связи (в частности, гидрофобные взаимодействия и водородные связи). Дисульфидные связи в присутствии восстанавливающего агента меркаптоэтанола разрываются, в то время как пептидные связи самого остова полипептидной цепи не затрагиваются. В этих условиях развертываются глобулы нативных белковых молекул и образуются случайные и беспорядочные структуры
При непродолжительном действии и быстром удалении денатурирующих агентов возможна ренатурация белка с полным восстановлением исходной трехмерной структуры и нативных свойств его молекулы включая биологическую активность. Таким образом, при денатурации белковая молекула полностью теряет биологические свойства, демонстрируя тем самым тесную связь между структурой и функцией. Для практических целей иногда используют процесс денатурации в «мягких» условиях, например при получении ферментов или других биологически активных белковых препаратов в условиях низких температур в присутствии солей и при соответствующем значении рН. При лиофилизации белков (высушивание в вакууме путем возгонки влаги из замороженного состояния) для предотвращения денатурации часто пользуются химическими веществами (простые сахара, глицерин, органические анионы).
60 Биофизика нуклеиновых кислот (НК):строение полипептидной цепи, особенности пространственной структуры
НК являются обязательными участниками процессов синтеза белков. Основная цепь НК состоит из чередующихся звеньев фосфорной кислоты и сахара (рибозы в РНК; дезоксирибозы в ДНК). К сахарам присоединяются азотистые основания, которые уже не повторяют друг друга.
Общая схема строения цепи:
Рибоза
Дезоксирибоза
Подобно тому, как в белках фигурируют 20 аминокислотных остатков, так в ДНК и РНК фигурируют 4 азотистых основания. Но это правило менее строгое и наряду с каноническими основаниями встречаются производные от них - минорные основания. В ДНК фигурируют цитозин (Ц), тимин (Т), аденин (А), гуанин (Г); в РНК - цитозин (Ц), тимин (Т), аденин (А), урацил (У).
Для всех азотистых оснований характерно наличие центрального кольца по типу бензольного. Наличие двойных связей приводит к наличию делокализованных электронов, принадлежащих всему кольцу.
Соединения азотистых оснований с рибозой и дезоксирибозой называются нуклеозидами (соответственно, рибонуклеозиды и дезоксирибонуклеозиды).
Аналогичные нуклеозиды Г, Т, У называются соответственно: гуанозин, тимидин, уридин.
В результате фосфорелирования образуются ди- и трифосфаты. Эти мономерные соединения играют важнейшую роль в биоэнергетических процессах.
Вместо R:
Аденозиндифосфат (АДФ):
Аденозинтрифосфат (АТФ):
Образование нуклеиновой кислоты происходит путем поликонденсации нуклеозидтрифосфата. При включении в цепь каждого нуклеозида отщепляется одна молекула дифосфата - пирофосфорная кислота.
Нуклеиновые кислоты подобно белковым цепям являются линейными неразветвленными цепями. Первичная структура нуклеиновой кислоты определяется последовательностью азотистых оснований. Первичная структура ДНК была расшифрована в 1962 году, и сегодня существует правило синтеза полинуклеотидных цепей. Одно из нескольких экспериментальных правил, справедливых для ДНК, - правило Чаргаффа (с точностью 3 - 5%):
ДНК содержится в основном в хромосомах клетки и ее молекулярный вес достигает миллиардов (самые длинные биополимеры). РНК содержится в цитоплазме ядер клеток, в растительных вирусах и фагах.
Принято различать четыре типа РНК:
Рибосомальная РНК (молекулярный вес - 2*106);
Матричная РНК (3*104 - 7*104) {так как средний вес рибонуклеотида равен 224, то самые короткие цепи матричной РНК содержат более 150 нуклеотидов;
Транспортная РНК (2*104) (около 80 нуклеотидов);
Вирусная РНК.
Функции
1. поддержание существования живых организмов
2. хранение и передача наследственной информции
3. непосредственное участие в передаче наследсвенной инфо (ДНК-мРНК-белок)
4. Составные компоненты НК выполняют ряд функций:
а) участие в качестве коферментов и аллостерических эффекторов
б) участие в аккумулировании Е.
Формы НК: 1. линейные 2. развёрнутые 3. кольцевые.
Кольцевые: 1-цеп, 2-цеп, замкнутые
Правило Чаргаффа:
1. А+Ц=Т+.Г
2. (А+Г)/(Ц+Т)=1 Молярная доля пуринов = молярной доле пиримидинов.
3. А=Т. Г=Ц
4. Существующее условие - коэффициент специфичности - отношение Г+Ц / А+Т. % ГЦ больше, тем больше плотная молекула ДНК
61 Физические модели нуклеиновых кислот(НК), методы изучения ДНК и РНК
Первичная структура - взаимодействие Н3РО4 и азотистых оснований происходит через сахар. Функции нуклеозидов:
1. коферменты (в оксидредуктазах)
2. предшественники для сроительных единиц РНК/ДНК
3. Энергетическая
Вторичная структура: взаимодействие м/д азотистыми основаниями путём образования водородных
связей. А=Т, Г=Ц(3 связи)
Расстояние – 10,85 А
Формы А и В - правозакрученные
А: ширина витка - 2,0 нм, длина - 3,4нм
В: шир-2,2нм, длина-2,8нм.
Z форма - левовращающаяся спираль, образуется при чередовании ГЦ.
В дальнейшей упаковке участвует 4 класса белков: Н2А, Н2В, НЗ, Н4
Изучение пространственных структур осуществляется на модельных системах. Используют 2 группы методов:
1. Метод построения упрощённых физических моделей. Основывается на экспериментальных данных.
2. Методы конформационного анализа:
I. Модель гибкого стержня.
II. Модель спираль-клубок.
Гибкость стержня определяется поворотной изомерией.
2 вида жесткости:
а) на изгиб оси (определяет способность ДНК укладываться в вирусную частицу и т.д. Е изгиба
gB – константа жесткости на изгибание.
gB=aKБT/l.
б) жесткость кручения - торсионная жесткость ДНК. Определяется как изменение Е внутри молекулы ДНК при отклонении угла м.д соседними парами оснований. Для перехода в другую форму достаточно отклонения на 2,5 градуса.
Переходы обуславливаются:
1. флуктуационным изгибанием оси НК
2. поворот соседних пар оснований ДНК
3. Раскрытие отдельных пар оснований
П. Метод спираль – клубок.
Основан на том, что движение зависит от температуры. Закрытые пары оснований образуют спираль, открытые участки - клубок. Открытые участки приводят к образованию суперспирали.
Параметр - степень спирализации (S). Определяется число супервитков на 10 пар оснований, обычно меньше 0, = 0,05. Образуют левозакрученные участки.
Метод конформационных переходов.
Формируют общую геометрию отдельных пар оснований. D- расстояние от центра п.о. до оси. ?-поворот, TL – наклон.
Особая роль - углеводный компонент, м.б. С2' -эндо, С3' - эндо, С3'- и С2' - экзо .
Z - форма - (ГЦ)n. Чем больше ГЦ, тем больше участок Z спирали. Данная последовательность -левовращающаяся. Широко распространена в природе. Угол равен 30 градусов. В 1 виток- 12 п.о.
Метод гибридизации основан на плавлении и отжиге НК. Плавление - разрушение Н-Н связей. Является взаимообратимым процессом. Используют для таксономической характеристики вида. Метод дифференциального центрифугирования
Методы: ЭПР(Электронный Парамагнитный Резонанс), ЯМР(Я?дерный магни?тный резона?нс), При исследовании строения и конформационных превращений Биополимеры широко используются как очищенные природные Биоп, так и их синтетические модели, которые проще по строению и легче поддаются исследованию. Так, при изучении белков моделями служат гомогенные или гетерогенные полипептиды (с заданным или случайным чередованием аминокислотных остатков). Моделями ДНК и РНК являются соответствующие синтетические гомогенные или гетерогенные полинуклеотиды. К методам исследования Биоп и их моделей относятся рентгеноструктурный анализ, электронная микроскопия, изучение спектров поглощения, оптической активности, люминесценции, методы светорассеяния и динамического двойного лучепреломления, седиментационный метод, вискозиметрия, физико-химические методы разделения и очистки и ряд др. Все методы, разработанные для изучения синтетических полимеров, применимы и к Биополимеры При трактовке свойств Биополимеры и их моделей, закономерностей их конформационных превращений используются также методы теоретической физики (статистической физики, термодинамики, квантовой механики и др.).
62 Физич. Свойства НК. Денатурация, ренатурация: механизм, качеств. и количеств характеристика, биологич. роль. Метод молекулярной гибридизации.
Молекулы нуклеиновых кислот содержат множество отрицательно заряженных фосфатных групп и образуют комплексы с ионами металлов; их калиевая и натриевая соли хорошо растворимы в воде. Концентрированные растворы нуклеиновых кислот очень вязкие и слегка опалесцируют, а в твердом виде эти вещества белые. Нуклеиновые кислоты сильно поглощают ультрафиолетовый свет, и это свойство лежит в основе определения их концентрации. С этим же свойством связан и мутагенный эффект ультрафиолетового света. Длинные молекулы ДНК хрупки и легко ломаются, например при продавливании раствора через шприц. Поэтому работа с высокомолекулярными ДНК требует особой осторожности. Химическая структура. Нуклеиновые кислоты это длинные цепочки, состоящие из четырех многократно повторяющихся единиц (нуклеотидов). Их структуру можно представить следующим образом: Символ Ф обозначает фосфатную группу. Чередующиеся остатки сахара и фосфорной кислоты образуют сахарофосфатный остов молекулы, одинаковый у всех ДНК, а огромное их разнообразие обусловливается тем, что четыре азотистых основания могут располагаться вдоль цепи в самой разной последовательности. Сахаром в нуклеиновых кислотах является пентоза; четыре из пяти ее углеродных атомов вместе с одним атомом кислорода образуют кольцо. Атомы углерода пентозы обозначают номерами от 1 до 5. В РНК сахар представлен рибозой, а в ДНК дезоксирибозой, содержащей на один атом кислорода меньше. Фрагменты полинуклеотидных цепей ДНК и РНК показаны на рисунке.
Денатурация ДНК - переход ДНК из двухнитевой формы в однонитевую при разрыве водородных связей между комплементарными парами оснований под воздействием высоких температур.
Ренатурация (renaturation)
- Восстановление (после денатурации) нативной (биологически активной) пространственной структуры биополимера (белка или нуклеиновой кислоты). В частности, ренатурация ДНК (после денатурации нагреванием) может происходить при медленном охлаждении, что используется для получения гибридных гетеродуплексов.
Метод дифференциальной диагностики и прямого выявления нуклеиновых кислот в исследуемом материале с помощью реакции молекулярной гибридизации и полимеразной цепной реакции (ПЦР).
Диагностическая суть этих методов заключается в том, что у исследователей имеются определенные олигонуклеотиды, воспроизводящие (или комплементарные), высококонсервативные и высокоспецифичные последовательности нуклеотидов из искомого генома. В реакции молекулярной гибридизации такие олигонуклеотилы называют зондами, в методе ПЦР -праймерами. В реакции молекулярной гибридизации назначение этих специфических олигонуклеотидов-"найти'' в исследуемой нуклеиновой кислоте комплементарные последовательности, и сформировать структуры согласно природе комплементарных взаимодействий между парами азотистых оснований . Материалом для исследований служит кровь, культуральная жидкость, ликвор, биопсийный материал, носоглоточные смывы, моча и пр. биологические субстанции. Молекулярно-генетические методы перспективны при необходимости ранней диагностики ВИЧ до появления в сыворотке AT, при неясных серологических результатах, при определении наличия ВИЧ в организме новорожденных детей от инфицированных женщин. Целесообразно использовать эти методы при обследовании серонегативных сексуальных партнеров инфицированных лиц
63 Осмотическое давление биол. жидкостей, его измерение; влияние поверхностной активности веществ на величину поверхностного натяжения, биологическая роль.
Осмотическое давление, диффузное давление, термодинамический параметр, характеризующий стремление раствора к понижению концентрации при соприкосновении с чистым растворителем вследствие встречной диффузии молекул растворённого вещества и растворителя. Если раствор отделен от чистого растворителя полупроницаемой мембраной, то возможна лишь односторонняя диффузия — осмотическое всасывание растворителя через мембрану в раствор. В этом случае О. д. становится доступной для прямого измерения величиной, равной избыточному давлению, приложенному со стороны раствора при осмотическом равновесии. О. д. обусловлено понижением химического потенциала растворителя в присутствии растворённого вещества. Тенденция системы выравнивать химические потенциалы во всех частях своего объёма и перейти в состояние с более низким уровнем свободной энергии вызывает осмотическое (диффузионный) перенос вещества. О. д. в идеальных и предельно разбавленных растворах не зависит от природы растворителя и растворённых веществ; при постоянной температуре оно определяется только числом «кинетических элементов» — ионов, молекул, ассоциатов или коллоидных частиц — в единице объёма раствора. Первые измерения О. д. произвёл В. Пфеффер (1877), исследуя водные растворы тростникового сахара. Его данные позволили Я. X. Вант-Гоффу установить (1887) зависимость О. д. от концентрации растворённого вещества, совпадающую по форме с Бойля — Мариотта законом для идеальных газов. Оказалось, что О. д. (p) численно равно давлению, которое оказало бы растворённое вещество, если бы оно при данной температуре находилось в состоянии идеального газа и занимало объём, равный объёму раствора. Для весьма разбавленных растворов недиссоциирующих веществ найденная закономерность с достаточной точностью описывается уравнением: pV = nRT, где n — число молей растворённого вещества в объёме раствора V; R — универсальная газовая постоянная; Т — абсолютная температура. В случае диссоциации вещества в растворе на ионы в правую часть уравнения вводится множитель i > 1, коэффициент Вант-Гоффа; при ассоциации растворённого вещества i < 1. О. д. реального раствора (p') всегда выше, чем идеального (p''), причём отношение p'/ p'' = g, называемое осмотическим коэффициентом, увеличивается с ростом концентрации. Растворы с одинаковым О. д. называется изотоническими или изоосмотическими. Так, различные кровезаменители и физиологические растворы изотоничны относительно внутренних жидкостей организма. Если один раствор в сравнении с другим имеет более высокое О. д., его называют гипертоническим, а имеющий более низкое О. д. — гипотоническим.
О. д. в клетках животных, растений, микроорганизмов и в биологических жидкостях зависит от концентрации веществ, растворённых в их жидких средах. Солевой состав биологических жидкостей и клеток, характерный для организмов каждого вида, поддерживается избирательной проницаемостью биологических мембран для разных солей и активным транспортом ионов. Относительное постоянство О. д. обеспечивается водно-солевым обменом, т. е. всасыванием, распределением, потреблением и выделением воды и солей. У т. н. гиперосмотических организмов внутреннего О. д. больше внешнего, у гипоосмотических — меньше внешнего; у изоосмотических (пойкилоосмотических) внутреннее О. д. равно внешнему. В первом случае ноны активно поглощаются организмом и задерживаются в нём, а вода поступает через биологич. мембраны пассивно, в соответствии с осмотическим градиентом. Гиперосмотическая регуляция свойственна пресноводным организмам, мор. хрящевым рыбам (акулы, скаты) и всем растениям. У организмов с гипоосмотической регуляцией имеются приспособления для активного выделения солей. У костистых рыб преобладающие в океанических водах ионы Na+ и Cl— выделяются через жабры, у морских пресмыкающихся (змеи и черепахи) и у птиц — через особые солевые железы, расположенные в области головы. Ионы Mg2+ у этих организмов выделяются через почки. О. д. у гипер- и гипоосмотических организмов может создаваться как за счёт ионов, преобладающих во внешней среде, так и продуктов обмена. Например, у акуловых рыб и скатов О. д. на 60% создаётся за счёт мочевины и триметиламмония; в плазме крови млекопитающих — главным образом за счёт ионов Na+ и Cl—; в личинках насекомых — за счёт разнообразных низкомолекулярных метаболитов. У морских одноклеточных, иглокожих, головоногих моллюсков, миксин и др. изоосмотических организмов, у которых О. д. определяется О. д. внешней среды и равно ему, механизмы осморегуляции отсутствуют (исключая клеточные).
Диапазон средних величин О. д. в клетках организмов, не способных поддерживать осмотический гомеостаз, довольно широк и зависит от вида и возраста организма, типа клеток и О. д. окружающей среды.
64. Поверхностное натяжение воды и биологических жидкостей, его измерение; влияние поверхностно активных веществ на величину поверхностного натяжения; биологическая роль.
Наиболее интересной особенностью жидкостей является наличие свободной поверхности. Жидкость, в отличие от газов, не заполняет весь объем сосуда, в который она налита. Между жидкостью и газом (или паром) образуется граница раздела, которая находится в особых условиях по сравнению с остальной массой жидкости. Молекулы в пограничном слое жидкости, в отличие от молекул в ее глубине, окружены другими молекулами той же жидкости не со всех сторон. Силы межмолекулярного взаимодействия, действующие на одну из молекул внутри жидкости со стороны соседних молекул, в среднем взаимно скомпенсированы. Любая молекула в пограничном слое притягивается молекулами, находящимися внутри жидкости (силами, действующими на данную молекулу жидкости со стороны молекул газа (или пара) можно пренебречь). В результате появляется некоторая равнодействующая сила, направленная вглубь жидкости. Поверхностные молекулы силами межмолекулярного притяжения втягиваются внутрь жидкости. Но все молекулы, в том числе и молекулы пограничного слоя, должны находиться в состоянии равновесия. Это равновесие достигается за счет некоторого уменьшения расстояния между молекулами поверхностного слоя и их ближайшими соседями внутри жидкости. Как видно из рис. 3.1.2, при уменьшении расстояния между молекулами возникают силы отталкивания. Если среднее расстояние между молекулами внутри жидкости равно r0, то молекулы поверхностного слоя упакованы несколько более плотно, а поэтому они обладают дополнительным запасом потенциальной энергии по сравнению с внутренними молекулами. Следует иметь ввиду, что вследствие крайне низкой сжимаемости наличие более плотно упакованного поверхностного слоя не приводит к сколь-нибудь заметному изменению объема жидкости. Если молекула переместится с поверхности внутрь жидкости, силы межмолекулярного взаимодействия совершат положительную работу. Наоборот, чтобы вытащить некоторое количество молекул из глубины жидкости на поверхность (т. е. увеличить площадь поверхности жидкости), внешние силы должны совершить положительную работу ΔA внеш, пропорциональную изменению ΔS площади поверхности: ΔAвнеш = ??S.
Коэффициент σ называется коэффициентом поверхностного натяжения (? > 0). Таким образом, коэффициент поверхностного натяжения равен работе, необходимой для увеличения площади поверхности жидкости при постоянной температуре на единицу.
В СИ коэффициент поверхностного натяжения измеряется в джоулях на метр квадратный (Дж/м2) или в ньютонах на метр (1 Н/м = 1 Дж/м2).
Следовательно, молекулы поверхностного слоя жидкости обладают избыточной по сравнению с молекулами внутри жидкости потенциальной энергией. Потенциальная энергия Eр поверхности жидкости пропорциональна ее площади: Eр = Aвнеш = ?S.
Из механики известно, что равновесным состояниям системы соответствует минимальное значение ее потенциальной энергии. Отсюда следует, что свободная поверхность жидкости стремится сократить свою площадь. По этой причине свободная капля жидкости принимает шарообразную форму. Жидкость ведет себя так, как будто по касательной к ее поверхности действуют силы, сокращающие (стягивающие) эту поверхность. Эти силы называются силами поверхностного натяжения.
Наличие сил поверхностного натяжения делает поверхность жидкости похожей на упругую растянутую пленку, с той только разницей, что упругие силы в пленке зависят от площади ее поверхности (т. е. от того, как пленка деформирована), а силы поверхностного натяжения не зависят от площади поверхности жидкости.
Некоторые жидкости, как, например, мыльная вода, обладают способностью образовывать тонкие пленки. Всем хорошо известные мыльные пузыри имеют правильную сферическую форму – в этом тоже проявляется действие сил поверхностного натяжения. Если в мыльный раствор опустить проволочную рамку, одна из сторон которой подвижна, то вся она затянется пленкой жидкости
Силы поверхностного натяжения стремятся сократить поверхность пленки. Для равновесия подвижной стороны рамки к ней нужно приложить внешнюю силу Fвн=-Fн. Если под действием внеш силы перекладина переместится на ?x, то будет произведена работа ?Aвн = Fвн?x = ?Ep = ??S, где ?S = 2L?x – приращение площади поверхности обеих сторон мыльной пленки. Так как модули сил вн и н одинаковы, можно записать:
Fн?x=?2L?x
Таким образом, коэффициент поверхностного натяжения ? может быть определен как модуль силы поверхностного натяжения, действующей на единицу длины линии, ограничивающей поверхность.
Из-за действия сил поверхностного натяжения в каплях жидкости и внутри мыльных пузырей возникает избыточное давление ?p. Если мысленно разрезать сферическую каплю радиуса R на две половинки, то каждая из них должна находиться в равновесии под действием сил поверхностного натяжения, приложенных к границе разреза длиной 2?R и сил избыточного давления, действующих на площадь ?R2 сечения (рис. 3.5.4). Условие равновесия записывается в виде ?2?R = ?p?R2
Отсюда избыточное давление внутри капли равно
?р=2 ?\R(капля жид-ти)
Избыточное давление внутри мыльного пузыря в два раза больше, так как пленка имеет две поверхности: ?р=4 ?\R
Вблизи границы между жидкостью, твердым телом и газом форма свободной поверхности жидкости зависит от сил взаимодействия молекул жидкости с молекулами твердого тела (взаимодействием с молекулами газа (или пара) можно пренебречь). Если эти силы больше сил взаимодействия между молекулами самой жидкости, то жидкость смачивает поверхность твердого тела. В этом случае жидкость подходит к поверхности твердого тела под некоторым острым углом ?, характерным для данной пары жидкость – твердое тело. Угол ? называется краевым углом. Если силы взаимодействия между молекулами жидкости превосходят силы их взаимодействия с молекулами твердого тела, то краевой угол ? оказывается тупым (рис. 3.5.5). В этом случае говорят, что жидкость не смачивает поверхность твердого тела. При полном смачивании ? = 0, при полном несмачивании ? = 180°.
65. Развитие представлений о строении биомембран; типы моделей мембран, их научное значение.
Все клетки окружены цитоплазматической мембраной, которая представляет собой функциональную структуру, толщиной в несколько молекулярных слоев, которая ограничивает цитоплазму и большинство внутриклеточных структур, а так же образует единую систему канальцев, складок и замкнутых полостей, расположенных внутри клетки. Толщина редко превышает 10 нм, в этой структуре плотно упакованы липиды и белки, поэтому сухой вес мембраны составляет более ? сухого веса клетки.
В середине XIX века Дюбуа-Реймон впервые сообщил, что между внутренней и внешней поверхностью кожи лягушки имеется разность потенциалов. Моль ввел термин "мембрана" , он изучал цитоплазму клеток растений и выяснил, что она окружена полупроницаемой мембраной. 1877 г. Пфейфер-ботаник, исследуя явление осмоса, пользовался как естественной, так и искусственной мембраной из осадочного ферроцианида. Cu > cходнства между ними > естественная мембрана участвует в явлении осмоса. Позднее стали говорить о генерации биопотенциала мембраны (конец XIX века). 1902 г – Бернштейн – мембранная теория потенциала покоя и потенциала действия > развитие мембранологии. Хаксли, Ходжкин и К0 впервые показала, что потенцилы покоя и действия базируются на избирательной проницаемости мембраны к определенным ионам (К+) – неодинаковое распределение ионов по обе стороны мембраны, в основе чего лежат процессы активного транспорта ионов через мембрану. С участием мембраны связаны: фоторецепция, рецепция, БАВ, передача нервного импульса, синтез ДНК.
Модели биологических мембран
В 1925 году Гортер и Грендел показали, что площадь монослоя липидов, экстрагированных из мембран эритроцитов, в два раза больше суммарной площади эритроцитов. Гортер и Грендел экстрагировали липиды из гемолизированных эритроцитов ацетоном, затем выпаривали раствор на поверхности воды и измеряли площадь образовавшейся мономолекулярной пленки липидов. На основе результатов этих исследований было сделано предположение, что липиды в мембране располагаются в виде бимолекулярного слоя. Это предположение подтвердили исследования электрических параметров биологических мембран (Коул и Кёртис, 1935 год): высокое электрическое сопротивление, порядка 107 Омм2 и большая электроемкость. Вместе с тем имелись экспериментальные данные, которые свидетельствовали о том, что биологическая мембрана содержит в своем составе и белковые молекулы.
В 1935 г. модель Даниэля Доусона – бутербродная модель-унитарная модель био мембран. Липидный бислой – структурная основа. Наружный и внутренний слои – глобулярные белки. Симметричная модель.
Модель Робертсона (середина 60х г). Мембрана представляет собой 3х слойную структуру, средний слой из липидов. Белковые молекулы развернуты на поверхности двойного липидного слоя вследствие электростатических взаимодействий заряженными головками фосфолипидов. Модель Робертсона ассимметрична, так как на наружной поверхности мембраны – гликопротеиды.
В группе моделей предполагается наличие белков матрицы. Модель Лючи (середина 60х г.) – белково-кристаллическая модель.
Модель (1970) сохраняется концепция липидного бислоя, однако этот слой прирастается участками симметрично расположенных белков, они жестко фиксированны пространственно за счет дальнодействующих белок-белковых свойств.
Модель Сенгера и Николсона. 60-70 г. Основа – липидный бислой, в который включены молекулы интегральных и периферических белков.
Жидкомозаичная модель. С ее помощью объясняется проницаемость мембран.
66.Биофизическая характеристика молекулярных компонентов мембран: белков, липидов, углеводов и их комплексов.
Химический состав мембраны
Достаточно высокое содержание липидов, они составляют мембранную матрицу; белки составляют вариабильную часть; углеводы в виде гликопротеидов и гликолипидов. В мембране всегда находится небольшое кол-во воды (важная роль).
Липиды мембраны:
Классификация
I. Классы:
1. Липиды – производные глицерина. Кефалины – фосфодиэтаноламин, Лецитин – фосфатидилхолин.
2. Липиды – производные сфингозина. Сфингомиолин, цереброзиды.
3. Стерины – холестерин, ?-ситостерин, эргостерин, зимостерин и т.д.
4. Минорные липиды - ?-каротин, витамин К.
II. Группы:
1. Нейтральные липиды – холестерин, триглицериды.
2. Цвиттерионы – 2 заряда диполя – фосфотидилэтаноламин, фосфотидилхолин.
3. Липиды – слабые кислоты, фосфотидилсерин.
4. Липиды – сильные кислоты – фосфотидиловые кислоты и сульфокислоты.
Мембранные белки
С трудом поддаются выделению, многие вообще не выделяются без нарушения структуры. Белки в мембране отличаются большим разнообразием. Большинство белков в мембране находятся в виде клубка, 30% белков могут находится на поверхности мембраны в виде спирали. Существует несколько классификаций мембранных белков:
I. Функциональная классификация
1. ферментативные,
2. транспортные,
3. рецепторные,
4. каналообразующие,
5. воротные,
6. структурные.
II. Классификация по локализации по отношению к липидам.
1. интегральные,
2. периферические.
Интегральные белки погружены в мембрану или пронизывают ее насквозь. Периферические белки на поверхности мембраны и слабо связаны с ней – слабые взаимодействия. На поверхности интегральных белков имеется значительно меньше участков, несущих электрический заряд, чем на поверхности периферических белков.
Вандеркой и Капалди 1972 г. – все аминокислоты делятся на полярные, неполярные и промежуточные. Полярность а-к первой группы приняли за 1, полярность а-к второй группы – за 0, полярность а-к третьей группы – за ?. Изучили состав периферических и интегральных белков: 20 видов мембранных белков: средняя полярность всех белков равна 0,46; интегральные белки имеют полярность от 0,3 до 0,4; периферические белки имеют полярность от 0,41 до 0,53.
Периферические белки могут находиться как с внутренней, так и с внешней стороны мембраны. Обычно они связаны с мембраной электростатическими взаимодействиями, то есть значительно слабее, чем интегральные белки. Поэтому многие периферические белки легко удаляются с мембраны.
Углеводы мембран
В связанном виде не встречаются. В состав мембранных углеводов входят следующие сахара:
- Д-галактоза,
- Д-глюкоза,
- ацетилглюкозамин,
- ацетилгалактозамин,
- Д-фруктоза,
- Д-манноза,
- Д-ксилоза.
Родопсин – гликопротеин оболочки сетчатки, состоит из углеводородной цепочки (4%), связанной с белками М=28000 Да. Гликопротеиды являются рецепторами для гормонов, медиаторов, пептидов и др. Большое кол-во гликопротеидов в вирусных оболочках (до 40% оболочки).
Струкрурная организация мембран
Плохо изучена, но внедряется электронная микроскопия, ЯМР, ЭПР.
Мембраны – 3х слойная структура с наружным и внутренним слоем, тонкие, темные до 2,5 нм, внутренний слой между ними светлый до 3,5 нм. Считается, что основой биомембран в большинстве случаев являются мембранные липиды. 1925 г. Грейбель и Гортер описали свойство фосфолипидов самопроизвольное образованием ими угла биомолекулярного слоя с замкнутой поверхностью в водной среде. Липиды образуют шаровидные образования.
В другой работе показано, что такие образования сохраняют устойчивость, если внешний d этой замкнутой поверхности не меннее 30 нм, так как чем меньше d, тем зазоры между головками липидов больше и вода просачивается внутрь замкнутого образования и нарушает стабильность. Стабильность бислоя определяется заряженными головками липидов.
Ассимметричность – 2ух слоев, они могут состоять из разным липидов.
Эритроцитарная мембрана: во внешнем слое много фосфатидилхолина и сфингомиелина, во внутреннем слое много фосфатидилэтаноламина и фосфатидилсерина. Во многих случаях неполярные хвосты содержат цепочки от 10 до 22 атомов С, между которыми могут быть насыщенные и ненасыщенные связи, это обуславливает ряд свойств мембран. Чем больше ненасыщенных связей, тем ниже t0 замерзания липидного бислоя. Внутренний слой бислоя нерыхлый, он содержит множество холестерина, он заполняет пространство между неполярными хвостами, влияет на t0 замерзания бислоя: чем больше холестерина, тем ниже t0 кристаллизации. Холестерин участвует в стабилизации мембран и будет влиять на проницаемость мембран, чем его больше, тем ниже проницаемость мембраны.
Мембранные липиды обладают динамическими свойствами:
- способность липидной молекулы к латеральной диффузии, коэффициент латеральной диффузии равен 3,25*10–8 см/сек. Коэф отражает способность перемещения липидной молекулы вдоль мембраны,
- вращательная диффузия, К=10–9 сек,
- flip-flop переход, липидные молекулы пересекают мембрану, переходя из одного слоя в другой. К=10–3 сек средняя величина, показывающая число переходов – 1 переход в 1000 сек.
Организация мембранных белков
Большая часть мембранных белков находится в виде клубка (?70%), основная часть может разворачиваться на поверхности липидного бислоя вследствие электростатического взаимодействия с липидными головками. В этом случае белки будут расположены на поверхности липидов в виде спирали.
Родоспин, М=28000 Да, форма сферы, d=4 нм, мелкая молекула.
Динамические свойства белков.
1. Латеральная диффузия. все значения для белков с М=100000, К=3*10–10 см/сек. Но белки могут объединяться в кластеры, которые мало подвижны.
2. Вращательная диффузия К=0,34 сек. flip-flop переходы, К=10–4 сек – частота flip-flop перехода
67.Вода как составной компонент биомембран: структура, свойства, биологическая роль.
Вода. С ней связаны многие структурно-функциональные свойства мембран, а так же процессы стабилизации и формирования мембран. Вода входит в состав мембран и делится на свободную, связанную и захваченную. Связанная и свободная вода различается по подвижности молекул воды и растворяющей способности. Наименьшей подвижностью и растворяющей способностью обладает внутренняя связанная вода. Она присутствует в липидной зоне мембран в виде отдельных молекул. Основную часть связанной воды представляет вода гидратных оболочек. Эта вода окружает полярные группы белков и липидов, имеет min подвижность и практически не обладает свойствами растворителя. Свободная вода в порах и каналах. По ней могут перемещаться свободные ионы. Она является хорошим растворителем, подвижная и обладает всеми свойствами жидкой воды. Захваченная вода обладает изотопным движением, характерным для жидкой воды, является хорошим растворителем. Она встречается в центральной зоне мембран, между ее липидными слоями, но эта вода пространственно делится как с внеклеточной жидкостью, так и с цитоплазмой. У нее нет возможности свободно с ними обмениваться.
Особенности строения воды
Вода является средой с большим количеством водородных связей, именно они определяют особые свойства воды:
- ее способность сохранять жидкое состояние в широком диапазоне t0,
- низкую t0 образования льда.
Для льда характерно строго упорядоченное расположение молекул воды, под тетраэдрическими углами. Каждая молекула имеет 4 водородных связи между соседними молекулами. Это рыхлая структура. Когда из льда образуется вода, то эта структура разрушается, в жидкой воде встречаются молекулы с 4,3,2,1 и 0 водородными связями. Водородные связи в жидкой воде характеризуются широким набором углов и длин.
Потенциальная энергия. U вод. связ. жидк. воды – непрерывная функция угла межмолекулярной водородной связи и геометрических характеристик молекулы воды.
Существует несколько моделей структуры воды
1. Разработана Айзенбергом и Кауцманом. Особое внимание обращается на масштаб времени наблюдения за структурой. Удалось обнаружить 3 структуры воды:
1) если сделать снимок с длительностью экспозиции намного меньше, чем период колебаний молекул воды (?<<?кол., ?=2*10–13 c), то мы регистрируем М-структуру, которая характеризуется малой упорядоченностью.
2) если продолжить ?>>?кол., но намного меньше времени вращения тел диффузии t=10–5 с, то удается пронаблюдать К-структуру. Она характеризуется упорядоченным расположением молекул воды, но случайностью ориентации.
3) при ?>>периода вращения диффузии получается Д-структура. Она характеризуется регулярным расположением молекул воды и их правильной, закономерной ориентацией.
2. Кластерная модель Шерага.
Жидкая вода состоит из отдельных молекул и структурно связанных кластеров. Кластеры постоянно распадаются и возникают вновь. Это создает усредненное окружение для каждой отдельно взятой молекулы воды, - слабо учитывает молекулы воды в молекулярных группах.
3. Модель Самойлова
рассматривает структурные изменения воды при различных температурах. Предположим, что во время таяния льда, оторвавшаяся молекула воды заполняет пустоты кристаллической решетки, при этом увеличивается удельный вес. Максимальный удельный вес воды наблюдается при +40С, при более высокой t0 происходит увеличение амплитуды колебаний молекул воды, увеличение занимаемого ею объема и снижению плотности.
Растворимость различных веществ в воде
В воде хорошо растворяются электролиты вследствие высокой диэлектрической проницаемости воды, так же вещества с большим дипольным моментом и вещества, способные образовывать водородные связи с молекулами воды.
Рисунок. Нерастворимые вещества в воде: различные углеводороды, масла, жиры. Это объясняется тем, что контакты между молекулами Н2О–Н2О и С6Н6–О молекулами оказываются более выгодными, чем С6Н6–Н2О. В любой ситуации, когда свободная энергия раствора меньше свободной энергии воды и растворимого вещества, данное вещество хорошо растворяется в воде (и наоборот). Мембранная вода.
Подразделяют на 3 типа в зависимости от осмотической активности, способности растворять вещества и обмениваться с внешней средой.
1. Свободная вода. Подвижная фаза, способная растворять любые химические вещества и
обладающая осмотической активностью. В мембранах находится в ионных каналах.
2. Захваченная вода. Близка к свободной, но локализована между двумя слоями мембраны,
тяжело обменивается с внешней средой и не эффективна при транспорте.
3. Связанная вода (несколько типов).
- вода гидратных оболочек (связывается с белковым компонентом)
- прочно связанная с белковым компонентом ионных каналов.
Состояние мембран зависит от состава липидов и температуры среды.
Температура фазового перехода - температура, мембрана переходит из одного фазового состояния в другое.
68.Типы межмолекулярных взаимодействий в мембранах, их природа и роль в стабилизации мембранных структур.
В реальных условиях не только природные, но часто и искусственные мембраны существенно неоднородны по липидному или белковому составу. В структурной организации стабилизации таких систем наряду с обычными гидрофобными эффектами важное место занимают так называемые липид-белковые и белок-белковые взаимодействия. Эти термины используют для обозначения широкого круга разнообразных, отличающихся по механизмам явлений, которые приводят неравномерному распределению молекулярных компонентов в мембранах — микрогетерогенности мембран.
Липид-липидные взаимодействия. Этот термин обычно используют, чтобы выделить специфические взаимодействия, возникающие в мембранных системах вследствие неоднородности липидного состава. Среди различных факторов, определяющих соотояние липидов в мембранах, наибольшее значение имеют электростатические силы притяжения и отталкивания между заряженными полярными головками, стерические факторы, учитывающие форму молекул липидов и характер расположения их головок и гидрофобных углеводородных хвостов, «сила гидратации», а также водородные связи между головками липидов. Гидратационные силы играют важную роль при взаимодействии фолипидных мембран между собой. Сохранение слоя воды 10-30 А около наружной полярной поверхности препятствует сближению мембран и их непосредственному контакту. Для удаления такого слоя воды необходимо нарушить его состояние и затратить энергию, что собственно и лежит в основе проявления гидратационнах сил. Энергию взаимодействия системы, состоящей из двух липидных компрнентов
А и Б, можно представить в виде парных потенциалов Фаа, Фвв и Фав- Если разность Фав — 1/2(Флл + Фвв) мала, то в системе будет наблюдаться равномерное распределение компонентов А и Б. Когда же потенциалы взаимодействия сильно различаются, становится возможным скомпенсировать уменьшение энтропии за счет возрастания упорядоченности системы. В этом случае следует ожидать неравномерного распределения липидов и расслоения системы. Поскольку основной вклад в энергию взаимодействия липидов в мембранах обусловлен дисперсионным взаимодействием углеводородных цепей, эти эффекты наиболее явно проявляются в мембранах, сформированных из липидов, резко различающихся длиной углеводородных цепей.
Липид-белковые взаимодействия. В основе данных взаимодействий лежат межмолекулярные дисперсионные и электростатические силы, водородные связи или другие эффекты связывания. Липид-белковые взаимодействия и обусловленные ими явления условно классифицируют следующим образом: взаимодействия белок — липидный монослой; взаимодействия белок — липидный бислой; липид-белковые взаимодействия в мембранах, включающие липид-зависимые ферменты. Взаимодействие белков с липидными монослоями обнаруживается при включении в монослои радиоактивно меченных белков (альбумин, цитохром с). Электростатические взаимодействия между белками и монослоем проявляются в виде резкого изменения сорбции белков на заряженных монослоях при отклонении от изоэлектрической точки белков. В опытах с фосфолипазами показано, что электростатические взаимодействия определяют начальные этапы взаимодействия фермент — липидный монослой. Начальные этапы существенно облегчают последующую пра- правильную стереохимическую ориентацию компонентов фермент-субстратного комплекса.
Взаимодействие белок — липидный бислой—высокоспецифичный и многоста- многостадийный процесс, характеризующийся наряду с поверхностной сорбцией внутримем- бранным встраиванием белков. Экспериментальным критерием встраивания белков в липидный бислой обычно служит изменение ионной проницаемости мембран. В модельных экспериментах встраивание мембранных белков в искусственные бислойные системы играет решающую роль в их успешной функциональной реконструкции.
Липид-белковое взаимодействие в мембранах проявляется при образовании внутри мембран специфичного липидного окружения вокруг белковых молекул. Такие липиды называются связанными или аннулярными (от англ. annular — кольцеобразный). В настоящее время, однако, окончательно не решен вопрос о возможности формирования вокруг белков в жидкокристаллических мембранах (при Г > ГфП) специфического липидного окружения, характеризующегося сравнительно медленным обменом с остальными липидами. Тем не менее с помощью метода ЭПР доказано изменение подвижности и характера упаковки углеводородных цепей под влиянием белков. Более того, методами ЭПР, ЯМР, флуоресценции и другими показано, что пертурбирующее действие различных интегральных и периферических белков (цитохром-с-оксидаза, цитохром с, полилизин, миелин, родопсин, белки тилакоидных мембран и др.) распространяется вплоть до четвертого слоя липидов, окружающих молекулу белка.
Белок-белковые взаимодействия. Эти взаимодействия проявляются в мембра- мембранах в виде обратимой внутримембранной агрегации мембранных белков, часто со- сопровождающейся изменением функциональной и ферментативной активности системы. Так, в мембранах эритроцитов равномерно распределены белковые внутри- мембранные частицы, обратимо агрегирующие при значениях рН ниже 5,5. Агрегация чувствительна к составу водной фазы; при возрастании концентрации электролитов и низких значениях рН агрегация приостанавливается. Эта внутримембранная агрегация белковых частиц в эритроцитах коррелирует с изменением распределения поверхностных рецепторов.
69.Физические свойства биомембран. Подвижность компонентов мембраны (вращательное движение, латеральная и вертикальная диффузия).
Физические свойства мембран.
1. подвижность. 3 типа(липидные):
A) круговые/вращательные - поворот молекул липидов вокруг оси. Время поворота 10-9 – 10-12 секунд, (если гидрофильный участок сбалансирован - скорость вращения высокая)
Б) латеральная подвижность - движение в одном из слоев или перемещение молекул происходит в пределах одного мембранного слоя. V= lсp = корень из 4Dt, где D – коэффициент латеральной диффузии - зависит от химической природы липида
Одна молекула липида способна пройти через всю поверхность за 0,4/11 секунд.
B) флип-флоп переходы. Переход с внешнего слоя мембраны на внутренний, половина молекул переходит ~ за 24 часа.
Этими же типами подвижности обладают и белки, но скорость их гораздо меньше. Это обусловлено: большими размерами, жестким взаимодействием с захваченной водой, взаимодействием с липидами и другими белками. Связи:
- Н-Н связи (ион Н+ и любой отрицательнозаряженный ион)
- Ван-дер-Ваальсовы (3 типа)
ориентационные взаимодействия (между постоянными диполями), индуцибельные (одна молекул диполь, вторая не полярна, но поляризуется под действием диполя), возникновение мгновенных диполей.
Липосомы-образуются при добавлении фосфолипидов в полярный растворитель. При этом происходит самопроизвольное формирование бислойных замкнутых структур, так как именно такая структура отвечает состоянию с минимальной энергией. 2 типа.
Мультиламмелярные - имеет несколько слоев- в которых каждый липидный бислой отделен от другого слоем воды (изучали проницаемость, осмотические свойства мембран)
Моноламмелярные - наиболее приближены к настоящим мембранам. можно получить при воздействии ультразвуком на эмульсию с многослойными липосомами
Протеолипосомы - липосомы с включениями белков, участков биологических мембран (можно изучать системы транспорта, каналы).
Для изучения свойства мембран наиболее широко используют двойной липидный бислой.
(тефлоновые планшеты с определёнными порами). По физическим параметрам сходна с любой биологической мембраной.
2 вязкость и упругость Вязкость обеспечивается межмолекулярными взаимодействиями
70. Фазовые переходы в мембранах; факторы, инициирующие фазовые переходы мембран. Жидкие кристаллы в структуре мембран, их свойства.
Природные и искусственные мембранные системы могут находиться в двух основных фазовых состояниях: в виде твердого двумерного кристалла (гель) или в жидкокристаллическом (расплавленном) состоянии. При нормальных физиологических условиях мембраны находятся в жидком состоянии, однако, в отличие от жидкостей, они имеют строгую упорядоченную пространственную структуру. Благодаря таким свойствам состояние мембран называется жидкокристаллическим. С понижением температуры мембраны переходят из жидкокристаллического состояния в твердокристаллическое (гель-состояние). При таком переходе сохраняется общая структура мембраны: липиды по-прежнему образуют двойной слой с обращенными внутрь гидрофобными «хвостами», но порядок в системе еще более возрастает: «хвосты» липидов вытянуты строго параллельно друг другу (рис. 5.7), их колебания ограничены. Толщина мембраны при переходе в твердокристаллическое состояние увеличивается, но за счет уменьшения площади объем мембраны в целом уменьшается. Подвижность липидных молекул в обоих фазовых состояниях существенно отличается. В гель-состоянии липиды способны совершать только совместные колебания или вращательные движения. В жидком состоянии липидные «хвосты» имеют гораздо большую свободу, особенно велика их подвижность в середине мембраны. Молекулы липидов жидкой мембраны могут находиться в двух конформациях: в полностью транс- и в двойной гош-конформации (поворот на +120° относительно транс-конформации) (гош-транс-гош-конформации), в гель-состоянии реализуется только транс-конформация (рис. 5.8). Длина молекулы в гош-конформации меньше, чем в транс-, а ширина, наоборот,— больше; этим объясняется уменьшение толщины и увеличение площади мембраны, приходящейся на один липид, при переходе из гель- в жидкокристаллическое состояние.
Способность липидов жидкокристаллической мембраны переходить в гош-конформации способствует повышению ее проницаемости для некоторых гидрофильных низкомолекулярных соединений, например воды. Если два соседних участка рядом расположенных молекул нахолятся в гош-конформации (рис. 5.9), то образуется так называемый кинк (от англ. kink — изгиб). Кинки способны перемещаться вдоль липидных «хвостов», и случайно оказавшаяся между ними небольшая молекула может таким образом пересечь гидрофобный слой. при фазовых переходах из жидкокристаллического состояния в гель-состояние и обратно в мембранах образуются поры диаметром 2—6 нм. То есть при фазовом переходе увеличивается проницаемость мембраны для ионов и низкомолекулярных соединений, способных проходить через такие поры.
Фазовый переход в мембранах происходит не мгновенно, а на протяжении некоторого температурного интервала. Температурой фазового перехода называется температура, при которой одна половина мембранных липидов находится в жидкокристаллическом состоянии, а другая половина — в твердокристаллическом.
Температура фазового перехода зависит от липидного состава мембран: чем больше в «хвостах» липидов двойных связей (а их число в одном «хвосте» молекулы может колебаться от нуля до четырех), то есть чем больше степень ненасыщенности жирнокислотных остатков, тем ниже температура фазового перехода.
Для мембран, состоящих из насыщенных липидов, эта величина составляет +60°С, а для мембран, состоящих из ненасыщенных липидов, — снижается до –20°С. Такая разница в температурах плавления объясняется тем, что ненасыщенные жирные кислоты, находящиеся в цис-конформации, способствуют удалению друг от друга молекул липидов, и, следовательно, уменьшают силы сцепления между ними (рис. 5.10). Чем слабее взаимосвязь между молекулами, тем ниже температура перехода мембран в жидкую фазу.
Фазовые переходы мембранных липидов носят кооперативный характер, то есть чем большее количество липидов совершило фазовый переход, тем легче это будет сделать остальным. В идеале, если на каком-либо участке одна молекула липида перешла из твердой в жидкокристаллическую фазу, то за этим сразу же последует фазовый переход всех липидов этого участка (закон «все или ничего»). Такой участок называется кооперативной единицей, а число молекул, входящих в него,— размером кооперативной единицы n. Для липидных мембран n может достигать нескольких десятков. Величина n тем больше, чем более однороден химический состав мембран.
Жидк. крист.
Внутреннее строение липидного бислоя в жидких кристаллах отличается от состояния углеводородов в растворе, хотя в обоих случаях эти структуры гидрофобны. Большая часть анизотропного бислоя в жидком кристалле высокоупорядочена и только относительно небольшие участки в середине биолоя жидкоподобны.
71. Биофизическая характеристика мембранных липидов: строение, свойства, классификация
Липиды мембраны:
Классификация
III. Классы:
5. Липиды – производные глицерина. Кефалины – фосфодиэтаноламин, Лецитин – фосфатидилхолин.
6. Липиды – производные сфингозина. Сфингомиолин, цереброзиды.
7. Стерины – холестерин, ?-ситостерин, эргостерин, зимостерин и т.д.
8. Минорные липиды - ?-каротин, витамин К.
IV. Группы:
5. Нейтральные липиды – холестерин, триглицериды.
6. Цвиттерионы – 2 заряда диполя – фосфотидилэтаноламин, фосфотидилхолин.
7. Липиды – слабые кислоты, фосфотидилсерин.
8. Липиды – сильные кислоты – фосфотидиловые кислоты и сульфокислоты.
Липиды обладают свойством амфифильности (или амфипатичности) (амфифильность — в переводе с греческого означает «любящий обоих»), так как имеют в своем составе полярную гидрофильную «головку» и неполярный гидрофобный «хвост», относящиеся друг к другу по длине приблизительно как 1: 4. Благодаря такому строению, в водной среде липиды стремятся расположиться таким образом, чтобы неполярные хвосты контактировали друг с другом, а полярные «головки» — с водой. Поэтому липиды в гидрофильной среде самопроизвольно формируют двойной слой (бислой): внутри оказываются гидрофобные участки, а снаружи — гидрофильные. Такая организация липидных молекул отвечает состоянию с наименьшим значением потенциала Гиббса. Образовавшийся билипидный слой не образует краев, а стремится замкнуться на себя. Так, например, образуются липосомы.
Подобное строгое пространственное расположение молекул в мембране во многом определяет ее физические свойства. Мембраны имеют высокое удельное электрическое сопротивление (порядка 107 Ом • м2) и высокую удельную емкость (приблизительно 0,5 • 10-2 Ф/м2). Диэлектрическая проницаемость мембранных липидов равна 2.
Большинство фосфолипидов имеют два жирнокислотных остатка. Такие липиды имеют форму, близкую к цилиндру. Если же в липиде одна из двух жирных кислот отсутствует, например в результате перекисного окисления липидов или действия некоторых фосфолипаз, то молекула напоминает конус. В водном растворе такие липиды образуют мицеллы (рис. 5.3), а в мембране — гидрофильные поры (рис. 5.1), через которые способны проходить молекулы воды и ионы, для которых в норме проницаемость мембраны крайне мала. Изменение проницаемости мембраны для веществ может привести к нарушению функционирования и гибели клетки. Ионизирующее излучение усиливает процессы перекисного окисления липидов, а следовательно, способствует образованию пор, что является одним из механизмов поражения клетки при воздействии излучения.
Мембраны содержат большое число различных белков. Их количество так велико, что поверхностное натяжение мембраны ближе к величине поверхностного натяжения на границе раздела «белок—вода» (? ~ 10–4 Н/м), чем «липид—вода» (? ~ 10–2 Н/м). Концентрация мембранных белков зависит от вида клетки. Например, в миелиновой оболочке аксона белков в 2,5 раза меньше, чем липидов, а в эритроцитарной мембране, наоборот,— белков в 2,5 раза больше (рис. 5.4). Одни белки находятся на поверхности мембраны (периферические белки), другие частично погружены в липидный слой или пронизывают мембрану насквозь (интегральные белки).
Мембранные липиды обладают динамическими свойствами:
- способность липидной молекулы к латеральной диффузии- перемещение молекул происходит в пределах одного мембранного слоя, коэффициент латеральной диффузии равен 3,25*10–8 см/сек. Коэф отражает способность перемещения липидной молекулы вдоль мембраны,
- вращательная диффузия, К=10–9 сек,
- flip-flop переход, липидные молекулы пересекают мембрану, переходя из одного слоя в другой. К=10–3 сек средняя величина, показывающая число переходов – 1 переход в 1000 сек.
Струкрурная организация мембран
Плохо изучена, но внедряется электронная микроскопия, ЯМР, ЭПР.
Мембраны – 3х слойная структура с наружным и внутренним слоем, тонкие, темные до 2,5 нм, внутренний слой между ними светлый до 3,5 нм. Считается, что основой биомембран в большинстве случаев являются мембранные липиды. 1925 г. Грейбель и Гортер описали свойство фосфолипидов самопроизвольное образованием ими угла биомолекулярного слоя с замкнутой поверхностью в водной среде. Липиды образуют шаровидные образования.
В другой работе показано, что такие образования сохраняют устойчивость, если внешний d этой замкнутой поверхности не меннее 30 нм, так как чем меньше d, тем зазоры между головками липидов больше и вода просачивается внутрь замкнутого образования и нарушает стабильность. Стабильность бислоя определяется заряженными головками липидов.
Ассимметричность – 2ух слоев, они могут состоять из разным липидов.
Эритроцитарная мембрана: во внешнем слое много фосфатидилхолина и сфингомиелина, во внутреннем слое много фосфатидилэтаноламина и фосфатидилсерина. Во многих случаях неполярные хвосты содержат цепочки от 10 до 22 атомов С, между которыми могут быть насыщенные и ненасыщенные связи, это обуславливает ряд свойств мембран. Чем больше ненасыщенных связей, тем ниже t0 замерзания липидного бислоя. Внутренний слой бислоя нерыхлый, он содержит множество холестерина, он заполняет пространство между неполярными хвостами, влияет на t0 замерзания бислоя: чем больше холестерина, тем ниже t0 кристаллизации. Холестерин участвует в стабилизации мембран и будет влиять на проницаемость мембран, чем его больше, тем ниже проницаемость мембраны.
Мембранные липиды обладают динамическими свойствами:
- способность липидной молекулы к латеральной диффузии, коэффициент латеральной диффузии равен 3,25*10–8 см/сек. Коэф отражает способность перемещения липидной молекулы вдоль мембраны,
- вращательная диффузия, К=10–9 сек,
- flip-flop переход, липидные молекулы пересекают мембрану, переходя из одного слоя в другой. К=10–3 сек средняя величина, показывающая число переходов – 1 переход в 1000 сек.
72.Искусственные мембраны, их строение, классификация, теоретическое и практическое значение. Отличие от природных мембран.
Искусствен мембраны, их строение, классификация, теоретическое и практическое значение. Отличие от природных мембран.
Искусственная мембрана обычно представляет собой жесткую селективно-проницаемую перегородку, разделяющую массообменный аппарат на две рабочие зоны, в которых поддерживаются различные давления и составы разделяемой смеси.
Мембраны могут быть выполнены в виде плоских листов, труб, капилляров и полых волокон. Мембраны выстраиваются в мембранные системы. Наиболее распространенные искусственные мембраны — полимерные мембраны. При определённых условиях, преимущественно могут быть использованы керамические мембраны.
Некоторые мембраны работают в широком диапазоне мембранных операций, таких, как микрофильтрация, ультрафильтрация, обратный осмос, первапорация, сепарация газа, диализ или хроматография. Способ применения зависит от типа функциональности включеной в мембрану, которые могут быть основаны на изоляции по размеру, химическом родстве или электростатике.
73. Монослой на границе раздела фаз. Липосомы и протеолипосомы. Бислойные липидные мембраны.
Для изучения многих свойств мембран, таких, как проницаемость для различных веществ (в том числе и лекарств), электропроводность, механизм формирования трансмембранных потенциалов и других, удобно использовать не природные, а искусственные мембраны. Последних существует несколько видов.
Известно, что липиды, нанесенные на поверхность воды, не смешиваются с ней, а образуют пленку. При нанесении некоторого количества липидов на поверхность воды можно получить мономолекулярный слой. Благодаря свойству амфифильности, на границе раздела вода — воздух гидрофильные «головки» липидов обращены к воде, а гидрофобные «хвосты» — в воздух.
Такие мономолекулярные слои удобно использовать для изучения механических свойств мембран, подвижности и упаковки мембранных молекул, всевозможных процессов, протекающих на границе раздела фаз, а также действия лекарств. Монослои готовят не только из искусственных липидов, но и из липидов природных мембран как здоровых, так и патологических клеток, что позволяет проводить ряд биологических исследований. Известно, что некоторые физические (например изменение температуры) и химические (например действие некоторых анестетиков) воздействия способны изменить величину площади, занимаемой одной молекулой фосфолипида. Монослои позволяют относительно несложными методами измерить величину этого изменения.
На способности липидов образовывать мономолекулярные слои на границе раздела гидрофобной и гидрофильной фаз основано действие моющих средств. Мыло состоит из липидных молекул, которые в воде окружают засаленные участки отмываемой поверхности. Гидрофобные фрагменты загрязнений оказываются внутри капсулы, окруженной монослоем из молекул мыла. Снаружи такая капсула имеет гидрофильные группы и поэтому легко смывается водой.
Монослои имеют существенный недостаток: они состоят из одного слоя липидов, в то время как природные мембраны образованы двумя слоями. Этого недостатка лишены такие искусственные мембранные структуры, как липосомы и плоские бислойные липидные мембраны.
Липосомы образуются при добавлении фосфолипидов в полярный растворитель. При этом происходит самопроизвольное формирование бислойных замкнутых структур, так как именно такая структура отвечает состоянию с минимальной энергией. Как правило, спонтанно образуются многослойные (мультиламеллярные) липосомы, в которых каждый липидный бислой отделен от другого слоем воды. Толщина билипидных слоев составляет 6,5—7,5 нм, в зависимости от природы липидов. Монослойные (моноламеллярные) липосомы можно получить при воздействии ультразвуком на эмульсию с многослойными липосомами. Липосомы, полученные этим методом, не очень удобны для исследований, так как слишком малы (диаметр 20—40 нм). В настоящее время существуют методы для получения липосом большего размера (диаметром до 400 нм и более). Липосомы могут образовывать и природные мембраны при действии на них разрушающих факторов (ультразвук, механические воздействия).
В состав мембраны липосом, кроме липидов, могут быть включены белки, а также небольшие фрагменты природных мебран. Липосомы, содержащие белки, называются протеолипосомами. Они широко применяются для исследования мембран. Липосомы позволяют, изменяя липидный и белковый состав, смоделировать цитоплазматические мембраны митохондрий, мембраны эндоплазматического ретикулума и других органелл клетки. С помощью липосом можно определить проницаемость мембраны для того или иного лекарственного препарата. Для этого липосомы получают в растворе, содержащем изучаемый препарат. Часть препарата оказывается внутри липосом, после этого оставшуюся часть выводят из окружающего раствора и по количеству препарата, просачиваемого из липосом в раствор за определенное время, определяют скорость его выхода.
Липосомы можно использовать не только в научных исследованиях, но и на практике. При введении внутрь липосомы лекарственного препарата облегчается его доставка и проникновение в ткани или органы. Состав липосомальных липидов можно подобрать таким образом, что такая оболочка будет совершенно не токсична. В косметологии, например, в состав кремов включают липосомы, содержащие биологически активные вещества. Рассматривается возможность введения инсулина с помощью липосом. Билипидная оболочка защитит белковую молекулу инсулина от действия ферментов пищеварительного тракта. Это позволит вводить инсулин перорально, а не с помощью инъекций.
Иногда требуется доставить препарат именно в данный орган или определенный участок органа. Известно, что каждый класс клеток организма имеет на своей мембране среди множества белков отличительные белки (антигены), свойственные только этим клеткам. К каждому антигену существует комплементарная молекула (антитело), способная взаимодействовать только со «своим» антигеном. Если такое антитело включить в билипидную оболочку липосомы, то, случайно оказавшись (с током крови) возле нужного антигена, к клетке прикрепится антитело, а с ним — и липосома с лекарством. Однако подобные методы терапии еще только разрабатываются.
Плоские бислойные липидные мембраны (БЛМ) можно получить, если на небольшое отверстие диаметром около 1 мм в тонкой фторопластовой пластине, помещенной в воду, нанести каплю углеводородного (например гептанового) раствора липида. Растворитель диффундирует в раствор, образуется толстая липидная пленка, которая самопроизвольно утончается в течение 5— 20 мин до тех пор, пока не получится билипидная мембрана толщиной 5—7 нм. Утончению пленки способствуют силы поверхностного натяжения и силы Ван-дер-Ваальса, притягивающие слои воды по обе стороны пленки. Лишние липидные молекулы скапливаются на ободке отверстия в пластиковом стаканчике, образуя торус. БЛМ - хороший объект для изучения электрических, транспортных и других свойств мембран. Например, БЛМ помогли изучить действие антибиотиков валиномицина и грамицидина, а также ряда других лекарственных препаратов, изменяющих проницаемость мембраны.
74. Проблема проницаемости и транспорта веществ через биомембраны. Методы исследования проницаемости.
Проницаемость биологических мембран, важнейшее свойство биологических мембран (БМ), заключающееся в их способности пропускать в клетку и из неё различные метаболиты (аминокислоты, сахара, ионы и т.п.). Проницаемость биологических мембран имеет большое значение для осморегуляции и поддержания постоянства состава клетки, её физико-химический гомеостаз; играет важную роль в генерации и проведении нервного импульса, в энергообеспечении клетки, сенсорных механизмах и др. процессах жизнедеятельности. Проницаемость биологических мембран обусловлена особенностями строения БМ, являющихся осмотическим барьером между клеткой и средой, и служит характерным примером единства и взаимосвязи между структурой и функцией на молекулярном уровне. БМ проницаемы лишь для небольшого числа низкомолекулярных жирорастворимых веществ (глицерин, спирты, мочевина и др.). Такая проницаемость (простая диффузия) играет сравнительно малую роль в процессах переноса веществ через мембраны. Более важные процессы переноса (транслокации) веществ через БМ происходят с участием специфических систем транспорта. Предполагают, что эти системы содержат мембранные переносчики (белки или липопротеиды) и, возможно, ряд др. компонентов, осуществляющих связанные с транспортом функции (например, рецепторные). Переносчик (или их система) связывает переносимое вещество (субстрат) и может перемещаться в мембране. Если переносчики неподвижно фиксированы в БМ, то считают, что в БМ существуют специфические для переносимого вещества поры или каналы. Если переносчик связывается с субстратом путём невалентных взаимодействий (ионными, гидрофобными и др. силами), то такой процесс называется вторичной транслокацией; различают 3 её типа: облегчённая диффузия (унипорт), котранспорт (симпорт) и противотранспорт (антипорт). Механизм облегчённой диффузии не зависит от переноса др. веществ в клетку или из клетки. Этим способом переносится, например, глюкоза в эритроциты. Котранспорт — совместный транспорт двух (или более) веществ в одном направлении. Так, транспорт глюкозы и аминокислот через слизистые оболочки тонкого кишечника сопряжён с транспортом ионов Na+. Механизм противотранспорта подразумевает сопряжение переноса вещества в одном направлении с потоком др. вещества в противоположном направлении. Этим способом осуществляется противоположно направленный перенос ионов Na+ и К+ в нервных клетках . Процессы сопряжённого транспорта (симпорт и антипорт) имеют большое значение в тех случаях, когда переносимое вещество движется против градиента концентрации (из области меньшей в область большей концентрации). Такой активный транспорт, в отличие от пассивного транспорта (по концентрационному градиенту), требует затрат энергии. Энергообеспечение активного транспорта достигается за счёт сопряжения вторичной транслокации с ферментативными реакциями разрыва или образования химических связей. При этом энергия химического превращения расходуется на поддержание осмотического потенциала или асимметрии по обе стороны мембраны. Транспорт веществ через БМ, связанный с разрывом или образованием валентных связей, называется первичной транслокацией. Типичный пример такого процесса — работа «натриевого насоса», сопряжённая с химической реакцией гидролиза богатого энергией аденозинтрифосфата (АТФ), катализируемого ферментом аденозинтрифосфатазой. Гидролиз АТФ сопровождается переносом ионов Na+ из клетки и поступлением в клетку ионов К+; предполагают, что переносчиком ионов К+ является свободный фермент, а ионов Na+ — фосфорилированный фермент, образующийся в ходе гидролиза АТФ. До сих пор не удалось выделить переносчиков из БМ клеток животных. У бактерий четко доказано (главным образом генетическими методами) существование переносчиков — т. н. пермеаз, некоторые из них (например, М-белок — переносчик лактозы у кишечной палочки) выделены в чистом виде. Имеются данные, показывающие, что активный транспорт сахаров и аминокислот у бактерий сопряжён с окислением D-молочной комитеты. У некоторых бактерий обнаружено большое число «связывающих белков», которые, возможно, являются рецепторными компонентами соответствующих транспортных систем.
Проницаемость биологических мембран регулируется гормонами и др., биологически активными веществами. Так, некоторые стероидные гормоны, инсулин и др. увеличивают проницаемость мембран эритроцитов, мышечных и жировых клеток. Проницаемость биологических мембран возбудимых клеток (например, нервных) зависит от особых веществ — медиаторов (ацетилхолин и др.). На Проницаемость биологических мембран для ионов сильно влияют антибиотики (валиномицин, грамицидин, нонактин), а также некоторые синтетические полиэфиры. В исследованиях Проницаемость биологических мембран — одной из важнейших проблем молекулярной биологии — большое значение имеют модельные мембраны: липидные монослои, искусственные двухслойные мембраны, многослойные замкнутые мембраны (липосомы) и т.п. Для изучения Проницаемость биологических мембран широко применяются электро-химические, физические и химические методы
75. Классификация и краткая характеристика типов транспорта веществ через биомембраны.
Большинство процессов жизнедеятельности, таких, как всасывание, выделение, проведение нервного импульса, мышечное сокращение, синтез АТФ, связано с переносом веществ через мембраны. Этот процесс в биологических системах получил название транспорта.
Если перенос вещества происходит с уменьшением электрохимического потенциала, то есть не требует затрат энергии, то такой транспорт называется пассивным. Его разновидностями являются диффузия (перемещение веществ в сторону меньшей концентрации) и фильтрация (просачивание веществ через поры в сторону меньших значений давления). С помощью диффузии в клетку проникают растворенные молекулы кислорода и углекислого газа, а также не свойственные организму соединения, например яды и лекарственные препараты. Примером фильтрации в организме является перенос воды через стенки кровеносных сосудов, выдавливание плазмы крови в почечные канальцы.
Транспорт веществ через липидный бислой с помощью простой диффузии совершается с малой скоростью, особенно в случае заряженных частиц, и почти не контролируется. Поэтому в процессе эволюции для некоторых веществ появились специфические мембранные каналы и мембранные переносчики, которые способствуют повышению скорости переноса и, кроме того, осуществляют селективный (избирательный) транспорт. Пассивный транспорт веществ с помощью переносчиков называется облегченной диффузией.
Иногда требуется перенести вещество из области с меньшим значением электрохимического потенциала в область с большим его значением. Этот процесс не может протекать самопроизвольно и требует затрат энергии. Такой вид транспорта называется активным. Например, в сторону увеличения электрохимического потенциала осуществляется трансмембранный перенос ионов натрия. Если энергия, необходимая для осуществления активного транспорта, берется за счет гидролиза АТФ или окислительно-восстановительных реакций, то такой транспорт называется первично-активным; если — за счет градиента концентраций других ионов, то — вторично-активным или сопряженным.
Через мембрану могут переноситься не только отдельные молекулы, но и твердые тела (фагоцитоз), растворы (пиноцитоз). Если вещество транспортируется внутрь клетки, то такой вид транспорта называется эндоцитозом, если наружу, то — экзоцитозом. В первом случае на наружной стороне мембраны образуется впячивание, постепенно превращающееся в пузырек, который отрывается от мембраны внутри клетки. Такой пузырек (фаго- или пиносома) содержит внутри транспортируемое вещество, окруженное билипидной оболочкой (везикулой). В дальнейшем везикула сливается с какой-нибудь клеточной органеллой (например лизосомой) и выпускает в нее свое содержимое. В случае экзоцитоза процесс происходит в обратной последовательности: везикула подходит к мембране с внутренней стороны клетки, сливается с ней и выбрасывает свое содержимое в межклеточное пространство.
76. Диффузия как тип транспорта веществ через биомембраны; скорость и движущие силы диффузии. Закон Фика.
Диффузия определяется движением молекулярных частиц по направлению концентрационного градиента. Диффузия в физике рассматривается на примере простых моделей. Для полной диффузии необходимо несколько суток. Для био систем скорость диффузии не изменяется, но она осуществляется очень быстро. Процесс диффузии через мембрану изучают на примере:
Скорость диффузии будет определяться количеством вещества, диффундирующем в единицу времени.
Закон Фика.
dQs/dt=Ds*A*dCs/dx
dQs/dt – количесво вещества диффундирующее в единицу времени
Ds – коэффициент диффузии
А – площадь поверхности
dCs/dx – концентрационный градиент (изменение концентрации вещества с расстоянием)
Для скорости диффузии важной величиной является концентрационный градиент. Коэф диффузии зависит от природы и молекулярной массы растворенного вещества и растворителя. Из правого в левый движение хаотичное, но оно не велико. Будут наблюдаться однонаправленные потоки – количество растворенного вещества, пересекающих единицу площади поверхности молекулы за 1 секунду в данном направлении.
Iоднонапр потока = dQs/dt , I измеряется в моль/см2*сек.
Однонаправленный поток вещества в одном направлении не зависит от потока этого же вещества в противоположном направлении.
dQs/dt=P*(C1-C2),
для описания диффузии незаряженных молекул.
Р – проницаемость мембраны,
(C1-C2) – разность между концентрацией вещества 1 и 2.
[C]=моль/см3,
[P]=cм/с.
Скорость движения незаряженных молекул является линейной функцией концентрационного градиента. Р является функцией рассматриваемых мембран и диффунцирующего вещества.
Р=Дм*К/х,
Дм коэффициент диффузии вещества внутри мембраны (чем больше вязкость мембраны, тем больше диффузия молекул, тем ниже эта величина). К- коэффициент распределения. х – величина толщины мембраны. Коэффициент проницаемости от 10–12 до 10–2 см/сек эритроцитарный.
Под действием антидиуретического гормона проницаемость мембраны может возрастать в 10 раз.
1. простая диффузия - перенос вещества по градиенту электрохимического потенциала без посредников (осмос, диффузия через бислой или липидные поры, через белковые каналы)
2. облегчённая диффузия - по градиенту с использованием переносчиков (подвижные и неподвижные)
3.фильтрация- Движение раствора через поры под действием градиента давления.
77. Проницаемость клеток для воды, электролитов и неэлектролитов. Физиологическая роль и практическое значение диффузии.
Прохождение воды (2механизма).
1. за счет петель в остатках жирных кислот (вода проходит через гидрофильную головку, попадает в кинки - петли, а далее -> флип-флоп переход и выход на обратной стороне через гидрофильную головку).
2. через аквопорины (г = 0,27 - 0,3 им). Их довольно много, поэтому вода может активно проходить через мембрану.
1748 г. – открытие осмоса. Офицально считается, что открыл Жан-Антуан Молле. Особые свойства мочевого пузыря лягушки. установил, что эта мембрана обладает особым свойством: если по одну сторону чистая вода, по другую растворенные вещества (растворы сахаров). В этих условиях вода начинает активно проникать через мембрану мочевого пузыря в раствор.
Осмос заключается в переходе молекул воды через мембрану по направлениям ее концентрационных градиентов. Наступает равновесие (динамическое) определяется фактором осмотического давления (направление слева направо).
Гидростатическое давление раствора в правом отсеке, когда эти два давления уравновесили друг друга, то мы получим равновесие. Вывод: для того, чтобы измерить осмотическое давление раствора нужно измерить гидростатическое давление во втором отсеке.
В 1877 г. Пфейффер определил количественный показатель осмоса с помощью осмометра (имеет полупроницаемую мембрану – из осадочного ферроцианида Сu). Пфейффер сделал заключение – осмотическое давление пропорционально концентрации растворенного вещества.
Вант-Гофер: в термодинамическом отношении молекулы воды ведут себя подобно молекулам газа.
?=RTS или ?=RT?/V,
? – осмотическое давление,
RT? – количество молей вещества,
R – газовая постоянная,
Т – абсолютная температура,
С – концентрация.
Это выражение справедливо лишь для разбавленных растворов.
Осмотичность:
два раствора, в которых создается одинаковое осмотическое давление по обе стороны мембраны проницаемой только для воды называются изоосмотическими, растворы содержат в единице объема одинаковое число растворенных молекул. Если один из растворов имеет осмотическое давление по отношению к другому, то первый раствор называется гиперосмотически, второй – гипоосмотическим.
Тоничность:
определяется по реакции клеток и тканей на их погружение в раствор; если при погружении в раствор ткань не набухает, не сморщивается, такой раствор называют изотоническим по отношению к ткани. Если при погружении ткань набухает – раствор гипотонический, если ткань сморщивается – раствор гипертонический.
Транспорт неэлектролитов происходит по механизмам диффу¬зии. Поток вещества / в направлении оси х пропорционален градиенту концентрации. Неэлектролиты проникают в гид¬рофобную часть мембраны, или в узкую пору, при условии, что они теряют свою гидратную оболочку. Необходимо затратить определенную энергию, чтобы "оторвать" диполи воды от полярных групп молекулы (-СООН, -ОН, - NH2). Это определяет причину сильной температурной зависимости коэффициента проницаемости мембран для ряда неэлектролитов. Другим видом пассивного транспорта является облегченная диффузия аминокислот и сахаров. Она отличается от простой диффузии высокой специфичностью по отношению к транспортируемому веществу, насыщением скорости диффузии при увеличении концентрации вещества, чувствительностью к действию определенных ингибиторов. Все это говорит о сходстве облегченной диффузии с ферментативными процессами и указывает на участие переносчиков в этом процессе.
Транспорт ионов
Необходимо учитывать и влияние электрических сил.
1. На заряженные частицы (органические и неорганические ионы) действуют 2 силы, определяющие их диффузию через мембрану: концентрационный градиент и электрическая сила (определяется разностью потенциалов). Совокупность этих двух сил составляет электрохимический потенциал.
2. Существует разность потенциалов, уравновешивающая действующий на данный ион концентрационный градиент и предотвращающая трансмембранный перенос данного иона. В этой ситуации будет существовать некоторое состояние равновесия – электрохимическое равновесие, а соответствующие потенциалы мембраны будут называться равновесными потенциалами. Например, на мембране много К+, идет отток К+. Если зарядить внутреннюю поверхность мембраны до –97 мВ, для Na+ равновесный потенциал ? +55 мВ.
3. Диффузия заряженных частиц может происходить против концентрационного градиента, если электрический градиент будет направлен противоположно концентрационному и будет превышать его действие.
Доннановское равновесие
Фредерик Доннан – физико-химик, 1911 г.
Если налить в сосуд с полупроницаемоей перегородкой воды, то в 1 и 2 будет вода. Доннан добавил в первый отсек соль KCl. По прошествии определенного времени концентрации различных ионов в двух отсеках стали равны. Доннан взял соль с органическими ионами, которые не проходят через мембрану. Через некоторое время ионы K+ и Cl– начинают диффунцировать. Наступает ситуация при которой в первом отсеке [K+] больше, чем во втором, в первом отсеке [Cl–] меньше, чем во втором.
Вывод: анион, не проходящий через мембрану оказывает на распределение анионов и катионов, свободно проходящих через мембрану между отсеками.
Такая же ситуация наблюдается и в клетках и в биосистемах. Установленное Доннаном равновесие обусловлено несколькими фактами:
1. Оба отсека по отдельности должны быть электронейтральными, то есть в каждом отсеке число "+" ионов должно быть равно числу "–" ионов.
2. Диффундирующие ионы (K+ и Cl–) пересекают мембрану парами, при этом сохраняется электронейтральность отсеков. Вероятность пересечения мембраны этими ионами определятется произведением их концентраций [K+]*[Cl–].
3. В равновесии скорость диффузии KCl в одном направлении равна скорости диффузии KCl в противоположном направлении. Поэтому [K+]*[Cl–] должно быть одинаковым для обоих отсеков.
Математическое выражение Доннановского равновесия:
[K+]2/[K+]1=([A–]1+[Cl–]1)/[Cl–]2.
78. Облегченная диффузия и транслокация радикалов как типы транспорта веществ через биомембраны; движущие силы, механизмы, биологическая роль.
облегчённая диффузия - по градиенту с использованием переносчиков (подвижные и неподвижные)
Облегчённая диффузия.
Переносчик не фиксирован в мембране и может легко проникать через липидный бислой (валиномицин - перенос К+, наружная часть молекулы гидрофобна>располагается в мембране, внутренняя часть несёт О- группы, которые фиксируют К+).
2. С фиксированным переносчиком.
Передача ионов «по эстафете». Например: системы цитохромов в фотосинтетических структурах. В основном проникают аминокислоты, сахара, азотистые основания и некоторые другие полярные низкомолекулярные вещества. Кинетика облегчённой диффузии сходна с ферментативной.
Отличия облегчённой от простой диффузии.
1. процесс идёт быстрее
2. обладает свойством насыщения
3. наблюдается конкуренция между переносимыми веществами
4. существуют вещества, способные блокировать перенос
Облегченная диффузия. Это говорит, что скорость увеличивается только при относительно низких концентрациях. Это кинетика насыщения.
Причины кинетики насыщения:
1. Связывание проникающей молекулы с определенным участком внутри канала или вблизи него.
2. Основная причина – транспорт вещества через мембрану с помощью молекулы-переносчика:
а) количество молекул-переносчиков ограничено,
б) скорость из реагирования с переносимым веществом так же лимитирована.
Скорость облегченной диффузии достигает max, когда все молекулы переносчика будут заняты транспортируемым веществом.
Транспорт ионов с помощью переносчиков называется индуцированным ионным транспортом, а сам переносчик — ионофором.
Структура ионофора такова, что снаружи он покрыт неполярными группами, благодаря чему ему выгодно находиться в гидрофобной части мембраны; внутри же ионофор имеет полость, покрытую полярными группами, к которым и присоединяются ионы. Известны две разновидности ионных переносчиков. Так называемые подвижные переносчики связываются с ионом, диффундируют с ним через мембрану, высвобождают его по другую сторону и возвращаются обратно. При этом, если переносчик не покидает мембрану, то говорят, что перенос происходит по механизму «малой карусели», как, например, в случае переноса ионов валиномицином; если же переносчик выходит из мембраны во вне- или внутриклеточную жидкость, где и происходит связывание и высвобождение иона, то — по механизму «большой карусели».
Другие переносчики остаются неподвижными относительно мембраны, они формируют мембранные каналы, которые обычно не пронизывают мембрану насквозь. Ионы, пересекая мембрану, вынуждены переходить по цепочке из одной молекулы-переносчика в другую, поэтому такой перенос называется эстафетным. Примером подвижных переносчиков являются антибиотики валиномицин и нигерицин. Молекула имеет циклическое строение. Ее внутренняя полость содержит гидрофильные группы, с которыми способны связываться ионы. Так как переносчик имеет жесткое строение и размер его полости фиксирован, то с валиномицином способны связываться только те ионы, которые стерически соответствуют полости переносчика. Поэтому валиномицин обладает высокой селективностью. Основным ионом, который он переносит, является К+. Меньший по размеру ион натрия хуже взаимодействует с группами, выстилающими полость переносчика, и поэтому переносится в 104 раз медленнее, чем К+.
Транслокация радикалов — активный перенос химически измененных молекул, которые в целом виде не способны проходить через мембрану.
79.Активный транспорт молекул и ионов через биомембраны, его характеристика, свойства и функции.
Активный транспорт. Перенос вещества против концентрационного градиента (из места с меньшим ц в место с большим µ). При этом происходит возрастание свободной энергии>процесс самопроизвольно протекать не может, необходима затрата Е.
Е может быть:
1. макроэргические связи АТФ.
2. ЕОВР реакций
3. Градиент концентрации иона, который при вторичном активном транспорте (симпорте), переносится через мембрану
Например, в сторону увеличения электрохимического потенциала осуществляется трансмембранный перенос ионов натрия. Если энергия, необходимая для осуществления активного транспорта, берется за счет гидролиза АТФ или окислительно-восстановительных реакций, то такой транспорт называется первично-активным; если — за счет градиента концентраций других ионов, то — вторично-активным или сопряженным.
Активный транспорт:1. Первичный.
В его синтез входят 3 насоса, переносящие ионы против градиента концентрации при помощи энергии АТФ.
К данному типу относятся Na+/K+ АТФ-аза. Переносит 3 иона Na из клетки во внешнюю среду, параллельно переносится в клетку 2 иона К+.
Са2+ -АТФ-аза. При гидролизе 1 молекулы АТФ переносится 2 иона Са2+ из клетки во внешнюю среду.
Н+ АТФ-аза. При гидролизе 1 молекулы АТФ из клетки выносится 2 иона Н+. Внешняя часть мембраны заряжена положительно (+), внутренняя - отрицательно (-).
Создание различных типов градиентов:
1. концентрационный (избыток концентрации с внешней стороны мембраны).
2. электрический потенциал.
3. давление.
Существование активного транспорта доказал Уесинг.
В состоянии равновесия при наличии активного транспорта. Уравнение Уссинга-Теорелла.
Jm(вн)\Jm(нар)=Cн\Свв*е^ZE??\RT
Показывает действие активного первичного транспорта.
Основные особенности первично активного транспорта:
1. Осуществляется против концентрационного градиента.
2. Система первичного транспорта в высшей степени специфична (Na система не перекачивает другие ионы).
3. Для его обеспечения необходима АТФ или другие источники энергии (метаболические яды блокируют насос).
4. Обменивает один вид ионов на другой (К-Na насос).
5. Многие виды ионных насосов выполняют электрическую работу, перенося заряды через мембрану (реогенный насос – это насос, при работе которого создается электрический ток).
6. Активный транспорт с помощью ионных насосов избирательно подавляется блокирующими агентами. (Существуют специфические вещества, которые блокируют данный насос, например, убаин – сердечный гликозид. Это вещество конкурентно блокирует участки, связывающие ионы К+.)
7. Энергия, необходимая для первично активного транспорта, высвобождается при гидролизе АТФ ферментами, расположенными в мембране
Активность ферментов зависит от концентрации ионов.
2. Вторичный активный транспорт.
Движущей силой является градиент концентрации ионов (унипорт, симпорт, антипорт), энергия ОВР. В переносе участвуют различные переносчики (одно-, двуместные>два центра связывания)
унипорт - переносчик с 1 центром связывания с ионом. Идёт закачка против концентрационного градиента в одном направлении. Движущая сила - энергия ОВР, транспортируются аминокислоты и некоторые другие соединения.
тип: антипорт - молекулярный переносчик с 2 центрами связывания для ионов. Движущая сила - градиент концентрации для одного из ионов. 1 - закачка по градиенту, 2 - против градиента.
тип: симпорт - участвуют переносчики с 2 активными центрами для 2 разных ионов. Движение К+ и А- идёт в одном направлении. Движущей силой является концентрационный градиент одного из ионов. Так при симпорте с Н+ транспортируются отрицательно заряженные аминокислоты, жирные кислоты, спирты и некоторые другие соединения.
80. Сходcтва и отличия активного транспорта и облегченной диффузии веществ через биомембраны. Доказательства наличия активного транспора в условиях in vitro.
Механизмы пассивного транспорта через мембраны
Пассивный транспорт осуществляется главным образом тремя способами:
1. Вещества, находящиеся в водной фазе по одну сторону мембраны, растворяются в липидно-белковом слое мембраны, пересекают его и вновь переходят в водную фазу с противоположной стороны мембраны.
2. Вещества, которые перемещаются через поры или каналы мембраны, заполненные водой.
3. Молекулы транспортируемого вещества соединяются с молекулой переносчиком, встроенным в мембрану и переносчик опосредует или облегчает транспорт – этот транспорт называют облегченной или опосредованной диффузией. Молекулы переносчика всегда жирорастворимы, они ускоряют транспорт веществ по их концентрационному или электрохимическому градиенту.
Облегченная диффузия. Это говорит, что скорость увеличивается только при относительно низких концентрациях. Это кинетика насыщения.
Причины кинетики насыщения:
1. Связывание проникающей молекулы с определенным участком внутри канала или вблизи него.
2. Основная причина – транспорт вещества через мембрану с помощью молекулы-переносчика:
а) количество молекул-переносчиков ограничено,
б) скорость из реагирования с переносимым веществом так же лимитирована.
Скорость облегченной диффузии достигает max, когда все молекулы переносчика будут заняты транспортируемым веществом.
Теория облегченной диффузии напоминает теорию субстрат-связывающего комплекса. Данный вид транспорта можно ингибировать с помощью химических аналогов транспортируемого вещества.
Активный транспорт. Перенос вещества против концентрационного градиента (из места с меньшим ц в место с большим µ). При этом происходит возрастание свободной энергии>процесс самопроизвольно протекать не может, необходима затрата Е.
Активный транспорт:1. Первичный.
В его синтез входят 3 насоса, переносящие ионы против градиента концентрации при помощи энергии АТФ.
К данному типу относятся Na+/K+ АТФ-аза. Переносит 3 иона Na из клетки во внешнюю среду, параллельно переносится в клетку 2 иона К+.
2. Вторичный активный транспорт.
Движущей силой является градиент концентрации ионов (унипорт, симпорт, антипорт), энергия ОВР. В переносе участвуют различные переносчики (одно-, двуместные>два центра связывания)
Механизмы первично активного транспорта
Энергия клеточного механизма концентрируется в виде АТФ. Существуют специальные мембранные насосы, их совокупность – первично активный транспорт. Источник энергии – клеточный метаболизм, если отключить источник энергии, то ионы расположатся равномерно, относительно мембраны. Концентрационный градиент направлен внутрь клетки, ионы Na пассивно поступают внутрь клетки. Но концентрационный градиент постоянен, так как ему противостоят Na насосы.
Основные особенности первично активного транспорта:
1. Осуществляется против концентрационного градиента.
2. Система первичного транспорта в высшей степени специфична (Na система не перекачивает другие ионы).
3. Для его обеспечения необходима АТФ или другие источники энергии (метаболические яды блокируют насос).
4. Обменивает один вид ионов на другой (К-Na насос).
5. Многие виды ионных насосов выполняют электрическую работу, перенося заряды через мембрану (реогенный насос – это насос, при работе которого создается электрический ток).
6. Активный транспорт с помощью ионных насосов избирательно подавляется блокирующими агентами. (Существуют специфические вещества, которые блокируют данный насос, например, убаин – сердечный гликозид. Это вещество конкурентно блокирует участки, связывающие ионы К+.)
7. Энергия, необходимая для первично активного транспорта, высвобождается при гидролизе АТФ ферментами, расположенными в мембране
Механизм вторично активного транспорта
заключается в переносе веществ через мембрану против концентрационного градиента, обеспечиваемом энергией, которая высвобождается при переносе другого вещества по градиенту. То, что транспортируется по градиенту, называется синпортом, или ко-транспорт. Пример, транспорт а-к или сахаров через био мембраны.
Транспорт в клетки аланина.
В присутствии внеклеточных ионов Na+ транспорт аланина в клетки осуществляется до тех пор, пока внутриклеточная концентрация Na+ будет в 7-10 раз больше внеклеточной. Если во внеклеточной среде Na+ отсутствует, то концентрация аланина внутри клетки не отличается от внеклеточной.
Скорость транспорта в двух случаях одинакова. Внеклеточный Na+ оказывает непосредственное влияние на транспорт аланина (различный наклон графиков). Если повысить внутриклеточную концентрацию Na+, то аланин из клетки будет выходить во внеклеточную среду. Вторично активный транспорт не зависит от концентрации Na+ вне клетки, а зависит от концентрации градиента ионов Na+. Градиент Na+ является движущей силой, промежуточной стадией в процессе использования энергии (в системе вторично активного транспорта).
81. Транспортные АТФ -азы, их классификация и роль в активном транспорте ионов. Представление о бионасосах.
Активный транспорт. Перенос вещества против концентрационного градиента (из места с меньшим ц в место с большим µ). При этом происходит возрастание свободной энергии>процесс самопроизвольно протекать не может, необходима затрата Е.
Е может быть:
1. макроэргические связи АТФ.
2. ЕОВР реакций
3. Градиент концентрации иона, который при вторичном активном транспорте (симпорте), переносится через мембрану
Активный транспорт:1. Первичный.
В его синтез входят 3 насоса, переносящие ионы против градиента концентрации при помощи энергии АТФ.
К данному типу относятся Na+/K+ АТФ-аза. Переносит 3 иона Na из клетки во внешнюю среду, параллельно переносится в клетку 2 иона К+.
Са2+ -АТФ-аза. При гидролизе 1 молекулы АТФ переносится 2 иона Са2+ из клетки во внешнюю среду.
Н+ АТФ-аза. При гидролизе 1 молекулы АТФ из клетки выносится 2 иона Н+. Внешняя часть мембраны заряжена положительно (+), внутренняя - отрицательно (-).
Циклы работы АТФ-аз.
1. Основная роль в создании потенциала покоя мембраны принадлежит Na+/K+ АТФ-азе. Представляет собой 2 взаимодействующих белка (2-суьединичные). Крупные субъединицы обращены во внутреннюю среду клетки. М=84кДа. Обладает ферментативной активностью. Малые субъединицы АТФ-азной активностью не обладают. Обе с/е имеют по 1 центру связывания Na+/K+. В исходном состоянии большая с/е обладает большим сродством к Na+, а малая к К+.
1-цикл.
1. в исходном состоянии к малым с/е присоединяются 2 иона К+ из среды, а большие - 3 Na+ с внутренней стороны мембраны. Присоединение Na+ приводит к активации ферментативной активности. Происходит гидролиз АТФ, остаётся -РО4, который присоединяется к большой субъединице, неся 3 атома О2 (то есть отрицательный заряд). Приводит к напряжению данной субъединицы>стремление снять напряжение>конформационное изменение>центр связывания с ионом становится ближе к внешней стороне мембраны -> изменение конформации малой субъединицы (оба центра связывания располагаются друг напротив друга).
2- цикл
Изменение конформации приводит к изменению сродства к ионам>у большой с/е увеличивается сродство к К+, а у малой - к Na+. Большая присоединяет 2 иона К+, малая - 3Na+>меняется заряд>напряжение в белковой молекуле>обратное изменение конформации>исходное состояние (большая внутрь, малая наружу). Отщепляется остаток НЗРО4>сродство молекул возвращается в исходное состояние.
В центре связывания 12 атомов О.
Первый присоединившийся ион определяет дальнейшие события.
Са2+ -АТФ-аза.
1 интегральный белок Обладающий АТФ-азной активностью центр связывания и каталитический центр во внутренней среде клетки. В исходном состоянии центр связывания обладает сродством к Са2+. Цикл работы схож с Na+/K+.
Н+ АТФ-аза.
Состоит из 1 белка, перенос Н+ против градиента. Присоединение Н+ с внутренней стороны мембраны.
Механизмы первично активного транспорта
Энергия клеточного механизма концентрируется в виде АТФ. Существуют специальные мембранные насосы, их совокупность – первично активный транспорт. Источник энергии – клеточный метаболизм, если отключить источник энергии, то ионы расположатся равномерно, относительно мембраны. Концентрационный градиент направлен внутрь клетки, ионы Na пассивно поступают внутрь клетки. Но концентрационный градиент постоянен, так как ему противостоят Na насосы.
Основные особенности первично активного транспорта:
1. Осуществляется против концентрационного градиента.
2. Система первичного транспорта в высшей степени специфична (Na система не перекачивает другие ионы).
3. Для его обеспечения необходима АТФ или другие источники энергии (метаболические яды блокируют насос).
4. Обменивает один вид ионов на другой (К-Na насос).
5. Многие виды ионных насосов выполняют электрическую работу, перенося заряды через мембрану (реогенный насос – это насос, при работе которого создается электрический ток).
6. Активный транспорт с помощью ионных насосов избирательно подавляется блокирующими агентами. (Существуют специфические вещества, которые блокируют данный насос, например, убаин – сердечный гликозид. Это вещество конкурентно блокирует участки, связывающие ионы К+.)
7. Энергия, необходимая для первично активного транспорта, высвобождается при гидролизе АТФ ферментами, расположенными в мембране
Активность ферментов зависит от концентрации ионов.
Современная гипотеза первично активного транспорта
K-Na-АТФаза – молекула из двух субъединиц, имеющих внутренние полости: ?-большая субъединица (полипептид), ?-малая субъединица (гликопротеид). ? обладает высоким сродством к Na +, ? - к К+. Полость ?-субъединицы заполняется 3 ионами Na+, полость ?-субъединицы заполняется 2 ионами К+. Потом у ?-субъединицы сродство к Na+ падает, а у ?-субъединицы сродство к К+ возрастает.
За счет флуктуации происходит пространственное совмещение полостей субъединиц и обмен ионами. В конце цикла полости открываются, и ионы их покидают.
Другая гипотеза. В начале происходит заполнение полостей описанным выше способом, затем поворот K-Na-АТФазы на 1800. После чего ионы покидают полости, а K-Na-АТФаза опять поворачивается на 1800. Если молеула постоянно переворачивается, то это должно привести к перестройке молекулярного слоя – спорный момент.
83. Биоэлектрические явления: общая характеристика, классификация
Биоэлектрические явления
Начало изучения электрических явлений, возникающих в живых тканях, относится ко 2-й половине 18 в., когда было обнаружено, что некрые рыбы (электрический скат, электрический угорь) при охоте используют электрические разряды, оглушая и обездвиживая свою добычу. Было высказано предположение, что распространение нервного импульса представляет собой течение вдоль нерва особой «электрической жидкости». В 1791—1792 гг. итал. ученые Л. Гальвани и А. Вольта первые дали научное объяснение явления «животного электричества». Своими, ставшими уже классическими, опытами они достоверно установили факт существования в живом теле электрич. явлений. Позже Б. я. были обнаружены и в растительных тканях. С позиций современных представлений о Б. я. ясно, что все процессы жизнедеятельности неразрывно связаны с различными формами Б. я. В частности, Б. я. обусловливают возникновение возбуждения и его проведение по нервным волокнам, являются причиной процессов сокращения мышечных волокон скелетных, гладких и сердечных мышц, выделительной функции железистых клеток и т. д. Б. я. лежат в основе процессов всасывания в жел.-киш. тракте, в основе восприятия вкуса, запаха (см. Обоняние), в основе деятельности всех анализаторов и т. д. Нет физиологич. процесса в живом организме, к-рый в той или иной форме не был бы связан с Б. я.
Но что же такое собственно Б. я., откуда они берутся, каково их участие в процессах жизнедеятельности?
Для облегчения понимания сущности Б. я. любой живой организм можно представить в виде сложной смеси жидкостей и различных химич. соединений. Многие из этих соединений (и поступающие в организм в виде пищи, и выделенные из него в процессе обмена веществ, и промежуточные вещества, образующиеся при обмене веществ) находятся в виде положительно или отрицательно заряженньгх частиц — ионов. Перераспределение этих ионов и их транспорт, постоянно имеющие место в процессе Жизнедеятельности,— вот причина возникновения Б., я. На практике все Б. я. определяют через разность электрич. потенциалов; между двумя точками живой ткани, к-рая может быть зарегистрирована спец. электрич. приборами — гальванометрами. С помощью микроэлектродов, напр., можно измерить разность потенциалов между наружной и внутренней сторонами оболочки (мембраны) клетки. Эту разность потенциалов называют потенциалом покоя, или мембранными потенциалом. Наличие его обусловлено неравномерным распределением ионов (в первую очередь ионов натрия и калия) между внутренним содержимом клетгки (ее цитоплазмой) и окружающей клетку средой. Величина мембранного потенциала различна: для нервной клетки она составляет 60—80 милливольт (.мв), для поперечнополосатых мышечных волокон — 80—90 мв, для воло- кон сердечной мышцы — 90—95 мв, причем для каждого типа клетки в покое величина потенциала строго определенная и отражает интенсивность обменных процессов, протекающих в этой клетке. В возбужденной клетке регистрируется еще один вид потенциала — так наз. потенциал действия, к-рый, в отличие от потенциала покоя, передвигается в форме волны возбуждения по поверхности клетки со скоростью до нескольких десятков метров в секунду. В каждом возбужденном участке потенциал приобретает обратный знак. Возникновение потенциала действия связано с избирательным увеличением проницаемости клеточной мембраны для ионов натрия. Существуют и другие виды потенциалов, в частности так наз. потенциал повреждения, или демаркационный потенциал. Этот вид электрич. активности регистрируется между поврежденным и интактным (неповрежденным) участками ткани. Можно предположить, что его возникновение как бы стимулирует восстановительные (регенерационные) резервы клетки (ткани).
Б. я. (по крайней мере те, к-рые мы только что рассмотрели) исторически возникли как способ более совершенной связи между отдельными образованиями многоклеточного организма. Действительно, фактически существуют лишь две формы «общения» между клетками. Первая — наиболее древняя — связана с химич. взаимодействием, при к-ром вещество, продуцируемое одной клеткой, достигает другую клетку и вызывает в ней ответную реакцию. Эти вещества мы называем медиаторами, а в том случае, когда они передаются в пределах организма в целом на большие расстояния, их традиционно называют гормонами. Но такой способ общения не обеспечивает возможность быстрой передачи информации (напр., при необходимости отдернуть руки при внезапном прикосновенли к огню). Поэтому природой был выработан другой, более совершенный способ сигнализации и передачи информации — с помощью электрич. импульсов, возникающих в клетке. Особенно отчетливо выражен этот способ в деятельности центральной нервной системы высших животных и человека. Живой организм является не только генератором биопотенциалов, но и проводником электрич. тока, причем изменение степени электропроводности живых тканей в зависимости от их жизнедеятельности может служить показателем жизнеспособности (состояния) клеток или тканей. Особой формой Б. я. служит так низ, электрокинетический потенциал, возникающий, напр., при движении крови по кровеносным сосудам. В этом случае появляется разность потенциалов между стенкой сосуда и движущейся кровью. Величина этого потенциала изменяется при некрых патологич. состояниях, что может быть использовано в диагностич. целях.
Возникновением различных форм биоэлектрич. активности сопровождается любой акт жизнедеятельности (мышечное сокращение, работа головного мозга, деятельность сердца и т. д.). Регистрация их с помощью спец. аппаратуры расширяет наши возможности в изучении возникновения многих болезней, позволяет диагностировать их. При помощи записи и анализа суммарной электрич. активности головного мозга проводят диагностику некрых нервных и психич. заболеваний. На основе изучения электрич, активности сердца определяют многие болезни сердечнососудистой системы и т. д. На основе Б. я., протекающих в мышцах, созданы биоэлектрич. протезы верхних и нижних конечностей.
84. Механизм возникновения электродных и ионных биопотенциалов, их измерение. Формула Нернста.
ЭЛЕКТРОДНЫЙ ПОТЕНЦИАЛ - разность электростатич. потенциалов между электродом и находящимся с ним в контакте электролитом. Возникновение ЭП обусловлено пространств. разделением зарядов противоположного знака на границе раздела фаз и образованием двойного электрического слоя. На границе между металлич. электродом и р-ром электролита пространств. разделение зарядов связано со след. явлениями: переносом ионов из металла в р-р в ходе установления электрохим. равновесия, кулоновской адсорбцией ионов из р-ра на пов-сть металла, смещением электронного газа за пределы положительно заряженного ионного остова кристаллич. решетки, специфич. (некулоновской) адсорбцией ионов или полярных молекул р-рителя на электроде и др. Последние два явления приводят к тому, что электродный потенциал не равен нулю даже при условиях, когда заряд пов-сти металла равен нулю.
Абс. величину электродного потенциала отдельного электрода определить невозможно, поэтому измеряют всегда разность потенциалов исследуемого электрода и нек-рого стандартного электрода сравнения. Электродный потенциал равен электродвиж. силе электрохим. цепи, составленной из исследуемого и стандартного электродов (диффузионный потенциал между разными электролитами, обусловленный различием скоростей движения ионов, при этом должен быть устранен). Для водных р-ров в качестве стандартного электрода обычно используют водородный электрод, потенциал к-рого при давлении водорода 0,101 МПа и термодинамич. активности а ионов Н+ в р-ре, равной 1, принимают условно равным нулю (водородная шкала электродных потенциалов). Если исследуемый электрод находится в стандартных условиях, когда активности всех ионов, определяющих электродный потенциал, равны 1, а давление газа (для газовых электродов) равно 0,101 МПа, значение электродного потенциала наз. стандартным (обозначение E°).
Оно связано со стандартным изменением энергии Гиббса ?G и константой равновесия Кр электрохим. р-ции ур-нием: - ?G=nFE?=RTlnKp, где F - число Фарадея; n - число электронов, участвующих в р-ции; R - газовая постоянная; Т - абс. т-ра. Значения E° электрохим. систем по отношению к водородному электроду и протекающие на электродах р-ции сведены в спец. таблицы
Зависимость электродного потенциала от термодинамич. активностей ai участников электрохим. р-ции выражается Нернста уравнением:
E=E?-RT\nF?vi ln ai
где vi - стехиометрич. коэф. участника р-ции, причем для исходных в-в это отрицат. величина, а для продуктов р-ции -положительная.
Если через электрод протекает электрич. ток, электродный потенциал отклоняется от равновесного значения из-за конечной скорости процессов, происходящих непосредственно на границе электрод – электролит.
Ионный потенциал.
Связь иона с молекулами воды (гидратация ионов) зависит не только от заряда иона, но и от размера его радиуса. Прочность связи возрастает с увеличением заряда иона и убывает с увеличением радиуса. Чем выше заряд иона, тем сильнее притягиваются молекулы, но чем больше радиус иона, тем слабее силы этого притяжения. Отношение заряда иона к его радиусу является важным показателем и называется ионным потенциалом. Он имеет существенное значение для оценки способности атомов химических элементов образовывать ионы в водном растворе и способности этих ионов к более или менее продолжительной миграции в природных водах. При большом заряде и незначительном радиусе (т. е. с большим ионным потенциалом) ион отталкивает протоны (катионы водорода в молекулах воды) и образуются хорошо растворимые кислородсодержащие анионы. При небольшом заряде (валентности) и большом радиусе взаимодействие между ионом и молекулами воды слабое, оно не нарушает связей в молекуле и ионы остаются в растворе, окруженные молекулами воды. Таковы катионы щелочных и щелочноземельных металлов с малым ионным потенциалом. В промежуточном случае, когда ион отталкивает лишь по одному протону (катиону водорода в молекуле воды), образуются нерастворимые соединения катиона металла с ОН-группами. Эти соединения выпадают в осадок. Щелочные и щелочноземельные элементы имеют небольшой ионный потенциал. Они долго остаются в растворенном состоянии и мигрируют с водами на большое расстояние. Элементы промежуточной группы должны быстро выпадать в осадок. Элементы с большими ионными потенциалами также хорошо растворимы, как и щелочные, и щелочноземельные элементы.
85. Мембранный потенциал и факторы, определяющие его величину.Передача нервного импульса по миелиновым и немиелиновым нервным волокнам.
Потенциал покоя
это разница потенциалов между цитоплазмой и внеклеточной средой, существующая в каждой живой клетке, находящейся в состоянии покоя. Внутриклеточная среда заряжена отрицательно. Величина ПП может быть различной, зависит от состояния клетки от –15 до –90 мВ у большинства клеток.
Для того, чтобы измерить величину ПП используется микроэлектродная техника. Используется специальный вид электродов, отличающийся намного меньшим диаметром кончика (доли мкм, или 1 мкм). Бывают стеклянные и металлические, по форме напоминают копье, необходим раствор электролита для хорошего проведения электрического тока.
Проведение возбуждения
В 1885 г. Герман предложил теорию малых токов. Осуществляется последовательно между участками волокна. В участке, соседнем с возбужденным будет наблюдаться выход электрического тока.
Кабельная теория нервного волокна: нервное волокно внутри содержит проводящую среду, оболочка нервного волокна имеет слой, который плохо проводит возбуждение. Нервное волокно омывается внеклеточной жидкостью, которая проводит электрический ток.
Эквивалентная электрическая схема нервного волокна
В состоянии покоя внутриклеточная среда имеет избыточный отрицательный заряд. Сила тока меняется с расстоянием от возбужденного сегмента, декремента.
Механизм распространения возбуждения
Возбуждение охватывает последовательно все отделы нервного волокна. R наруж влияет на скорость распространения возбуждения. В экспериментрах Ходжкина изменили внеклеточную среду на масло, которое имеет большее сопротивление, объем снизился на 30-50%. Эксперимент: нерв помещается на параллельные пластинки из серебра, замыкают с помощью ртутной ванночки, объем проведеним растет на 16-30%. Была подтверждена теория местных токов для безмякотных волокон. В мякотных нерных волокнах механизм проведения другой. Миелин имеет рост сопротивления и снижение емкости, миелиновая оболочка прерывается перехватами Ранвье – сальтаторное проведение. R на 1 см2 поверхности в перехвате Ранвье = 10-20 Ом, в миелиновой оболочке = 0,003-0,005 Ом. Петли тока в миелиновых нервных волокнах выходят через невозбужденый перехват Ранвье, находящийся спереди от возбужденного
По немиелинизированному волокну ПД распространяется непрерывно. Проведение нервного импульса начинается с распространением электрического поля. Возникший ПД за счет электрического поля способен деполяризовать мембрану соседнего участка до критического уровня, в результате чего на соседнем участке генерируются новые ПД. Сами ПД не перемещаются, они исчезают там же, где возникают. Главную роль в возникновении нового ПД играет предыдущий.
По миелинизированному волокну ПД распространяется скачкообразно (сальтаторное проведение). Для миелинизированных волокон характерна концентрация потенциалзависимых ионных каналов только в областях перехватов Ранвье; ПД, возникший в одном перехвате Ранвье, за счет электрического поля деполяризует мембрану соседних перехватов до критического уровня, что приводит к возникновению в них новых ПД, то есть возбуждение переходит скачкообразно, от одного перехвата к другому. В случае повреждения одного перехвата Ранвье ПД возбуждает 2-ой, 3-ий, 4-ый и даже 5-ый, поскольку электроизоляция, создаваемая миелиновыми муфтами, уменьшает рассеивание электрического поля. Это увеличивает скорость распространения ПД по миелинизированным волокнам по сравнению с немиелинизированными. Кроме того, миелинизированные волокна толще, а электрическое сопротивление более толстых волокон меньше, что тоже увеличивает скорость проведения импульса по миелинизированным волокнам. Другим преимуществом сальтаторного проведения является его экономичность в энергетическом плане, так как возбуждаются только перехваты Ранвье, площадь которых меньше 1 % мембраны, и, следовательно, необходимо значительно меньше энергии для восстановления трансмембранных градиентов Na+ и K+, расходующихся в результате возникновения ПД, что может иметь значение при высокой частоте разрядов, идущих по нервному волокну.
86. Электрокинетический потенциал: возникновение, измерение и факторы, определяющие его величину. Примеры электрокинетических явлений, их характеристика и научно-практическое значение.
Потенцил Действия
1. Объясняется поворотом диполя на 1800.
2. Теория альтерации Германа. При возбуждении возникает избыток кислых продуктов, которые несут отрицательны заряд, что приводит к разности потенциалов между возбужденным и невозбужденым учаском.
3. Мембранная теория Берштейна. В возбужденном участке мембраны резко увеличивается проницаемость для всех ионов, концентрации ионов смешиваются и участок становится электронейтральным.
4. Ходжкин и Хаксли. Рост проницаемости мембраны для ионов в месте воздействия. При возбуждении электропроницаемость мембраны увеличивается примерно в 500 раз. Max увеличивается проницаемость мембраны для Na+ (отсюда Na-теория ПД). Na+ свободно проходит внуть клетки. При возбужедении электро-химическое равновесие определяется потенциалом Na+. Равновесный потенциал для К+ = –97 мВ, для Na+ = +50 мВ. При возбужедении мембрана перезаряжается. Положение обратной активации и инактивации Na+-каналов, Na+-канал может активироваться (открываться) при определенных значениях потенциала. Причина активации Na+-каналов – деполяризация мембраны, чем больше деполяризация, тем больше проницаемость мембраны для Na+. Зависимость близка к линейной в подкор уровне; как только мембрана достигнет критического уровня деполяризации – зависимость нелинейная, лавинообразный вход Na+ в клетку.
Электрокинетический потенциал, x-потенциал, дзета-потенциал, часть общего скачка потенциала на границе двух фаз, определяющая относительное перемещение этих фаз при электрокинетических явлениях. Общий скачок потенциала при пересечении межфазной границы в дисперсных системах обусловлен существованием двойного электрического слоя. Электрокинетический потенциал — перепад потенциала по той части диффузного слоя, в пределах которой жидкость может быть вовлечена в тангенциальное движение относительно межфазной поверхности при внешнем воздействии на систему. Под влиянием сильно адсорбирующихся на поверхности ионов или изменения pH жидкости может произойти перемена знака на противоположный («перезарядка» поверхности). Электрокинетический потенциал в изоэлектрической точке равен нулю. он является одной из важнейших характеристик жидких коллоидных систем. Его значение и характер изменения при варьировании параметров электролита, адсорбции на пов-сти разл. в-в и т. п. позволяет судить о структуре граничных слоев, особенностях взаимод. компонентов р-ра с пов-стью, заряде пов-сти и т.д.
1). Для объяснения реполяризации используется положение об инактивации Na+-каналов. При приближении потенциала мембраны к равновесному для Na+, Na+-каналы инактивируются и посупление Na в клетку прекращается. К графику: в основе регенеративный процесс (сам себя поддерживающий), развивающийся по принципу обратной связи.
2). Рост К+ проницаемости мембраны. Не столь значителен, как для Na+ ( в 5-15 и 500 раз соответственно). Проницаемость для К+ развивается медленнее, чем для Na+. Ионы К+ в этой ситуации будут выходить наружу и выносить заряд.
3). Механизм активного транспорта, представленный K-Na-насосом. 3 Na+ внутрь и 2 К+ наружу.
Эксперименты Ходжкина и Хаксли.
Гигантский аксон кальмара. Из внеклеточной среды были удалены 2/3 Na+. При этом амплитуда ПД снизилась ? на 50%. Замена внутриклеточного Na+ на другие ионы приводит к некоторому росту ПД. Замена ? внутриклеточного К+ на Na+ приводит к значительному снижению ПД.
Метод фиксации потенциала
метод Петч-Клемпинга. С его помощью можно зафиксировать на длительное время значение мембранного потенциала на любом желаемом уровне. Это делается с помощью внешнего генератора напряжения
Суммарные мембранные токи при ПД
1. Подпороговая область:
Слабое изменение мембранного потенциала, суммарный ионный ток направлен от клетки наружу, так как поток К+, выходящий из клетки, уже усиливается из-за удаления мембранного потенциала от равновесного потенциала для К+. Входящий ток Na+ еще слаб, так как рост Na+-проницаемости пока невелик. Однако с развитием деполяризации Na-ый поток постепенно нарастает.
2. Критический уровень деполяризации:
В этот момент суммарный ионный ток через мембрану равен нулю, так как встречные токи ионов Na+ и К+ уравновешивают друг друга. Даже небольшая дальнейшая деполяризация приводит к росту входа Na+-тока в сотни раз.
3. Во время фазы деполяризации резко увеличивается Na+-проницаемость и суммарный мембранный ток, направленный внутрь клетки. Выходящий К+-ток растет медленнее и становится заметным только к моменту пика потенциала.
4. Фаза реполяризации:
В момент пика потенциала большинство Na+-каналов инактивированны, а К+-ток max. Поэтому суммарный мембранный ток – выходящий.
Кальциевая теория активации и инактивации Na+-каналов
В состоянии покоя у наружного отверстия Na+-канала находится Са2+, который электростатически тормозит проникновение Na+ в канал. При возбуждении наружная поверхность мембраны заряжена отрицательно, при этом Са2+ уходят со своих мест, вход открывается и Na+ входит в клетки.
Инактивация: по ходу деполяризации узкие Na+-каналы могут закупориваться Na+. Во многих каналах есть воротные белки (могут менять свое местоположение под влиянием изменения потенциала). В состоянии покоя активационный белок закрыт, а инактивационный открыт. При возбуждении открывается активационный белок в момент закрывания инактивационного белка. В конце реполяризации белки так же закрываются и потом открываются (исходное состояние).
Факторы, определяющие скорость распространения возбуждения по нервному волокну
1. Пространственная константа определяет величину декремент
деполяризации, ? - пространственная константа.
2. Коэффициент надежности, соотношение между амплитудой ПД
критической энергией и ПП. S=ПД/(Екр–ПП), ПД=120мВ, ПП=–70мВ, Екр=–55мВ ? S=8. Чем больше S, тем быстрее проведение.
3. Временная константа ? мембр. При возбуждении мембраны меняется
заряд. Длительность перезарядки мембраны. ?мембр=Rm*Cm. Чем больше ? мембр, тем ниже С. Vраспр=S*?/?мембр.
88.Биофизическая характеристика мышечных и немышечных сократительных белков.
Актин представляет собой длинную белковую нить, однако его нельзя отнести к фибриллярным белкам. Он состоит из отдельных глобулярных белков, сцепленных между собой таким образом, что вся структура представляет собой вытянутую цепь. Молекулы глобулярного актина (G-актина) имеют боковые и концевые центры связывания с другими такими же молекулами. В результате они объединяются таким образом, что образуют структуру, которую часто сравнивают с двумя нитками бус, соединенных вместе (рис. 7.1). Образованная из молекул G-актина лента закручена в спираль. Такая структура называется фибриллярным актином (F-актином). Шаг спирали (длина витка) составляет 38 нм, на каждый виток спирали приходится 7 пар G-актина. Полимеризация G-актина, то есть образование F-актина, происходит за счет энергии АТФ, и, наоборот, при разрушении F-актина выделяется энергия. Вдоль спиральных желобков актиновых филаментов (нитей) располагается белок тропомиозин. Каждая нить тропомиозина, имеющая длину 41 нм, состоит из двух идентичных ?-цепей, вместе закрученных в спираль с длиной витка 7 нм. Вдоль одного витка F-актина расположены две молекулы тропомиозина.
Каждая тропомиозиновая молекула соединяется, немного перекрываясь, со следующей, в результате тропомиозиновая нить простирается вдоль актина непрерывно.
В клетках поперечнополосатых мышц в состав тонких нитей кроме актина и тропомиозина входит еще и белок тропонин. На каждый шаг спирали F-актина приходится две молекулы тропонина. Этот глобулярный белок имеет сложное строение. Он состоит из трех субъединиц, каждая из которых выполняет свою функцию в процессе сокращения.
Толстая нить состоит из большого числа молекул миозина, собранных в пучок. Каждая молекула миозина длиной около 155 нм и диаметром 2 нм состоит из шести полипептидных нитей: двух длинных и четырех коротких. Длинные цепи вместе закручены в спираль с шагом 7,5 нм и образуют фибриллярную часть миозиновой молекулы. На одном из концов молекулы эти цепи раскручиваются и образуют раздвоенный конец. Каждый из этих концов образует комплекс с двумя короткими цепями, то есть на каждой молекуле имеются две головки. Это глобулярная часть миозиновой молекулы. В миозине выделяют два фрагмента: легкий меромиозин (ЛММ) и тяжелый меромиозин (ТММ), между ними находится шарнир. ТММ состоит из двух субфрагментов: S1 и S2. ЛММ и фрагмент S2 ТММ вложены в пучок нитей, а субфрагмент S1 выступает над поверхностью. Этот выступающий конец (миозиновая головка) способен связываться с активным центром на актиновой нити и изменять угол наклона к пучку миозиновых нитей.
Объединение отдельных молекул миозина в пучок происходит, скорее всего, за счет электростатических взаимодействий между ЛММ. Центральная часть нити (около 300 нм) не имеет головок. Весь комплекс миозиновых молекул простирается на 1,5 мкм. Это одна из самых больших биологических молекулярных структур, известных в природе.
При рассматривании в поляризационный микроскоп продольного среза поперечнополосатой мышцы видны светлые и темные участки. Темные участки (диски) являются анизотропными: в поляризованном свете они выглядят прозрачными в продольном направлении и непрозрачными — в поперечном, обозначаются буквой А. Светлые участки являются изотропными и обозначаются буквой I .
Диск I включает в себя только тонкие нити, диск А — и толстые, и тонкие. В середине диска А видна светлая полоса, называемая Н-зоной. Она не имеет тонких нитей. Диск I разделен тонкой полосой Z, которая представляет собой мембрану, содержащую структурные элементы, скрепляющие между собой концы тонких нитей. Участок между двумя Z-линиями называется саркомером.
Каждая толстая нить окружена шестью тонкими, а каждая тонкая — тремя толстыми. Таким образом, в поперечном срезе мышечное волокно имеет правильную гексагональную структуру
89.Основные характеристики поперечно-полосатой мышцы как механического преобразователя энергии; структура саркомеров, ее изменение при мышечном сокращении.
Веретенообразная мышца состоит из пучков мышечных волокон. Зрелое мышечное волокно практически полностью заполнено миофибриллами - цилиндрическими образованиями, сформированными из системы перекрывающихся толстых и тонких нитей, образованных сократительными белками. В миофибриллах скелетных мышц наблюдается правильное чередование более светлых и более темных участков. Поэтому часто скелетные мышцы называют поперечнополосатыми. Миофибрилла состоит из одинаковых повторяющихся элементов, так называемых саркомеров. Саркомер ограничен с двух сторон Z-дисками. К этим дискам с обеих сторон прикрепляются тонкие актиновые нити. Нити актина обладают низкой плотностью и поэтому под микроскопом кажутся более прозрачными или более светлыми. Эти прозрачные, светлые области, располагающиеся с обеих сторон от Z-диска, получили название изотропных зон (или I-зон). В середине саркомера располагается система толстых нитей, построенных преимущественно из другого сократительного белка, миозина. Эта часть саркомера обладает большей плотностью и образует более темную анизотропную зону (или А-зону). В ходе сокращения миозин становится способным взаимодействовать с актином и начинает тянуть нити актина к центру саркомера. Вследствие такого движения уменьшается длина каждого саркомера и всей мышцы в целом. Важно отметить, что при такой системе генерации движения, получившей название системы скользящих нитей, не изменяется длина нитей (ни нитей актина, ни нитей миозина). Укорочение является следствием лишь перемещения нитей друг относительно друга. Сигналом для начала мышечного сокращения является повышение концентрации Са2 + внутри клетки. Концентрация кальция в клетке регулируется с помощью специальных кальциевых насосов, встроенных в наружную мембрану и мембраны саркоплазматического ретикулума, который оплетает миофибриллы. Все нити актина в саркомере имеют постоянную длину и правильную ориентацию, при этом плюс-концы филаментов располагаются в Z-диске, а минус-концы - в центральной части саркомера. Вследствие такой упаковки нити актина, расположенные в левой и правой частях саркомера, имеют противоположную направленность.
90.Молекулярные механизмы мышечного сокращения, его регуляция.
В основе сокращения мышц лежит взаимное перемещение двух систем нитей, образованных актином и миозином. АТФ гидролизуется в активном центре, расположенном в головках миозина. Гидролиз сопровождается изменением ориентации головок миозина и перемещением нитей актина. Регуляция сокращения обеспечивается специальными Са-связывающими белками, расположенными на нитях актина или миозина. В основе сокращения мышц практически всех типов лежит перемещение двух систем белковых нитей (филаментов), построенных в основном из актина и миозина.
Для высокоэффективного преобразования энергии АТФ в механическую работу мышцы должны обладать строго упорядоченной структурой.
Строение и свойства актина. Мономеры актина (их часто называют G-актином, то есть глобулярным актином) могут взаимодействовать друг с другом, образуя так называемый фибриллярный (или F-актин). Процесс полимеризации можно инициировать повысив концентрацию одно- или двухвалентных катионов или добавив специальные белки. Процесс полимеризации становится возможным потому, что мономеры актина могут узнавать друг друга и образовывать межмолекулярные контакты. Полимеризованный актин внешне похож на две скрученные друг относительно друга нитки бус, где каждая бусина представляет собой мономер актина. Процесс полимеризации актина строго упорядочен, и мономеры актина упаковываются в полимер только в определенной ориентации. Тот конец полимера, где скорость полимеризации больше, называют плюс-концом, а противоположный конец полимера обозначают как минус-конец.
Актин является уникальным строительным материалом, широко используемым клеткой для построения различных элементов цитоскелета и сократительного аппарата. Есть белки, связывающиеся с мономерным актином (например, профилин). Эти белки, находясь в комплексе с глобулярным актином, препятствуют его полимеризации. Есть специальные белки, которые, как ножницы, разрезают уже сформировавшиеся нити актина на более короткие фрагменты. Некоторые белки преимущественно связываются и формируют шапочку ("кепируют") на плюс-конце полимерного актина. Другие белки кепируют минус-конец актина. Существуют белки, которые могут сшивать уже сформировавшиеся нити актина.
Все нити актина в саркомере имеют постоянную длину и правильную ориентацию, при этом плюс-концы филаментов располагаются в Z-диске, а минус-концы - в центральной части саркомера. Вследствие такой упаковки нити актина, расположенные в левой и правой частях саркомера, имеют противоположную направленность.
Строение и свойства миозина. В состав молекулы миозина скелетных мышц входят шесть полипептидных цепей - две так называемые тяжелые цепи миозина и четыре легкие цепи миозина (ЛЦМ). Эти цепи прочно ассоциированы друг с другом (нековалентными связями) и образуют единый ансамбль, который собственно и является молекулой миозина.
Тяжелые цепи миозина имеют большую молекулярную массу и сильно асимметричную структуру. У каждой тяжелой цепи есть длинный спирализованный хвост и маленькая компактная грушевидная головка. Спирализованные хвосты тяжелых цепей миозина скручены между собой наподобие каната. Этот канат обладает довольно высокой жесткостью, и поэтому хвост молекулы миозина образуют палочкообразные структуры. В нескольких местах жесткая структура хвоста нарушена. В этих местах располагаются так называемые шарнирные участки, обеспечивающие подвижность отдельных частей молекулы миозина. Шарнирные участки легко подвергаются расщеплению под действием протеолитических (гидролитических) ферментов, что приводит к образованию фрагментов, сохраняющих определенные свойства неповрежденной молекулы миозина.
В области шейки, то есть при переходе грушевидной головки тяжелой цепи миозина в спиральный хвост, располагаются короткие легкие цепи миозина. С каждой головкой тяжелой цепи миозина связаны одна регуляторная и одна существенная легкая цепь миозина. Обе легкие цепи миозина тем или иным способом влияют на способность миозина взаимодействовать с актином и участвуют в регуляции мышечного сокращения.
Палочкообразные хвосты могут слипаться друг с другом за счет электростатических взаимодействий. При этом молекулы миозина могут располагаться либо параллельно, либо антипараллельно друг относительно друга.
Хвосты миозина скелетных мышц могут упаковываться как в параллельном, так и в антипараллельном направлении. Комбинация параллельной и антипараллельной упаковок приводит к формированию так называемых биполярных (то есть двухполюсных) филаментов миозина. Половина молекул миозина повернута своими головами в одну сторону, а вторая половина - в другую сторону. Биполярный миозиновый филамент располагается в центральной части саркомера.
Главной "моторной" частью миозина скелетных мышц является головка тяжелой цепи миозина вместе со связанной с ней легкими цепями миозина. Головки миозина могут дотягиваться до нитей актина и контактировать с ними. При замыкании таких контактов образуются так называемые поперечные мостики, которые собственно генерируют тянущее усилие и обеспечивают скольжение нитей актина относительно миозина.
Рассмотрим цикл гидролиза АТФ и перемещение головки по актину. В исходном состоянии головка миозина не насыщена АТФ, актинсвязывающие центры сближены и головка прочно взаимодействует с актином. При связывании АТФ в активном центре "пасть" раскрывается, актинсвязывающие участки удаляются друг от друга, прочность связи миозина с актином ослабевает и головка диссоциирует от нити актина. Гидролиз АТФ в активном центре диссоциировавшей от актина головки миозина приводит к закрыванию щели активного центра. После гидролиза АТФ до АДФ и неорганического фосфата шейка занимает положение, перпендикулярное длинной оси нити актина. После всех этих событий головка миозина вновь оказывается способной взаимодействовать с актином. Образование комплекса с актином вызывает структурные изменения в головке миозина. Эти изменения позволяют выбросить из активного центра миозина неорганический фосфат, который образовался в ходе гидролиза АТФ. Головка миозина проталкивает нить актина на шаг вперед. После этого из активного центра выбрасывается другой продукт реакции, АДФ. Цикл замыкается, и головка переходит в исходное состояние.
Механизмы регуляции мышечного сокращения. Ионы Са2 + являются сигналом для начала мышечного сокращения.
Миозиновый тип регуляции сократительной активности. Простейший способ миозиновой регуляции описан для некоторых мышц моллюсков. Миозин моллюсков по своему составу не отличается от миозина скелетных мышц позвоночных. Считается, что при отсутствии Са2 + легкие цепи обернуты вокруг шарнирного участка тяжелой цепи миозина. При этом подвижность шарнира сильно ограничена. Головка миозина не может совершать колебательных движений, она как бы заморожена в одном положении относительно ствола толстого филамента. Очевидно, что в таком состоянии головка не может осуществлять колебательные движения и вследствие этого не может перемещать нить актина. При связывании Са2 + происходят изменения структуры легких и тяжелых цепей миозина. Резко повышается подвижность в области шарнира. Теперь после гидролиза АТФ головка миозина может осуществлять колебательные движения и проталкивать нити актина относительно миозина.
Оказалось, что с миозиновыми филаментами гладких мышц связан специальный фермент. Этот фермент получил название "киназа легких цепей миозина" (КЛЦМ). В состоянии покоя при низкой концентрации Са2 + в цитоплазме киназа легких цепей миозина неактивна. Это связано с тем, что в структуре фермента есть специальный ингибиторный (блокирующий активность) участок. Ингибиторный участок попадает в активный центр фермента и, не давая возможности взаимодействовать с истинным субстратом, полностью блокирует активность фермента.
В цитоплазме гладких мышц есть специальный белок кальмодулин, содержащий в своей структуре четыре Са-связывающих центра. Связывание Са2 + вызывает изменения в структуре кальмодулина. Насыщенный Са2 + кальмодулин оказывается способным взаимодействовать с КЛЦМ. Посадка кальмодулина приводит к удалению ингибиторного участка из активного центра, и киназа легких цепей миозина как бы просыпается. Только после фосфорилирования легкой цепи миозин оказывается способным взаимодействовать с актином и начинается мышечное сокращение.
Актиновый механизм регуляции мышечного сокращения. Связанный с актином механизм регуляции сократительной активности характерен для поперечнополосатых скелетных мышц позвоночных и сердечной мышцы. Нити фибриллярного актина в скелетных и сердечных мышцах имеют вид двойной нитки бус. Нитки бус актина перекручены друг относительно друга, поэтому с двух сторон филамента образуются канавки. В глубине этих канавок размещается сильно спирализованный белок тропомиозин. Каждая молекула тропомиозина состоит из двух одинаковых (или очень похожих друг на друга) полипептидных цепей, которые перекручены. Располагаясь внутри канавки актина, палочкообразная молекула тропомиозина контактирует с семью мономерами актина.
На актиновом филаменте помимо тропомиозина располагается еще и тропониновый комплекс. В состоянии расслабления концентрация Са2 + в цитоплазме очень мала. Регуляторные центры тропонина С не насыщены Са2 +. Ингибиторный и С-концевой участки тропонина I взаимодействуют с актином и с помощью тропонина Т выталкивают тропомиозин из канавки на поверхность актина. До тех пор пока тропомиозин располагается на периферии канавки, доступность актина для головок миозина ограниченна. Контакт актина с миозином возможен, но площадь этого контакта мала, вследствие чего головка миозина не может переместиться по поверхности актина и не может генерировать тянущее усилие.
При повышении концентрации Са2 + в цитоплазме происходит насыщение регуляторных центров тропонина С. Тропонин С образует прочный комплекс с тропонином I. При этом ингибиторная и С-концевая части тропонина I диссоциируют от актина. Теперь ничто не удерживает тропомиозин на поверхности актина, и он закатывается на дно канавки. Такое перемещение тропомиозина увеличивает доступность актина для головок миозина, увеличивается площадь контакта актина с миозином, и головки миозина приобретают возможность не только контактировать с актином, но и прокатываться по его поверхности, генерируя при этом тянущее усилие.
