
- •212000, Г. Могилев, пр. Мира, 43
- •1 Строение атома
- •1.1 Современные представления о строении атома
- •69Se → 69As→69Ge→69Ga .
- •1.2 Строение электронной оболочки атома
- •1.3 Электронные семейства элементов
- •1.4 Атомная валентная зона. Возможные валентные состояния
- •1.5 Проскок (провал) электронов
- •2 Периодическая система элементов
- •2.1 Периодичность атомных характеристик
- •3 Химическая связь
- •3.1Основные виды химической связи
- •3.1.2 Донорно-акцепторная связь
- •3.1.3 Ионная связь
- •3.1.4 Металлическая связь
- •3.1.5 Метод валентных связей (вс)
- •3.1.6 Межмолекулярные связи
- •3.1.7 Водородная связь
- •4 Комплексные соединения
- •4.1 Состав комплексных соединений.
- •4.2 Классификация комплексных соединений
- •4.3 Тип связи в комплексных соединениях
- •4.4 Диссоциация комплексных соединений.
- •5 Вопросы и задания
- •Список литературы
4.2 Классификация комплексных соединений
По принадлежности к определенному классу соединений комплексные соединения подразделяются на: комплексные кислоты (Н[AuCl4] –хлористозолотая кислота); комплексные основания ([Ag (NH3)2]OH –гидроксид диамминосеребра); комплексные соли (K4[Fe(CN)6] – гексацианоферрат (II) калия, ферроцианид калия)
По природе лигандов: аквокомплексы -лигандами являются молекулы воды ([Cu(H2O)4](NO3)2); аммиакаты -лигандами являются молекулы аммиака ([Ag(NH3)2]Cl); гидроксокомплексы- соединения с ОН --группами в виде лигандов (Nа 2[Zn(OH)4]); ацидокомплексы- содержат в качестве лигандов анионы различных кислот.
По знаку заряда комплекса: комплексные катионы ([Zn(NH3)4]2+Cl2); комплексные анионы( K3Fe[CN)6]3- ): нейтральные комплексы - не имеют внешней сферы ([Co(NH3)3Cl3]).
4.3 Тип связи в комплексных соединениях
Современная теория строения комплексных соединений использует положения квантовой химии. Согласно методу (ВС) связь в комплексных соединениях осуществляется за счет свободных орбиталей комплексообразователя и неподеленных пар лигандов, т.е. реализуется по донорно-акцепторному механизму.
Рассмотрим строение комплекса [Ag(NH3)2]+. Электронная конфигурация иона серебра:
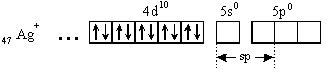
Свободные орбитали иона серебра являются акцепторами электронных пар атомов азота молекул аммиака:

4.4 Диссоциация комплексных соединений.
Для комплексных соединений характерна первичная и вторичная диссоциация.
Первичная диссоциация комплексных соединений на комплексный ион и противоположно заряженные ионы внешней сферы протекает полностью, как у сильных электролитов:
K2[Zn(CN)4] = 2K+ +[Zn(CN)4]2-
[Co(NH3)6](NO3)2 = [Co(NH3)6]2+ +2NO3-
Поэтому, соединения, содержащие комплексные ионы, могут вступать в реакции обмена с электролитами с образованием малорастворимых веществ:
2CuSO4
+ K4[Fe(CN)6]
= Cu2[Fe(CN)6]
+ 2K2SO4;
2Cu2+
+ [Fe(CN)6]4-
= Cu2[Fe(CN)6]
Однако, в отличие от “простых” ионов, комплексные ионы сами способны к диссоциации, которая называется вторичной диссоциацией. Она характеризует диссоциацию самого комплексного иона и протекает ступенчато, как у слабых электролитов, подчиняясь закону действия масс. Количественно каждая ступень характеризуется константой диссоциации.
I ступень: [Ag(NH3)2]+ = [AgNH3]+ +NH3
[AgNH3]+ [NH3]
Кд
(I) = [Ag(NH3)2]+
II ступень: [AgNH3]+ = Ag+ + NH3
[Ag+] [NH3]
Кд
(II)= [AgNH3]+
В целом устойчивость комплексного иона в растворе характеризуется величиной константы нестойкости Кн , которая равна произведению констант диссоциации отдельных ступеней.
Кн = Кд(I)Кд(II)
Общая константа нестойкости Княвляется константой равновесия полной диссоциации комплекса:
[Ag(NH3)2]+ = Ag+ + 2NH3
[Ag+ ] [NH3]2
Кн =
[Ag(NH3)2]+
Чем меньше константа нестойкости, тем прочнее комплексный ион.
5 Вопросы и задания
Каковы современные представления о строении атома? Какие элементарные частицы входят в состав ядра? Каков физический смысл порядкового номера элемента? Как определить число протонов, нейтронов и электронов в атоме? Как влияет изменение количества этих структурных единиц на строение атома?
Что такое изотопы, изобары, изотоны?
Охарактеризуйте квантовые числа n, l, ml, ms. Какие значения они могут принимать?
Что называют энергетическим уровнем (слоем), подуровнем, атомной орбиталью? Каким квантовым числом они характеризуется?
Сформулируйте основные принципы заполнения электронной оболочки атома (принцип минимальной энергии, принцип Паули, принцип Гунда).
Какие семейства элементов вам известны? Что называют атомной валентной зоной (АВЗ) элемента? Как определяется АВЗ для элементов различных семейств?
Напишите электронные формулы атомов элементов с порядковым номером 9, 28, 31, 35, 80, и 84. К какому семейству относится каждый из этих элементов? Покажите распределение электронов АВЗ этих элементов по квантовым ячейкам. Определите их возможные валентные состояния? Чему равен суммарный спин р- электронов у первого элемента и сколько свободных d- орбиталей у последнего элемента?
Дайте современную формулировку периодического закона Д.И. Менделеева. Укажите связь периодической системы со строением атома (порядковый номер, номер периода, номер группы). В чём причина периодичности свойств?
Что называют радиусом атома? Как он изменяется по периоду? В главных подгруппах? По периодической системе? Почему?
Что понимают под энергией ионизации? Энергией сродства к электрону? Электроотрицательностью? Как они изменяется по периоду? В главных подгруппах? По периодической системе? Почему?
Как изменяются окислительно-восстановительные свойства элементов по периоду? В главных подгруппах? По периодической системе? Почему?
Как изменяются кислотно-основные свойства оксидов и гидроксидов (оксидгидроксидо) по периоду? В главных подгруппах? По периодической системе? Почему?
Пользуясь периодической системой элементов, напишите формулы: а) высших оксидов хрома, марганца, олова; б) кислот, соответствующих этим оксидам; в) оксида, гидроксида и нитрата стронция. Напишите электронно-графические формулы данных элементов, укажите соответствующие степени окисления. Приведите графические формулы ионов.
Определите, у какого элемента сильнее выражены металлические свойства: а) Na или Cs; б) K или Cr; в) Rb или Ag. Напишите электронно-графи-ческие формулы ионов: Na+, Cs+, K+, Cr2+, Rb+, Ag+.
Какая связь между химической активностью щелочных металлов и строением их атомов? Как изменяются значения первых потенциалов ионизации в ряду Li-Fr? Ответ мотивируйте.
Какие типы химической связи вы знаете? Охарактеризуйте их..
Охарактеризуете силы межмолекулярного взаимодействия.
Составьте формулы комплексных ионов для Ag+, Cu2+,Au3+, в которых их координационные числа равны четырем, а лигандами являются следующие нейтральные молекулы и ионы: NH3, Cl–, S2O32–
Составьте формулы всех возможных комплексных соединений, используя в качестве комплексообразователя Co3+ (координационное число его равно шести), в качестве лигандов – NH3, NO2–, внешней сферы– K+, NO2–.
Определите степень окисления и координационное число комплексообразователя в следующих комплексных соединениях:
K[AuBr4], [Cd(NH3)4](OH)2, Na3[Ag(S2O3)2], H[Co (H2O)2(CN)4], Cu2[Fe(CN)6].
Распишите, как диссоциируют в растворе следующие комплексные соединения, напишите выражения для констант нестойкости их комплексных ионов: K2[PtCl6]; [Co(NH3)3(H2O)3]Cl3; [Cr(H2O)3Cl3].
