- •212000, Г. Могилев, пр. Мира, 43
- •1 Строение атома
- •1.1 Современные представления о строении атома
- •69Se → 69As→69Ge→69Ga .
- •1.2 Строение электронной оболочки атома
- •1.3 Электронные семейства элементов
- •1.4 Атомная валентная зона. Возможные валентные состояния
- •1.5 Проскок (провал) электронов
- •2 Периодическая система элементов
- •2.1 Периодичность атомных характеристик
- •3 Химическая связь
- •3.1Основные виды химической связи
- •3.1.2 Донорно-акцепторная связь
- •3.1.3 Ионная связь
- •3.1.4 Металлическая связь
- •3.1.5 Метод валентных связей (вс)
- •3.1.6 Межмолекулярные связи
- •3.1.7 Водородная связь
- •4 Комплексные соединения
- •4.1 Состав комплексных соединений.
- •4.2 Классификация комплексных соединений
- •4.3 Тип связи в комплексных соединениях
- •4.4 Диссоциация комплексных соединений.
- •5 Вопросы и задания
- •Список литературы
3.1.5 Метод валентных связей (вс)
Структура и свойства молекул с ковалентной связью могут быть объяснены с позиций метода валентных связей (ВС)
Основные положения метода ВС:
По методу ВС химическая связь между двумя атомами возникает в результате перекрывания атомных орбиталей (АО) с образованием электронных пар;
образованная электронная пара локализована между двумя атомами. Такая связь является двухцентровой и двухэлектронной;
химическая связь образуется только при взаимодействии электронов с антипараллельными спинами;
характеристики химической связи (энергия, длина, полярность, валентные углы) определяется типом перекрывания АО;
ковалентная связь направлена в сторону максимального перекрывания АО реагирующих атомов.
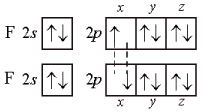
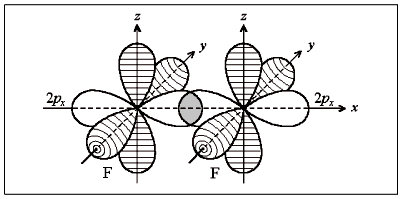
На рисунке 7 приведена схема образования связи в молекуле фтора F2 по методу ВС
|
|
Рисунок 7 – схема образования связи в |
Рисунок 6 – схема образования связи в молекуле фтора
3.1.6 Межмолекулярные связи
К основным видам межмолекулярного взаимодействия относят вандерваальсовы силы, водородные связи и донорно-акцепторные взаимодействия.
Вандерваальсовы силы обуславливают притяжение межу молекулами и включают в себя три составлющие: диполь- дипольное взаимодействия, индукционное и дисперсионное взаимодействия.
Диполь - дипольное взаимодействие происходит за счет ориентации диполей:
Индукционное взаимодействие. При воздействии диполей на неполярные молекулы возникают наведенные диполи:
Дисперсионное притяжение возникает за счет возникновения мгновенных диполей и их суммирования:
3.1.7 Водородная связь
Водородная связь – это химическая связь, образованная положительно поляризованным водородом, химически связанным в одной молекуле, и отрицательно поляризованным атомом фтора, кислорода и азота (реже хлора, серы и др.), принадлежащих другой молекуле. Водородная связь может быть внутримолекулярной, если она образуется между двумя группами одной и той же молекулы, и межмолекулярной, если она образуется между разными молекулами (А-Н + В-К = А-Н...В-К).
Энергия и длина водородной связи. Энергия возрастает с увеличением электроотрицательности (ЭО) и уменьшением размеров атомов. Водородная связь более прочная, чем вандерваальсово взаимодействие, но менее прочная, чем ковалентная связь. Аналогичную зависимость имеет и длина связи.
В ряду H2O – Н2S - Н2Se – H2Te свойства воды резко отличаются от свойств других веществ. Если бы вода не обладала водородными связями, она имела бы температуру плавления не 0°С, а (-100°С), и температуру кипения не 100°С, а -80°С. Водородная связь влияет и на химические свойства веществ. Так, HF - слабая кислота, тогда как НС1 - сильная. Причина в том, что HF образует с помощью водородной связи дифторид-ионы и другие более сложные ассоциаты.
4 Комплексные соединения
4.1 Состав комплексных соединений.
Комплексными называются соединения, образованные сочетаниями
отдельных компонентов – электронейтральных молекул простых и сложных
веществ
Теория, объясняющая строение таких соединений, была предложена А. Вернером. Она получила название координационной теории. Её основные положения сводятся к следующему:
Один из основных компонентов комплексного соединения – центральный атом или центральный ион, иначе – комплексообразователь.
Чаще всего комплексообразователем является ион d- элемента, но известны комплексы с ионами s- или р-элементов в роли центральных ионов.
Комплексообразователем может быть и нейтральный атом, например Fe .
Комплексообразователь координирует (удерживает вокруг себя) неко-
торое число одинаковых или разных лигандов.
В качестве лигандов могут выступать как анионы, так и нейтральные
молекулы, атомы в которых имеют неподеленные электронные пары, или молеулы, атомы в которых связаны π-связями, например: F-, Cl- , Br- , I- , OH- , CN- , SCN- , NO2- , SO42- , S2O32-, H2O, NH3.
Общее число лигандов при данном центральном ионе – координацион-
ное число – зависит от его природы, заряда и от природы лигандов.
Комплексообразователь с координированными лигандами образует
внутреннюю координационную сферу. При записи химической формулы
внутренняя координационная сфера заключается в квадратные скобки. В зави-
симости от зарядов комплексообразователя и лигандов комплекс представляет
собой анион, катион или нейтральную молекулу. Например:
[Cu(NH3)4]2+, [Ag(CN)2]-, [Pt(NH3)2Cl2]0 .
Заряд комплекса подсчитывают как алгебраическую сумму зарядов всех
составляющих его частиц (считая все заряды целочисленными). Незаряженным
центральным атомам и лигандам – нейтральным молекулам приписывается ну-
левой заряд.
Заряд комплексного иона уравновешивается зарядами соответст-
вующих противоионов, образующих внешнюю координационную сфе-
ру (записываются за квадратными скобками), например: [Cu(NH3)4](OH)2, [Ag(CN)2]Cl
На рисунке 7представлена структура комплексного соединения.
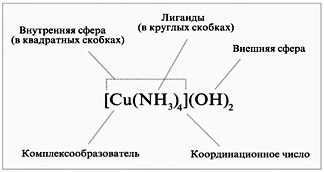
Рисунок 7 – структура комплексного соединения
Чаще всего роль комплексообразователей выполняют катионы переходных металлов ( d-элементы, f-элементы, реже s и p). Число лигандов, располагающихся вокруг комплексообразователя, называется координационным числом. Чаще встречаются координационные числа 2, 4 и 6, что соответствует наиболее симметричной геометрической конфигурации комплекса – линейной (2), тетраэдрической (4), октаэдрической (6).
Способность к комплексообразованию уменьшается в следующем порядке: f > d >p >>s.
Заряд комплексного иона численно равен суммарному заряду внешней сферы, но противоположен ему по знаку, и определяется как алгебраическая сумма зарядов комплексообразователя и лигандов.