
- •212000, Г. Могилев, пр. Мира, 43
- •1 Строение атома
- •1.1 Современные представления о строении атома
- •69Se → 69As→69Ge→69Ga .
- •1.2 Строение электронной оболочки атома
- •1.3 Электронные семейства элементов
- •1.4 Атомная валентная зона. Возможные валентные состояния
- •1.5 Проскок (провал) электронов
- •2 Периодическая система элементов
- •2.1 Периодичность атомных характеристик
- •3 Химическая связь
- •3.1Основные виды химической связи
- •3.1.2 Донорно-акцепторная связь
- •3.1.3 Ионная связь
- •3.1.4 Металлическая связь
- •3.1.5 Метод валентных связей (вс)
- •3.1.6 Межмолекулярные связи
- •3.1.7 Водородная связь
- •4 Комплексные соединения
- •4.1 Состав комплексных соединений.
- •4.2 Классификация комплексных соединений
- •4.3 Тип связи в комплексных соединениях
- •4.4 Диссоциация комплексных соединений.
- •5 Вопросы и задания
- •Список литературы
3 Химическая связь
Химической связью называют различные виды взаимодействий, обуславливающие устойчивое существование двух–и многоатомных соединений: молекул, ионов, кристаллов и других веществ. При образовании химической связи происходит: снижение общей энергии двух–и многоатомной системы по сравнению с суммой энергий изолированных частиц, из которых эта система состоит; перераспределение электронной плотности в области химической связи по сравнению с простым наложением электронных плотностей несвязанных атомов, сближенных на расстояние длины связи.
Энергией химической связи Есв. называют количество энергии, выделяющееся при образовании связи (кДж/моль).
Чем больше энергия связи, тем устойчивее молекула, тем прочнее связь.
Важной характеристикой связи является длина связи 1св, равная расстоянию между ядрами атомов в соединении. Она зависит от размеров электронных оболочек и степени их перекрывания. Связь обозначается черточкой, например: Н–J, О=О, Н–С=С-Н.
Правило октета. В результате образования химической связи атомы стремятся приобрести такую же электронную конфигурацию, как у благородных газов ns2nр6, то есть восемь электронов на внешней оболочке. Например, N 1s22р3 + 3 Н 1s1 = NH3.
3.1Основные виды химической связи
3.1.1 Ковалентной связью называется химическая связь, образованная путем обобществления пары электронов двумя атомами. При этом снижается энергия системы.
Особенностями ковалентной химической связи является ее направленность и насыщенность.
Направленность ковалентной связи объясняется тем, что атомные орбитали пространственно ориентированы и перекрывание электронных облаков происходит по определенным направлениям. Количественно она выражается в виде валентных углов между направлениями химической связи в молекуле.
Насыщаемость связана с ограничением числа электронов, находящихся на внешних оболочках, и определяет стехиометрию молекулярных химических соединений, от которой зависят формульный состав, массовые соотношения элементов, расчеты по формулам и уравнениям и т.д.
Полярность ковалентной связи. Связь, образованная одинаковыми атомами называется гомеополярной, или неполярной, так как обобществленные электроны равномерно распределены между атомами, например, в молекулах Н2, О2, N2, S8.
Если же один из атомов сильнее притягивает электроны, то электронная пара смещается к нему и возникающая связь называется ковалентной полярной.
Чем выше электроотрицательность (ЭО) атома, тем более вероятно смещение электронной пары в сторону ядра данного атома, поэтому разность ЭО (ΔЭО) атомов характеризует полярность связи. Атом, к которому смещается электронная плотность, приобретает эффективный заряд δ–, второй атом имеет эффективный заряд δ+. Вследствие этого возникает диполь, имеющий два одинаковых по величине заряда δ+ и δ-, и длину диполя 1Д. Мерой полярности связи служит электрический момент диполя μсв = δ·1Д, Кл·м, где δ –эффективный заряд, 1Д – длина диполя. В качестве внесистемной единицы для измерения μ используют Дебай D, 1 D = 3.3·10-30 Кл·м.
Порядок связи (кратность связи) – это число обобществленных поделенных пар между двумя связанными атомами. Чем выше порядок связи, тем прочнее связаны между собой атомы и тем короче сама связь.
Например, порядок связи в молекулах H2, O2 и N2 равен 1, 2 и 3 соответственно, поскольку связь в этих случаях образуется за счёт перекрывания одной, двух и трех пар электронных облаков.
В образовании ковалентной связи могут принимать участие АО как одинаковой, так и различной симметрии. При перекрывании АО вдоль линии соединения атомов образуется -связь. Схема образования -связи приведена на рисунке 4.
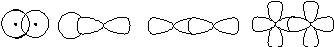 s–
s
s–p p–p d–d
s–
s
s–p p–p d–d
Рисунок 4 – схема образования -связи
При перекрывании АО по обе стороны от линии соединения атомов образуется -связь. Схема образования –связи приведена на рисунке 5.

p-p p-d d-d
рисунок 5 – схема образования –связи –связи
