
- •Основные понятия и законы химии
- •1 Основные понятия химии.
- •Простые и сложные вещества. Аллотропия.
- •Относительная атомная масса
- •Относительная молекулярная масса.
- •Моль. Молярная масса.
- •Эквивалент, фактор эквивалентности, молярная масса эквивалентов
- •Основные законы химии
- •Закон сохранения массы веществ.
- •Закон постоянства состава.
- •Закон авогадро.
- •Закон объемных отношений
- •Закон эквивалентов.
- •Контрольные вопросы и задачи.
- •3 Решение типовых задач
- •3.1 Моль. Молярная масса. Молярный объем.
- •3.3 Основные законы химии
- •Список литературы
Относительная молекулярная масса.
Относительной молекулярной массой Мr вещества называется величина, равная отношению массы молекулы вещества к 1/12 массы атома углерода 12С.
Молекулярная масса численно равна сумме относительных атомных масс всех атомов, входящих в состав молекулы вещества.
Относительная молекулярная масса показывает, во сколько раз масса молекулы данного вещества больше 1/12 массы атома 12С. Так, молекулярная масса кислорода Mr(O2) равна 32. Это означает, что масса молекулы кислорода в 32 раза больше, чем 1/12 массы атома 12C. Относительная молекулярная масса – одна из основных характеристик вещества.
Моль. Молярная масса.
Наряду с единицами массы, в химии пользуются также единицей количества вещества, называемой молем. Моль – количество вещества, содержащее в своем составе столько атомов, молекул, ионов, электронов или других структурных единиц, сколько атомов содержится в 0,012 кг углерода 12С.
Применяя понятие моль, необходимо в каждом конкретном случае точно указать, какие именно структурные единицы имеются в виду. Например, моль атомов Н, моль молекулы H2, моль ионов H+.
В настоящее время число структурных единиц, содержащихся в 1 моле вещества (постоянная Авогадро), определено с большей точностью. В практических расчетах его принимают равным 6,02 1023. Исходя из этого можно сказать, что моль – это количество вещества, которое содержит 6,02 1023 структурных единиц (молекул, атомов, ионов, электронов и др.)
Отношение массы «m» вещества к его количеству «n» называют молярной массой вещества.
![]()
Молярную массу обычно выражают в г/моль.
Эквивалент, фактор эквивалентности, молярная масса эквивалентов
В настоящее время эквивалентом(Э)называют реальную или условную частицу вещества, которая может замещать, присоединять или быть каким-либо другим способом эквивалента одному атому или иону водорода в кислотно-основных или ионообменных реакциях или одному электрону в окислительно-восстановительных реакциях.
Так же, как молекула, атом или ион, эквивалент безразмерен. И так же, как в случае молекул, атомов или ионов, состав эквивалента выражается с помощью химических знаков и формул.
Для того чтобы определить состав эквивалента вещества и правильно записать его химическую формулу, надо исходить из конкретной реакции, в которой участвует данное вещество.
Рассмотрим несколько примеров определения формулы эквивалента.
![]() (1)
(1)
С одним ионом
водорода реагирует один ион гидроксила.
Поэтому Э![]() ,
а эквивалент гидроксида калия и гидроксида
натрия будет соответственноКОН
и NaOH.
,
а эквивалент гидроксида калия и гидроксида
натрия будет соответственноКОН
и NaOH.
Рассмотрим взаимодействие Ca(OH)2 c HCl.
![]() (2)
(2)
В реакции
(2) один ион водорода эквивалентен 1/2
иона
![]() ,
одному ионуОН
,
одному ионуОН![]() и одному ионуCl
и одному ионуCl![]() .
Следовательно,Э
.
Следовательно,Э![]() ,Э(Cl
,Э(Cl![]() )
=
)
=![]()
![]() ,
Э
,
Э![]() .
.
Запишем уравнение реакции (2) в молекулярной форме:
![]()
Одному иону
![]() эквивалента 1/2 молекулы
эквивалента 1/2 молекулы![]() ,
следовательно,Э
,
следовательно,Э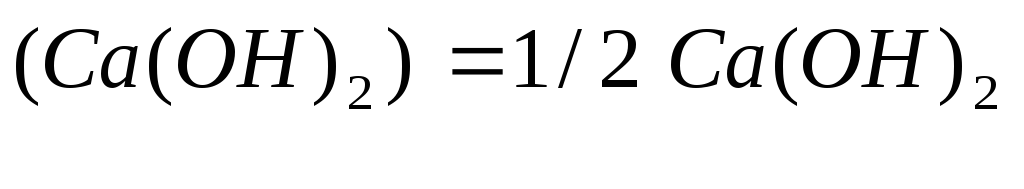
![]() (3)
(3)
B реакции
(3) с одним ионом цинка взаимодействуют
два электрона, поэтому Э![]() .
.
![]() (4)
(4)
В реакции (4) ион
Fe![]() реагирует
с одним электроном и, соответственно
Э
реагирует
с одним электроном и, соответственно
Э![]()
![]() (5)
(5)
В реакции (5) ион
Fe![]() присоединяет
три электрона, следовательно, Э
присоединяет
три электрона, следовательно, Э![]() .
.
ФАКТОР ЭКВИВАЛЕНТНОСТИ (fэ) – это число, которое показывает, какая часть реальной частицы соответствует 1 эквиваленту.
По реакции (1)
fэ(OH![]() )
= 1;
)
= 1;
по реакции (2) fэ(Ca(OH)2= 1/2;
fэ(CaCl2) = 1/2;
по
реакции (3) fэ![]() ;
;
по реакции (4)
fэ(Fe![]() )
= 1,
)
= 1,
по реакции (5)
fэ(Fe![]() )
= 1/3.
)
= 1/3.
Так как один ион
водорода соответствует единице
валентности, то fэ
химического элемента равен 1/В,
где В
– валентность элемента в данном
соединении. Например, в
![]() fэ(S)
= ½,
Э(S)
= 1/2S,
в NH
fэ(S)
= ½,
Э(S)
= 1/2S,
в NH![]()
fэ(N)
= 1/3,
Э(N)
= 1/3 N,
в AlCl![]() fэ(Al)
= 1/3,
Э(Al)
= 1/3Аl,
fэ(Al)
= 1/3,
Э(Al)
= 1/3Аl,
fэ(Cl) = 1, Э(Cl) = Cl.
МОЛЬ ЭКВИВАЛЕНТОВ – это количество вещества, которое соединяется с 1 моль атомов водорода или ½ моль атомов кислорода или замещает те же количества водорода в их соединениях. Например, в соединениях HCl, H2S, NH3, CH4 моль эквивалентов хлора, серы, азота, углерода равен соответственно 1 моль Cl, ½ моль S, 1/3 моль N, ¼ моль углерода.
Для нахождения молярной массы эквивалентов химического элемента нужно молярную массу данного элемента умножить на фактор эквивалентности.
Например, в тех же соединениях HCl, H2S, NH3, CH4,
Мэ(Cl) = M(1Cl) = 35,5 г/моль,
Мэ(S) = M(1/2S) = 16 г/моль,
Mэ(N) = M(1/3N) = 4,67 г/моль,
Мэ(С) = М(1/4C) = 3 г/моль
Рассмотрим, как определяются эквивалент, фактор эквивалентности и молярная масса эквивалентов сложных веществ.
Эквивалент
кислоты зависит от ее основности, которая
определяется числом атомов водорода,
замещающихся в реакции на атомы металла,
fэ(кислоты)
=
![]() .
Если кислота многоосновная, то fэ
и Э
и Мэ
могут принимать различные значения.
Например:
.
Если кислота многоосновная, то fэ
и Э
и Мэ
могут принимать различные значения.
Например:
![]()
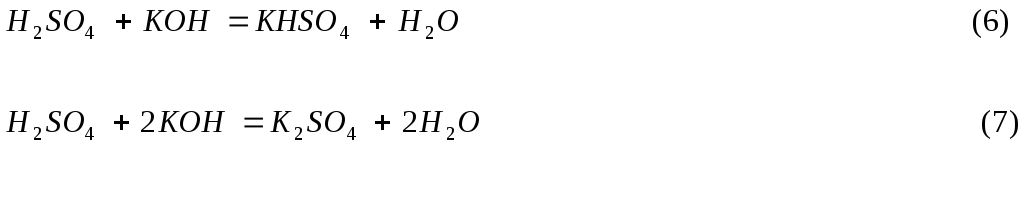 В
реакции (6) серная кислота обменивает
на металл один атом водорода, поэтому
fэ(Н2SO4)
= 1, Э(H2SO4)
= H2SO4,
В
реакции (6) серная кислота обменивает
на металл один атом водорода, поэтому
fэ(Н2SO4)
= 1, Э(H2SO4)
= H2SO4,
M(1H2SO4) = 98 г/моль
В реакции (7)
![]() обменивает
на металл два атома водорода, т.е. ведет
себя как двухосновная кислота, поэтому
обменивает
на металл два атома водорода, т.е. ведет
себя как двухосновная кислота, поэтому
fэ(H2SO4) = 1/2, Э(H2SO4) = 1/2 H2SO4, М(1/2 H2SO4) = 49 г/моль
Эквивалент основания
зависит от кислотности основания,
которая определяется числом гидроксильных
групп, обменивающихся на кислотный
остаток, fэ(основания)![]() .
Для многокислотных основанийfэ
– величина
переменная и зависит от условий проведения
реакции, например:
.
Для многокислотных основанийfэ
– величина
переменная и зависит от условий проведения
реакции, например:
![]()
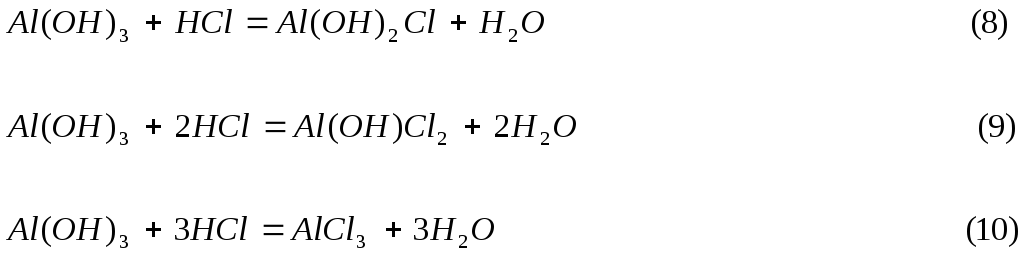
В реакции (8)
гидроксид алюминия обменивает одну
группу ОН![]() на кислотный остаток, поэтомуfэ(Al(OH)3)
= 1, Э(Al(OH)3)
= Al(OH)3,
M(1 Al(OH)3)
= 78 г/моль.
на кислотный остаток, поэтомуfэ(Al(OH)3)
= 1, Э(Al(OH)3)
= Al(OH)3,
M(1 Al(OH)3)
= 78 г/моль.
В реакции (9) Al(OH)3
обменивает на кислотный остаток две
группы ОН![]() ,
поэтомуfэ(Al(OH)3)
= ½, Э(Al(OH)3)
= ½Al(OH)3,
М(1/2 Al(OH)3)
= 39 г/моль.
,
поэтомуfэ(Al(OH)3)
= ½, Э(Al(OH)3)
= ½Al(OH)3,
М(1/2 Al(OH)3)
= 39 г/моль.
В реакции (10) fэ(Al(OH)3)=1/3,
Э = 1/3Al(OH)3, М(1/3Al(OH)3) = 26 г/моль.
Для средних солей
![]()
![]() ,где В
– валентность металла, образующего
соль, n
– число
его атомов.
,где В
– валентность металла, образующего
соль, n
– число
его атомов.
Например,
Na2SO4 - fэ(Na2SO4) = 1/2, Э(Na2SO4) = 1/2 Na2SO4,
M(1/2Na2SO4) = 71 г/моль
Al2(SO4)3 - fэ(Al2(SO4)3 = 1/(2 3) = 1/6,
Э(Al2(SO4)3 = 1/6 Al2(SO4)3, М(1/6 Al2(SO4)3) = 57 г/моль
СаСО3 - fэ (СаСО3) = 1/2, Э(СаСО3) = 1/2 СаСО3,
М(СаСО3)
= 50 г/моль![]()
Для кислых и основных солей fэ, Э и Мэ определяются по уравнению реакции, исходя из того что вещества вступают в реакцию в эквивалентных количествах.
Рассмотрим следующие реакции:
NaHSO4 + NaOH = Na2SO4 + H2O (11)
NaHSO4 + BaCl2 = BaSO4 + NaCl + HCl (12)
Al(OH)Cl2 + HCl =AlCl3 + H2O (13)
Al(OH)Cl2 + 2NaOH = Al(OH)3 = 2NaCl (14)
Al(OH)Cl2 + Na3PO4 = AlPO4 + 2NaCl + NaOH (15)
B реакции (11) одна молекула гидросульфата натрия взаимодействует с 1 эквивалентом NaOH, следовательно, fэ(NaHSO4) = 1, Э(NaHSO4) = NaHSO4, M(1NaHSO4) = 120 г/моль.
В реакции (12) одна молекула NaHSO4 взаимодействует с двумя эквивалентами хлорида бария, т.к. fэ(ВаCl2) = 1/2 и Э(BaCl2) = 1/2BaCl2, следовательно, fэ(NaHSO4) также равен 1/2 и Э(NaHSO4) = 1/2NaHSO4, M(1/2NaHSO4) = 60 г/моль.
В реакции (13) одна молекула дихлорида гидроксоалюминия взаимодействует с 1 эквивалентом HCl, поэтому fэ(Al(OH)Cl2) = 1, Э(Al(OH)Cl2) = Al(OH)Cl2, M(1 AlOHCl2) = 115 г/моль.
В реакции (14) одна молекула AlOHCl2 взаимодействует с двумя эквивалентами NaОН(fэ(NaOH) = 1), следовательно, fэ(AlOHCl2) = 1/2, Э(AlOHCl2) = 1/2 AlOHCl2, М(1/2 AlOHCl2) = 57,5 г/моль.
В реакции (15) одна молекула AlOHCl2 взаимодействует с тремя эквивалентами Na3PO4(fэ(Na3PO4) = 1/3), поэтому fэ(AlOHCl2) = 1/3, Э(AlOHCl2) = 1/3AlOHCl2, M(1/3AlOHCl2) = 38,3 г/моль.
Для оксидов,
проявляющих основные свойства, fэ
равен
![]()
где В - валентность металла, n - число атомов металла в оксиде,
например, CaO - fэ(СaO) = 1/2, Э(CaO) = 1/2 CaO,
M(1/2CaO) = 28 г/моль, Na2O - fэ(Na2O) = 1/2,
Э(Na2O) = 1/2Na2O, M(1/2Na2O) = 31 г/моль.
Al2O3 - fэ(Al2O3) = 1/6, Э(Al2O3) = 1/6 Al2O3,
M(1/6Al2O3) = 17 г/моль.
Для оксидов, проявляющих кислотные свойства, fэ по уравнению реакции:
SO3 + 2NaOH = Na2SO4 + H2O (16)
В реакции (16) одна молекула оксида серы (V1) взаимодействует с двумя эквивалентами гидроксида натрия (fэ(NaOH) = 1), cледовательно, fэ(SO3) = 1/2, Э(SO3) = 1/2SO3, M(1/2SO3) = 40 г/моль
Al2O3 + 2NaOH = 2NaAlO2 + H2O (17)
В реакции (17) одна молекула оксида алюминия взаимодействует с двумя эквивалентами гидроксида натрия, поэтому fэ(Al2O3) в данной реакции равен 1/2, Э(Al2O3) = 1/2 Al2O3, M(1/2Al2O3) = 51 г/моль.
Из всего сказанного можно сделать вывод, что фактор эквивалентности химического элемента и любого сложного вещества равен единице, деленной на число образующихся либо перестраивающихся связей .
Для кислот, оснований, средних солей и оксидов, проявляющих основные свойства, молярная масса эквивалентов может быть рассчитана как сумма молярных масс эквивалентов, составляющих данное соединение ионов (или элементов для оксидов).
Например, Мэ(H2SO4) реакции (6) равна:
Мэ(Н+) + Мэ(НSO-4) = M(1H+) + M(1HSO4-) = 98 г/моль
(fэ(иона) равен 1, деленной на заряд иона).
Мэ(H2SO4) в реакции (7) равна
Мэ(Н+) + Мэ(SO42-) = M(1H+) + M(1/2SO42-) = 49 г/моль
Мэ(Al(OH)3) в реакции (7) = Мэ(Al(OH)2+) + Mэ(OH-) = M(1Al(OH)2) + M(1OH-) = 78 г/моль
Мэ(Al(OH)3) в реакции (8) равна Мэ(AlOH2+) + Мэ(OH-) = M(1/2AlOH2+) + M(1OH-) = 39 г/моль.
Мэ(Al(OH)3) в реакции (9) равна Мэ(Al+3) +Mэ(OH-) = M(1/3 Al3+) + M(1OH-) = 26 г/моль.
Mэ(AL2(SO4)3) = Mэ(Al3+) + Mэ(SO42-) = M(1/3Al3+) + (1/2SO42-) = 57 г/моль.
Mэ(CaO) = Mэ(Ca2+) + Mэ(O2-) = M(1/2Ca2+) + M(1/2O2-) = 28 г/моль.
