

Таврический национальный университет им. В.И. Вернадского
Кафедра экспериментальной физики
Лабораторная работа № 1
ИЗУЧЕНИЕ ЗАКОНОМЕРНОСТЕЙ
В СПЕКТРАЛЬНЫХ ЛИНИЯХ
ВОДОРОДА
Симферополь 2002
Лабораторная работа № 1
ИЗУЧЕНИЕ ЗАКОНОМЕРНОСТЕЙ
В СПЕКТРАЛЬНЫХ ЛИНИЯХ ВОДОРОДА
1. ТЕОРЕТИЧЕСКОЕ ВВЕДЕНИЕ.
Излучение невзаимодействующих друг с другом атомов состоит из отдельных спектральных линий. По этой причине спектр испускания атомов называется линейчатым. Линии в спектрах атомов расположены не беспорядочно, а объединяются в группы – серии линий. Отчетливее всего это обнаруживается в спектре простейшего атома – водорода. На рис. 1. представлена часть спектра атомарного водорода в видимой и близкой ультрафиолетовой области.

Символами Hα, Hβ,H, Hδобозначены видимые линии,H∞указывает границу серии.
Швейцарский физик Бальмер в 1885 году обнаружил, что длины волн этой серии могут быть точно представлены формулой:
![]() (1)
(1)
где λ0– константа,n– целое число, принимающее значенияn=3,4,5,…
В спектроскопии принято характеризовать спектральные линии обратной длине волны величиной ν, которую называют волновым числом:
![]() (2)
(2)
Из (1) находим:
![]() (3)
(3)
где R=4/λ0= (10973730,9±1,2) м-1.
Величина Rназывается постоянной Ридберга, а формула (3) формулой Бальмера.
Изображенная на рис.1 серия, описываемая формулой (3), получила название серии Бальмера. В спектре водорода имеется еще несколько серий: серия Лаймана в ультрафиолетовой части спектра, серии Пашена, Брэкета и Пфунда в инфракрасной части спектра. В данной работе рассматривается только серия Бальмера.
Эмпирическая формула (3) может быть получена из элементарных теорий Бора. В 1913 году датский физик Нильс Бор высказал два постулата.
 1.
Из
бесконечного множества электронных
орбит, возможных с точки зрения
классической механики, осуществляются
в действительности только некоторые
дискретные орбиты, удовлетворяющие
условию: момент импульса электрона на
этих орбитах кратен постоянной Планка
( М = nħ,
n
– целое). Электрон, находящийся на этих
орбитах, не излучает электромагнитных
волн (света).
1.
Из
бесконечного множества электронных
орбит, возможных с точки зрения
классической механики, осуществляются
в действительности только некоторые
дискретные орбиты, удовлетворяющие
условию: момент импульса электрона на
этих орбитах кратен постоянной Планка
( М = nħ,
n
– целое). Электрон, находящийся на этих
орбитах, не излучает электромагнитных
волн (света).
2. Излучение испускается или поглощается в виде светового кванта энергии при переходе электрона из одного стационарного (устойчивого) состояния в другое. Величина светового кванта определяется разностью энергий тех стационарных состояний, между которыми совершается квантовый скачок электрона:
ħω=En-Ek.
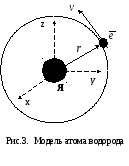
На рис.3. схематически изображен электрон, вращающийся вокруг ядра Я. Система координат связана с неподвижным ядром.
В
этой системе положение электрона в
пространстве задается радиус-вектором
![]() .
Как известно, модуль момента импульса
частицы, вращающейся по круговой орбите
радиуса r
со скоростью
.
Как известно, модуль момента импульса
частицы, вращающейся по круговой орбите
радиуса r
со скоростью ![]() равен:
равен:
![]()
Согласно первому постулату Бора:
![]() (4)
(4)
Число n называется главным квантовым числом.
Запишем 2-ой закон Ньютона для электрона, вращающегося вокруг ядра атома водорода:
![]() (5)
(5)
где
v2/r
– центростремительное ускорение, ![]() –
сила Кулона. Исключив v
из (4) и (5),получим выражение для радиусов
допустимых орбит:
–
сила Кулона. Исключив v
из (4) и (5),получим выражение для радиусов
допустимых орбит:
![]() (6)
(6)
Радиус
первой орбиты водородного атома
называется боровским
радиусом. Его значение равно: ![]() (1
Å (ангстрем) равен 10-10
м).
(1
Å (ангстрем) равен 10-10
м).
Энергия атома содержит кинетическую энергию электрона и кулоновскую энергию взаимодействия электрона с ядром:
![]() (7)
(7)
Из (5) следует:
![]() (8)
(8)
Следовательно:
![]() (9)
(9)
Подставив в (9) выражение (6), получим дозволенные значения внутренней энергии атома:
![]() (10)
(10)
Согласно второму постулату Бора при переходе электрона из состояния n в состояние k , излучается фотон с энергией:
![]() (11)
(11)
Частота испущенного света равна:
![]() (12)
(12)
Переходя
к волновым числам и длинам волн ![]() ,
находим:
,
находим:
![]() (13а)
(13а)
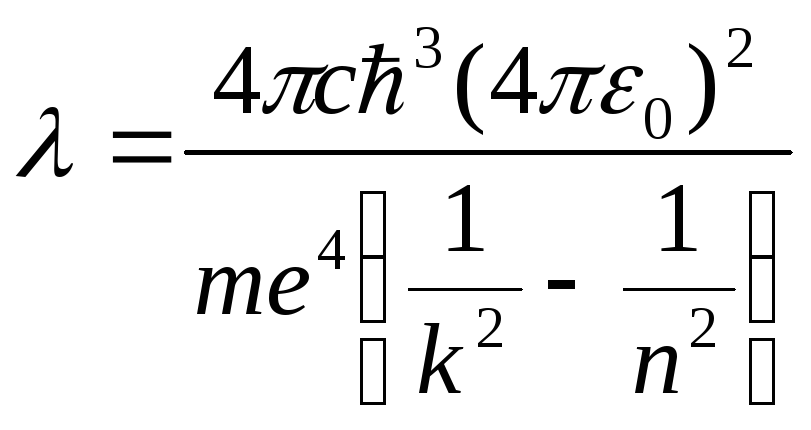 (13б)
(13б)
В данной работе изучается серия Бальмера (рис.2), для которой k = 2, а n принимает значения 3, 4, 5 …
Задача состоит в том, чтобы сфотографировать серию Бальмера, экспериментально определить ν или λ для этой серии и сравнить полученные результаты с теоретическими данными.
