
курсак жозика / 0904_155
.pdf
ХИМИЯ РАСТИТЕЛЬНОГО СЫРЬЯ. 2009. №4. С. 155–158.
УДК 547.918
ИДЕНТИФИКАЦИЯ И КОЛИЧЕСТВЕННОЕ ОПРЕДЕЛЕНИЕ ДИТЕРПЕНОВЫХ ГЛИКОЗИДОВ В РАСТЕНИИ СТЕВИЯ
(STEVIA REBAUDIANA BERTONI)
©М.Р. Ванидзе, А.Г. Каландия*, Х.Р. Чануквадзе
Государственный университет им. Шота Руставели, ул. Ниношвили, 35,
Батуми, 6010 (Грузия) E-mail: aleko.kalandia@Gmail.com
Методом жидкостной хроматографии высокого давления в разных частях выращенных в Грузии растений стевии (Stevia rebaudiana Bertoni) идентифицировано и количественно определено содержание дитерпеновых гликозидов: стевиозида 5,5–6,0% и ребаудиозида А 4,0–4,5%. Максимальное количество сладких дитерпеновых гликозидов накапливается в зрелых листьях.
Ключевые слова: стевия (Stevia rebaudiana Bertoni), листья, дитерпеновые гликозиды, стевиозид, ребаудиозида А, идентификация, количественный анализ.
Введение
Широкий интерес к новому для влажных субтропиков Грузии растению стевия (Stevia rebaudiana Bertoni) обусловлен наличием в нем соединений, имеющих интенсивно сладкий вкус. Они представлены в основном в виде восьми водорастворимых дитерпеновых гликозидов: стевиозид, стевиолбиозид, дулькозид и ребаудиозид [1]. Их агликоном является стевиоль (13-гидрокси, энт-каурен-16,18 карбоновая кислота). Из этих соединений количественное значение имеют стевиозид (13-О-β-D-глюкопиранозил (1-2)-β-D- глюкопиранозил, 19-оксо-О-β-D-глюкопиранозил, энт-каурен-16) и ребаудиозид А (13-О-β-D-глюко- пиранозил (1-2)-О-β-D-глюкопиранозил(1-3)-О-β-D-глюкопиранозил, 19-оксо-О-β-D-глюкопиранозил, энт-
каурен-16) [2, 3].
У стевиола в С13 и С19 положениях присоединена глюкоза. В положении С13 один моносахаридный остаток, а в положении С19 – два или три. Эти соединения в 50–400 раз слаще сахарозы, стабильны при нагревании, изменении рН, в насыщенных СО2 напитках и т.д. Во многих странах мира они применяются в качестве пищевых добавок при профилактике диабета и ожирения [4, 5].
Стевия (Stevia rebaudiana Bertoni) представляет собой травянистое многолетнее растение. В природных условиях это куст высотой до 80 см. Расположение листьев параллельное. Листья эллипсоидной, продолговатой формы с зубчатыми краями, характеризуются специфическим сладким вкусом [6, 7].
Экспериментальная часть
Объектом исследования являются листья интродуцированных в Грузии растений стевии (Stevia rebaudiana Bertoni) (рис. 1).
Образцы для исследований брали на испытательном участке университета, в селах Патара Поти Хобского района, Анаклиа Зугдидского района, Грмагеле Ланчхутского района, Ахалсопели Сенакского района (Западная Грузия).
С целью инактивации ферментов растительные образцы фиксировали водяным паром в течение 1 мин, затем сушили при комнатной температуре и измельчали. Исследование сладких дитерпеноидных гликозидов листьев стевии проводили по схеме, представленной на рисунке 2.
* Автор, с которым следует вести переписку.

156 |
М.Р. ВАНИДЗЕ, А.Г. КАЛАНДИЯ, Х.Р. ЧАНУКВАДЗЕ |
А |
|
Б |
Рис. 1. Стевия (Stevia rebaudiana Bertoni): А) в открытом грунте; Б) цветок стевии
Рис. 2. Схема разделения терпеноидных соединений стевии
Листья стевии (5 г) измельчали, обрабатывали в аппарате Сокслета хлороформом (300 мл) в течение 2 ч, далее метанолом (300 мл) в течение 5 ч, затем водой (30 мл). Полученный экстракт фильтровали и концентрировали в условиях вакуума. Хлороформные и водяные экстракты не содержат сладких терпеноидных гликозидов. Метанольные экстракты перекристаллизировали трижды, растворяли в метаноле (10 мл), фильтровали через мембранные фильтры (0,45 мкр). Высокоэффективную тонкослойную хроматографию производили на тонком слое силикагеля (Меrс), система растворителей: хлороформ – метанол – вода (30 : 20 : 4). Хроматограму проявляли 10% серной кислотой (рис. 3). При хроматографировании применяли растворители: 1) хлороформ – метанол – вода (30 : 20 : 4); 2) этилацетат – изопропанол – н-бутанол – вода
(20 : 12 : 7 : 6).
Исследование терпеноидных соединений осуществляли методом жидкостной хроматографии высокого давления (рис. 4). Хроматографирование проводили на хроматографе Beckman (USA), детектор MilliporeWаters 210 нм, хроматографические колонки Bordapac C18; Bordapac NH2. Системы растворителей: 1) метанол – вода (65 : 35); 2) ацетонитрил – вода (85 : 15); 3) ацетонитрил – вода (40 : 60).
После проявления пластинки нагревали до 110 °С и денситометрировали при 390 нм. В таблице 1 приведены значения Rf этих соединений (окраска экстракта после обработки H2SO4 темная). Идентификация сладких дитерпеноидных гликозидов стала возможной на основе сопоставления литературных данных с показателями аутентичных соединений (стевиозид и ребаудиозид А).
ИДЕНТИФИКАЦИЯ И КОЛИЧЕСТВЕННОЕ ОПРЕДЕЛЕНИЕ… |
157 |
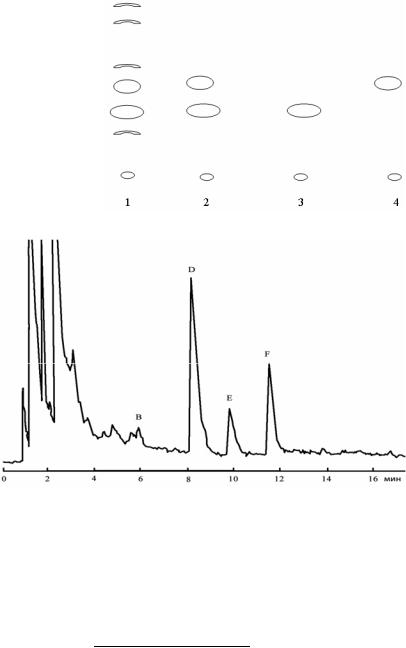
Рис. 3. Схематическое изображение тонкослойной хроматограммы. Система растворителей: хлороформ – метанол – вода (30 : 20 : 4).
1 – Экстракт стевии; 2 – Смесь стевиозида и ребаудиозида; 3 – Стевиозид; 4 – Ребаудиозид А
Рис. 4. Хроматограмма сладких дитерпеноидных соединений стевии. Хроматографическая колонка Bondapac C18,
детектирование при 210 нм
Для стевиозида значение Rf равно 0,75, а для ребаудиозида – 0,80. Опрыскивание серной кислотой, естественно, вызывает образование темных пятен на хроматограмме. Сладкие дитерпеноидные гликозиды в УФ-свете имеют максимум поглощения при 210 нм. Жидкостная хроматография высокого давления позволяет провести анализ в течение 20–30 мин, при этом разделяются все основные дитерпеноидные гликозиды.
Результаты и обсуждение
Таблица 1. Хроматографическая характеристика сладких терпеноидных гликозидов стевии
Наименование |
Значение Rf |
Лист стевии В1 |
0,75 |
Лист стевии В2 |
0,8 |
Ребаудиозид А |
0,8 |
Стевиозид |
0,75 |
Посадка саженцев стевии в условиях Грузии производится в апреле. На 1 га сажают 50–70 тыс. саженцев. Определение оптимального периода уборки урожая крайне важно, чтобы урожай и содержание в растениях сладких дитерпеноидных гликозидов были максимальными. Зафиксировано содержание сладких дитерпеноидных гликозидов на всех этапах роста и развития стевии. Количество этих соединений возрастает до начала цветения, а затем чуть снижается (рис. 5), поэтому для уборки урожая оптимальным можно считать период бутонизации, который в условиях Грузии приходится на сентябрь.
В стевии сладкие дитерпеноидные соединения распределены неравномерно. Основная их часть рассредоточена в зрелых листьях, которые во время бутонизации растения составляют 35% от общей массы. Зрелые листья накапливают основную часть сладких веществ, в 9–12-м листьях насчитывается более 70% терпеноидов от их общего содержания (табл. 2). В стеблях концентрация сладких гликозидов низкая (0,1%), поэтому перерабатывать их дальнейшем нет смысла (общая доля стебля – 40%). Особо интересен тот факт, что ребаудиозиды составляют почти половину, общего содержания сладких дитерпеноидных соединений. Они смягчают специфическую интенсивную сладость листьев и полученных из них препаратов.

158 |
М.Р. ВАНИДЗЕ, А.Г. КАЛАНДИЯ, Х.Р. ЧАНУКВАДЗЕ |
|
|
Рис. 5. Изменение сладких дитерпеноидных |
|||
|
|
гликозидов во время вегетации листьев стевии |
|||
Таблица 2. Содержание сладких дитерпеноидных гликозидов в разных частях стевии |
|
||||
Соединение |
|
Доля в общей массе, % |
|
% от общего |
|
Часть растения |
дулкозиды |
ребаудиозид A |
ребаудиозид C |
стевиозид |
содержания |
Флешь и 1-й лист |
– |
0,38 |
0,05 |
0,57 |
1,1 |
2–4-й листья |
0,01 |
0,39 |
0,05 |
0,55 |
11,0 |
5–8-й листья |
0,01 |
0,41 |
0,05 |
0,53 |
10,5 |
Боковые зрелые листья |
– |
0,42 |
0,03 |
0,55 |
11,0 |
9–11-й листья |
0,1 |
0,4 |
0,03 |
0,47 |
14,8 |
12-й и ниже листья |
– |
0,3 |
0,01 |
0,49 |
14,6 |
Стебель |
– |
0,42 |
0,02 |
0,56 |
0,2 |
Корни |
– |
– |
– |
– |
0 |
Выводы
Нами установлено, что в листьях нового для влажных субтропиков Грузии растения стевия (Stevia rebaudiana Bertoni) содержится до 11%сладких дитерпеноидных соединений. Сладкие дитерпеноиды в разных частях растения накапливаются по-разному. Максимальное содержание этих соединений обнаружено в зрелых листьях.
Список литературы
1.Kohda H., Kasai R., Yamasaki K., Murakami K. and Tanaka O. New sweet diterpene glycosides from Stevia rebaudiana // Phytochemistry. 1976. V. 15. P. 981–983.
2.Mosettig E. and Nes W.R. Stevioside. II. The structure of the aglucone // J. Org. Chem. 1955. V. 20. P. 884–899.
3.Hodge J.E. and Inglett G.E. Structural aspects of glycosides sweeteners containing (1'2)-linked disaccharides // In Inglett, G.E. (ed.) Symposium Sweeteners. The Avi Publishing Company, Inc. Conn. 1974. P. 216–234.
4.Chang K.F., Howard R.J. and Gaudiel R.G. First report of stevia as a host for Sclerotinia sclerotiorum // Plant Disease. 1997. V. 81. P. 311.
5.Chang S.S. and Cook J.M. Stability studies of stevioside and rebaudioside A in carbonated beverages // J. Agric. Food Chem. 1983. V. 31. P. 409–412.
6.Huang Y.S. and Guo A.G. Investigation and production on the type R-A steviosides // Journal of Plant Resources and Environment. 1996. V. 5(4). P. 29–32.
7.Sakamoto I., Yamasaki K. and Tanaka O. Application of 13C NMR spectroscopy to chemistry of natural glycosides: re- baudioside-C, a new sweet diterpene glycoside of Stevia rebaudiana // Chem. Pharm. Bull. 1977. V. 25. P. 844–846.
Поступило в редакцию 16 февраля 2009 г.
