
pat_phy_book
.pdfнарушение ее функций, вследствие чего развивается анемия, лейкопения и тромбоцитопения (поскольку нарушается регуляция кроветворения,
элиминация из крови старых форменных элементов и т.д.). Сочетание спленомегалии с этими изменениями в системе крови получило название гиперспленизма. При далеко зашедшем циррозе печени, почти всегда,
наблюдается асцит, происхождение которого связывают с гемодинамическим
(застойные явления в портальной системе), гормональным (депонирование крови в брюшной полости ведет к активации ренин-ангиотензин-
альдостероновой системы и задержке Na и воды в организме) и возможным дефицитом натрий-уретического гормона, вырабатываемого печенью.
К важнейшим проявлениям цирроз печени относятся печеночная
(паренхиматозная) желтуха и геморрагический диатез (кровоточивость слизистой носа и десен, подкожные петехии и кровоизлияния,
локализованная или генерализованная пурпура).
Изменяются биохимические показатели функционального состояния печени. Наиболее характерны диспротеинемия за счет гипоальбуминемии и гипергаммаглобулинемии, снижение активности холинэстеразы, повышение активности печеночных трансаминаз и концентрации прямого билирубина в крови, возрастание СОЭ.
Практически всегда при циррозе печени развивается печеночная недостаточность с гепатоцеребральным синдромом.
Погибают больные при циррозе печени, главным образом, от инфекционно-септических осложнений и кровотечения из варикозно расширенных вен пищевода и желудка.
16.3. Недостаточность печени
При заболеваниях печени различной этиологии происходит нарушение основных биохимических процессов, протекающих в этом органе, изменение
401

или выпадение ее функций. В тяжелых случаях развивается состояние,
которое обозначается как недостаточность печени.
Печеночная недостаточность – это состояние, при котором происходит снижение одной или нескольких функций печени ниже уровня, необходимого для обеспечения нормальной жизнедеятельности организма
По течению различают острую и хроническую, а по количеству
нарушенных функций – парциальную и тотальную печеночную недостаточность.
Этиология. Выделяют две группы причин, ведущих к развитию печеночной недостаточности: печеночные и внепеченочные. К первой
группе относятся патологические процессы, локализующиеся в печени и желчевыводящих путях. Прежде всего, это – гепатиты вирусной природы
(эпидемический гепатит или болезнь Боткина); реже возбудителями гепатитов могут являться бактерии, спирохеты, риккетсии. Нередко встречаются токсические гепатиты, развивающиеся при воздействии
токсических гепатотропных веществ: лекарственных препаратов
(антибиотиков, сульфаниламидов, туберкулостатиков, транквилизаторов,
наркотических веществ), промышленных ядов (CCl4, бензола, толуола,
хлороформа, эфира, нитрокрасок, свинца и др.), бытовых ядов (грибные токсины, этиловый спирт). К первой группе причин относятся также
дистрофии (гепатозы), циррозы печени, камни, опухоли или воспаления желчевыводящих путей с выраженным холестазом, генетические дефекты гепатоцитов.
Ко второй группе причин печеночной недостаточности относятся
патологические процессы, локализирующиеся вне печени: экстремальные
состояния |
(шок, коллапс, сепсис, обширные травмы, ожоги), хроническая |
сердечная |
или почечная недостаточность, белковое голодание, |
402
гиповитаминоз Е, нарушение печеночного кровообращения и портальной гипертензии.
В патогенезе печеночной недостаточности, кроме свободнорадикальной деструкции гепатоцитов и их органелл, важную роль отводят образованию противопеченочных аутоантител и аутосенсибилизированных Т-киллеров, которые вызывают дополнительное аутоаллергическое повреждение гепатоцитов.
Проявления. При печеночной недостаточности нарушаются все виды обмена веществ.
Расстройства углеводного обмена выражаются в снижении способности гепатоцитов к синтезу гликогенов из моносахаридов с одной стороны, а с другой, к расщеплению гликогена до глюкозы. Происходит также подавление глюконеогенеза в печени. В совокупности это приводит к характерному признаку печеночной недостаточности – нестабильному уровню глюкозы в крови (после приема пищи – гипергликемия, а натощак – гипогликемия).
Нарушения липидного обмена характеризуется снижением способности клеток печени превращать свободный холестерин в его менее атерогенную форму (холестеринэстер) и синтезировать антиатерогенные фосфолипиды. Это ведет к увеличению в крови содержания свободного холестерина, что способствует развитию атеросклероза.
Кроме этого, при печеночной недостаточности часто наблюдается
ожирение печени. Одной из основных причин которого является нарушение синтеза липопротеидов, образующихся из белков и фосфолипидов.
Нарушения белкового обмена включают три вида изменений:
-снижение синтеза гепатоцитами альбуминов, что ведет к гипоальбуминемии, диспротеинемии и гипоонкии крови, а также способствует развитию асцита при наличии портальной гипертензии;
-уменьшение синтеза прокоагулянтов, ферментов и белков,
участвующих в процессе свертывания крови (фибриногена,
403
протромбина, проакцелерина, проконвертина), что сопровождается развитием коагулопатий. Этому также способствует уменьшение всасывания в кишечнике жирорастворимого витамина К, т.к.
печеночная недостаточность, как правило, сочетается с расстройством желчеобразования и желчевыделения.
- снижение активности процесса дезаминирования аминокислот и синтеза мочевины из аминогрупп и аммиака и свободных аминокислот.
Нарушения ферментного обмена. При повреждении гепатоцитов наблюдается как уменьшение синтеза и секреции печеночными клетками холинэстеразы, НАД, НАДФ, так и увеличение выхода из них маркерных печеночных ферментов (орнитин- и карбамилтрансферазы, аргиназы) и
трансаминаз (особенно аланиновой, глютаминовой и аспарагиновой).
Нарушения антитоксической (барьерной) функции печени выражаются в повышении содержания в крови разнообразных токсических продуктов обмена в связи с подавлением обезвреживания их печенью.
Печеночная кома представляет собой наиболее тяжелое проявление функциональной недостаточности печени, характеризующееся токсическим поражением центральной нервной системы с глубокими нервно-
психическими нарушениями, судорогами, потерей сознания, расстройством жизнедеятельности организма.
Этиология. Вирусный гепатит В, ни А ни В, С, Д; Болезнь Васильева-
Вейля (желтушный лептоспироз); токсическая дистрофия печени; отравление гепатотропными ядами (ядовитые грибы, четыреххлористый углерод,
промышленные яды, алкоголь и др.); сепсические состояния с гемолизом;
первичный и метастатический рак печени; механическая желтуха различной этиологии; обширные травмы, ожоги, размозжение тканей; цирроз печени;
тромбоз воротной вены, острое расстройство печеночного кровообращения,
синдром портальной гипертензии.
404
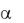
Патогенез. 1. Нарушение антитоксической функции гепатоцитов:
накопление в крови церебротоксических веществ: аммиака (угнетает окислительные процессы в головном мозге, так как, соединяясь с -
кетоглутаровой кислотой – образуется глутаминовая кислота – освобождает ее от участия в цикле трикарбоновых кислот), короткоцепочечных жирных кислот, фенолов, меркоптана, ацетона, бутиленгликоля и т.д. 2.
Гипогликемия, усугубляющая дефицит энергии в мозге. 3. Нарушение кислотно-щелочного равновесия (метаболический ацидоз, внутриклеточный и внеклеточный метаболический алкалоз, что усиливает поступление в клетки мозга свободного аммиака). 4. Гипоксемия. 5. Нарушение функции почек, усугубляющее метаболическую энцефалопатию. 6. Нарушение водно-
электролитного баланса (гипокалиемия как следствие вторичного гиперальдостеронизма, возникающего при снижении участия пораженной печени в метаболизме альдостерона), что способствует проникновению токсического свободного аммиака в клетки головного мозга.
В динамике развития печеночной комы различают три стадии.
І стадия – прекома: чувство тревоги, тоски, страха смерти; эйфория или подавленность, апатия; извращение суточного режима (днем спят, а
ночью бодрствуют); повышенная раздражительность и быстрая психическая истощаемость больных, ухудшение памяти; затруднение речи; неприятный вкус во рту; усиление желтухи, зуд; выраженный диспептический синдром;
боли в животе; икота, зевота; клинические проявления основного заболевания, приведшего к прекоме; в некоторых случаях – повышенная кровоточивость. При биохимическом исследовании крови обнаруживается глубокое расстройство функций печени.
ІІ стадия – угрожающая кома: спутанность сознания (дезориентация во времени, пространстве, лицах); приступы возбуждения с бредом и последующей сонливостью, депрессией; галлюцинации; нарушения координации движений; нистагм, «хлопающий» тремор пальцев рук и ног;
резко выраженная желтуха; дыхания Куссмауля; печеночный запах изо рта;
405

резкое уменьшение размеров печени по сравнению с исходным;
геморрагический синдром; артериальная гипотензия; повышение температуры тела.
ІІІ стадия – собственно кома (полная кома): полная потеря сознания;
широкие зрачки; появление патологических рефлексов (Бабинского,
хватательный, сосательный), исчезновение хлопающего тремора; олиго-,
анурия; желтуха, печеночный запах изо рта; геморрагический синдром;
дыхание Куссмауля может смениться дыханием Чейна-Стокса.
Поскольку способность печени к регенерации чрезвычайно велика,
организм может самостоятельно выйти из состояния печеночной комы,
которая через некоторое время развивается повторно, и, в конце концов,
больной погибает.
16.4. Нарушение желчеобразования, желчевыделения и обмена желчных
пигментов
Нарушение желчеобразовательной и желчевыделительной функции печени проявляется в увеличении или уменьшении секреции желчи, как правило, с одновременным изменением ее состава.
Образование и выделение желчи – специфическая функция печени. В
состав желчи входят холестерин, соли желчных кислот, желчные пигменты, а
также фосфолипиды и незначительное количество белка.
Холестерин – высокомолекулярный ненасыщенный спирт,
производное холестана, является обязательным компонентом желчи.
Основное место его синтеза в организме – печень и кишечник, в которых образуется 90% эндогенного холестерина. Синтез происходит на эндоплазматической сети гепатоцитов. Часть холестерина человек получает с пищей. Холестерин является исходным материалом для синтеза других стероидов, в частности желчных кислот.
406
Желчные кислоты – высокомолекулярные кристаллические соединения, относящиеся к стеринам, образуются в печени. Желчные кислоты содержатся в желчи в парных соединениях с гликоколом и таурином. Основными желчными кислотами в организме человека являются холевая, дезоксихолевая, хенодезоксихолевая и литохолевая.
 участвуют в переваривании и всасывании жиров;
участвуют в переваривании и всасывании жиров;
 стимулируют моторную функцию кишечника;
стимулируют моторную функцию кишечника;
 улучшают всасывание жирорастворимых витаминов.
улучшают всасывание жирорастворимых витаминов.
Желчные пигменты – билирубин и биливердин - также образуются в печени. Основным источником билирубина у человека является гемоглобин,
в состав которого входит молекула белка (глобин) и 4 молекулы гема.
Из биливердина, который в свою очередь представляет собой продукт окислительно-восстановительной трансформации гемоглобина эритроцитов,
образуется непрямой (свободный) билирубин.
Непрямым билирубин называется в связи с тем, что нерастворимый в воде он находится в плазме в комплексном соединении с транспортным белком альбумином и не дает прямой реакции с диазореактивом Эрлиха.
Свободный билирубин является основным желчным пигментом,
находящимся в норме в крови.
Превращение гемоглобина в желчный пигмент происходит главным образом в РЭС печени и частично в клетках РЭС костного мозга селезенки и других органов. Следовательно, содержание непрямого билирубина зависит от интенсивности гемолиза эритроцитов.
В течение суток у человека разрушается около 1% циркулирующих эритроцитов и в результате образуется 100-250 мг непрямого билирубина. В
норме его концентрация в крови не превышает 16 мкмоль/л. Клетки печени захватывают свободный билирубин из крови и превращают его в прямой или
связанный билирубин посредством соединения первого с двумя молекулами глюкуроновой кислоты. Поскольку такой связанный с глюкуроновой кислотой билирубин не соединен с белком, он дает прямую реакцию с
407
диазореактивом Эрлиха и может в небольшом количестве в норме содержаться в крови (до 5,0 мкмолей/л) за счет обратного возвращения в кровеносные капилляры, но в целом связанный билирубин находится только
вжелчи.
Вверхних отделах тонкого кишечника и желчевыводящих путях под влиянием бактериальных дегидрогеназ прямой билирубин превращается в бесцветные хромогены: уробилиногоген и стеркобилиноген. Последние,
окисляясь на воздухе в моче и кале, превращаются в оранжево-желтые пигменты – уробилин и стеркобилин, придавая моче соломенно-желтый, а
калу – коричневый цвет. Если нарушается поступление желчи в кишечник, то уробилин в моче и стеркобилин в кале отсутствуют.
Биологическое значение процесса глюкоронизации билирубина заключается в повышении его растворимости, что способствует экскреции в желчь и снижении его токсичности. Нарушение обмена билирубина обычно приводит к повышению его содержания в крови – билирубинемии, а
нарушение образования желчи в печени и синтеза ее составных частей, а
также выделение желчи через желчные протоки в кровь проявляется в виде желтухи.
Общие причины нарушения желчеобразовательной функции печени:
 изменение нейрогуморальной регуляции холепоэза (например,
изменение нейрогуморальной регуляции холепоэза (например,
увеличение холепоэза при усилении тонуса блуждающего нерва);
 алиментарные факторы (белковое голодание, чрезмерное употребление жиров и яичных желтков);
алиментарные факторы (белковое голодание, чрезмерное употребление жиров и яичных желтков);
 некоторые лекарственные препараты (сорбит, настои кукурузных рылец);
некоторые лекарственные препараты (сорбит, настои кукурузных рылец);
 отравление цианидами, 2,4-динитрофенолом;
отравление цианидами, 2,4-динитрофенолом;
 заболевания печени, приводящие к нарушению секреторной функции гепатоцитов (дистрофия и деструкция), снижению
заболевания печени, приводящие к нарушению секреторной функции гепатоцитов (дистрофия и деструкция), снижению
408
энергетического обмена в клетках и изменению реабсорбции компонентов желчи (гепатит, холангит, холецистит, гепатоз);
 гипоксия, гипо- и гипертермия, нарушающие энергетический обмен в организме, в том числе и в печени;
гипоксия, гипо- и гипертермия, нарушающие энергетический обмен в организме, в том числе и в печени;
 снижение активности кишечной микрофлоры;
снижение активности кишечной микрофлоры;
 нарушения образования и обмена билирубина и желчных кислот и изменения их содержания в желчи.
нарушения образования и обмена билирубина и желчных кислот и изменения их содержания в желчи.
Главными звеньями патогенеза, обусловливающими количественные и качественные нарушения желчеобразования, являются изменения секреторной активности гепатоцитов, нарушение реабсорбции компонентов желчи в желчевыводящих путях и кишках, а также сдвиги в транс- и
интерцеллюлярной фильтрации некоторых веществ из крови в печеночные капиллярные сосуды.
Нарушение желчевыделения возможно в следующих случаях:
 нарушение иннервации желчевыводящих путей (например,
нарушение иннервации желчевыводящих путей (например,
уменьшение желчевыделения при спазме сфинктера шейки желчного пузыря);
 изменение гуморальной регуляции желчевыделения
изменение гуморальной регуляции желчевыделения
(желчевыделение усиливается при гиперпродукции секретина,
холецистокинина, мотилина);
 механическое препятствие оттоку желчи при сдавливании желчевыводящих путей извне (опухолью головки поджелудочной железы, воспаленной тканью, рубцом) или их закупорке (камнем,
механическое препятствие оттоку желчи при сдавливании желчевыводящих путей извне (опухолью головки поджелудочной железы, воспаленной тканью, рубцом) или их закупорке (камнем,
гельминтами, густой желчью).
Нарушение желчеобразования и желчевыделения проявляются в виде сложных симптомокомплексов (синдромов): желтухи, ахолии, холемии,
дисхолии.
409

16.5. Желтуха
Желтуха (icterus) - синдром, характеризующийся желтой окраской кожи, слизистой оболочки, склеры в результате отложения в них желчных пигментов (преимущественно билирубина) при нарушении желчеобразования и желчевыделения
Этиологические факторы подразделяют на внутрипеченочные
(метастазы рака, гепатиты, цирроз, камни желчных протоков, паразитарные поражения) и внепеченочные (опухоли желчного пузыря и общего желчного протока, камни общего желчного протока, рак поджелудочной железы и др.).
По механизму возникновения различают три вида желтухи:
печеночную (паренхиматозная), вызванную нарушением образования и выведения желчи печеночными клетками при их повреждении, холестазе и энзимопатиях; механическую (подпеченочная, обтурационная), возникающую в результате механического препятствия выделению желчи по желчевыводящим путям; гемолитическую (надпеченочная), связанную с повышением желчеобразования при усиленном распаде эритроцитов и гемоглобинсодержащих нормобластов.
Механическая желтуха. Этот вид желтухи развивается в тех случаях,
когда затрудняется выведение желчи из желчных капилляров, желчного пузыря или его протока в 12-перснтную кишку, что имеет место при наличии камней или опухоли в желчевыводящих путях, холециститах, дискинезиях желчевыводящих путей, опухолях головки поджелудочной железы.
Механическое препятствие оттоку желчи приводит к застою и повышению давления желчи, в желчных капиллярах, их перерастяжением,
повышением проницаемости стенок и диффузии компонентов желчи в кровеносные капилляры. В случаях полной обтурации желчевыводящих путей возможен разрыв желчных капилляров и выход из них желчи. При
410
